LEGE Nr. 95
din 14 aprilie 2006
privind reforma in domeniul
sanatatii
ACT EMIS DE:
PARLAMENTUL ROMANIEI
ACT PUBLICAT IN:
MONITORUL OFICIAL NR. 372 din 28 aprilie 2006
Parlamentul României adoptă
prezenta lege.
TITLUL I
Sănătatea publică
CAPITOLUL I
Dispoziţii generale
Art. 1. - Obiectul prezentului titlu îl constituie reglementarea domeniului sănătăţii publice, obiectiv de interes social
major.
Art. 2. - (1) Asistenţa de sănătate publică reprezintă
efortul organizat al societăţii în vederea protejării şi promovării sănătăţii
populaţiei. Asistenţa de sănătate publică se realizează prin ansamblul
măsurilor politico-legislative, al programelor şi strategiilor adresate
determinanţilor stării de sănătate, precum şi prin organizarea instituţiilor
pentru furnizarea tuturor serviciilor necesare.
(2) Scopul asistenţei de sănătate publică îl
constituie promovarea sănătăţii, prevenirea îmbolnăvirilor şi îmbunătăţirea
calităţii vieţii.
(3) Strategia sistemului sănătăţii publice urmăreşte
asigurarea sănătăţii populaţiei în cadrul unor comunităţi sănătoase.
(4) Asistenţa de sănătate publică este o componentă a
sistemului de sănătate publică.
(5) Ministerul Sănătăţii Publice reprezintă
autoritatea centrală în domeniul sănătăţii publice.
(6) In cuprinsul actelor normative în vigoare
denumirea „Ministerul Sănătăţii" se înlocuieşte cu denumirea „Ministerul
Sănătăţii Publice", iar sintagma „ministrul sănătăţii", cu sintagma
„ministrul sănătăţii publice".
(7) Asistenţa de sănătate publică este coordonată de
către Ministerul Sănătăţii Publice şi se realizează prin toate tipurile de
unităţi sanitare de stat sau private, constituite şi organizate conform legii.
(8) Responsabilitatea pentru asigurarea sănătăţii
publice revine Ministerului Sănătăţii Publice, autorităţilor de sănătate
publică teritoriale, precum şi autorităţilor de sănătate publică din cadrul
ministerelor şi instituţiilor cu reţea sanitară proprie.
(9) Asistenţa de sănătate publică este garantată de
stat şi finanţată de la bugetul de stat, bugetele locale, bugetul Fondului
naţional unic de asigurări sociale de sănătate sau din alte surse, după caz,
potrivit legii.
Art. 3. - Protecţia sănătăţii publice constituie o
obligaţie a autorităţilor administraţiei publice centrale şi locale, precum şi
a tuturor persoanelor fizice şi juridice.
Art. 4. - (1) In înţelesul prezentului titlu, termenii
şi noţiunile folosite au următoarea semnificaţie:
a) sănătatea publică - starea de sănătate a populaţiei în raport cu determinanţii stării
de sănătate: socio-economici, biologici, de mediu, stil de viaţă, asigurarea cu
servicii de sănătate, calitatea şi accesibilitatea serviciilor de sănătate;
b) promovarea sănătăţii - procesul care oferă individului şi colectivităţilor posibilitatea
de a-şi controla şi îmbunătăţi sănătatea sub raport fizic, psihic şi social şi
de a contribui la reducerea inechităţilor în sănătate;
c) supravegherea - activitatea
de colectare sistematică şi continuă, analiza, interpretarea şi diseminarea
datelor privind starea de sănătate a populaţiei, bolile transmisibile şi
netransmisibile, pe baza cărora sunt identificate priorităţile de sănătate
publică şi sunt instituite măsurile de prevenire şi control;
d) evaluarea riscurilor
pentru sănătate - estimarea gradului în care
expunerea la factorii de risc din mediul natural, de viaţă şi de muncă şi la
cei rezultaţi din stilul de viaţă individual şi comunitar influenţează starea
de sănătate a populaţiei;
e) inspecţia sanitară - exercitarea controlului aplicării prevederilor legale de sănătate
publică;
f) principiul precauţiei
- instrumentul prin care autoritatea de sănătate
publică decide şi intervine în situaţii în care se apreciază că există un
potenţial risc pentru sănătatea populaţiei, în condiţiile unei argumentaţii
ştiinţifice insuficiente.
(2) In sensul prevederilor prezentului titlu, precum şi
al prevederilor din cuprinsul prezentei legi, prin ministere
şi instituţii cu reţele sanitare proprii se înţelege
autorităţile şi instituţiile care au în subordine unităţi sanitare, altele
decât Ministerul Sănătăţii Publice, respectiv Ministerul Apărării Naţionale,
Ministerul Administraţiei şi Internelor, Ministerul Justiţiei, Ministerul
Transporturilor, Construcţiilor şi Turismului, Serviciul Român de Informaţii,
Serviciul de Informaţii Externe, Serviciul de Telecomunicaţii Speciale şi
Academia Română.
Art. 5. - Funcţiile principale ale asistenţei de
sănătate publică vizează:
a) dezvoltarea politicilor, strategiilor şi
programelor vizând asigurarea sănătăţii publice;
b) monitorizarea şi analiza stării de sănătate a
populaţiei;
c) planificarea în sănătatea publică;
d) supravegherea
epidemiologică, prevenirea şi controlul bolilor;
e) managementul şi marketingul strategic al
serviciilor de sănătate publică;
f) reglementarea domeniului sănătăţii publice,
aplicarea şi controlul aplicării acestei reglementări;
g) asigurarea calităţii
serviciilor de sănătate publică;
h) cercetarea-dezvoltarea şi implementarea de soluţii
inovatoare pentru sănătatea publică;
i) prevenirea epidemiilor, inclusiv instituirea stării
de alertă epidemiologică;
j) protejarea populaţiei împotriva riscurilor din mediu;
k) informarea, educarea şi comunicarea pentru
promovarea sănătăţii;
l) mobilizarea partenerilor
comunitari în identificarea şi rezolvarea problemelor de sănătate;
m) evaluarea calităţii, eficacităţii, eficienţei şi
accesului la serviciile medicale;
n) dezvoltarea şi planificarea resurselor umane şi
dezvoltarea instituţională pentru sănătate publică;
o) integrarea priorităţilor de sănătate publică în
politicile şi strategiile sectoriale de dezvoltare durabilă;
p) asigurarea capacităţilor de răspuns la dezastre sau
la ameninţările la adresa vieţii şi sănătăţii populaţiei, inclusiv prin
introducerea de restricţii de circulaţie a persoanelor şi bunurilor.
Art. 6. - Principalele domenii de intervenţie ale
asistenţei de sănătate publică sunt următoarele:
a) prevenirea, supravegherea şi controlul bolilor
transmisibile şi netransmisibile prin:
1. asigurarea imunizărilor;
2. controlul epidemiilor;
3. supravegherea bolilor;
4. supravegherea factorilor de risc comportamentali;
5. prevenirea accidentelor;
b) monitorizarea stării de sănătate prin:
1. monitorizarea indicatorilor stării de sănătate;
2. monitorizarea determinanţilor stării de sănătate;
3. monitorizarea eficacităţii şi eficienţei
activităţilor din domeniul sănătăţii publice;
4. evaluarea nevoilor
populaţiei privind serviciile de sănătate publică;
c) promovarea sănătăţii şi educaţia pentru sănătate
prin:
1. campanii de informare-educare-comunicare;
2. programe de educaţie pentru sănătate şi promovare
a sănătăţii în comunităţi;
3. dezvoltarea şi implicarea comunităţilor locale;
4. pledoaria pentru sănătatea publică;
d) sănătatea ocupaţională prin:
1. definirea standardelor de sănătate ocupaţională;
2. controlul aplicării reglementărilor sănătăţii în
muncă;
e) sănătatea în relaţie cu mediul prin:
1. monitorizarea factorilor de mediu în relaţie cu
sănătatea;
2. reglementarea calităţii principalilor factori de
mediu;
3. stabilirea normelor de igienă şi sănătate publică
comunitare;
4. controlul aplicării reglementărilor referitoare la calitatea factorilor de mediu;
f) reglementarea primară şi secundară în domeniul
sănătăţii publice prin:
1. elaborarea, revizuirea, adaptarea şi implementarea
legislaţiei din domeniul sănătăţii publice;
2. reglementarea circulaţiei bunurilor şi serviciilor
cu potenţial impact asupra sănătăţii publice;
g) managementul sănătăţii publice bazat pe:
1. managementul politicilor, planificării şi
dezvoltării sistemului de sănătate publică;
2. formularea şi implementarea politicilor de
sănătate publică pe baze ştiinţifice;
3. cercetarea în domeniul sănătăţii publice şi al
sistemelor de sănătate;
4. colaborarea şi cooperarea internaţională în
domeniul sănătăţii publice;
h) servicii de sănătate publică specifice: 1. servicii
de sănătate şcolară;
2. servicii de urgenţă în caz de dezastre şi
calamităţi;
3. servicii de laborator în domeniul sănătăţii
publice;
4. servicii de planificare familială;
5. servicii de screening pentru depistarea precoce a
bolilor;
6. servicii prenatale şi postnatale;
7. servicii de consiliere în domeniul sănătăţii
publice;
8. servicii de sănătate publică în transporturi.
CAPITOLUL II
Principiile asistenţei de sănătate publică
Art. 7. - Principiile care stau la baza asistenţei de
sănătate publică sunt următoarele:
a) responsabilitatea societăţii pentru sănătatea
publică;
b) focalizarea pe grupurile populaţionale şi
prevenirea primară;
c) preocuparea pentru determinanţii stării de
sănătate: sociali, de mediu, comportamentali şi servicii de sănătate;
d) abordarea multidisciplinară
şi intersectorială;
e) parteneriat activ cu populaţia şi cu autorităţile
publice centrale şi locale;
f) decizii bazate pe cele mai bune dovezi ştiinţifice
existente la momentul respectiv (sănătate publică bazată pe dovezi);
g) în condiţii specifice, decizii fundamentate conform
principiului precauţiei;
h) descentralizarea sistemului de sănătate publică;
i) existenţa unui sistem informaţional şi informatic
integrat pentru managementul sănătăţii publice.
Art. 8. - Modalităţile de implementare a principiilor
de sănătate publică sunt:
a) activitatea de reglementare în domeniile sănătăţii
publice;
b) activitatea de inspecţie;
c) activităţile desfăşurate în cadrul programelor de
sănătate publică;
d) avizarea/autorizarea/notificarea
activităţilor şi produselor cu impact asupra sănătăţii populaţiei;
e) evaluarea impactului asupra sănătăţii în relaţie
cu programe, strategii, politici ale altor sectoare de activitate cu efecte
conexe asupra sănătăţii populaţiei.
Art. 9. - (1) Programele
naţionale de sănătate reprezintă cadrul implementării obiectivelor politicii şi
strategiei sănătăţii publice de către Ministerul Sănătăţii Publice, ca
autoritate centrală a domeniului de sănătate publică.
(2) Programele naţionale de sănătate se adresează
populaţiei şi sunt orientate către promovarea sănătăţii, prevenirea
îmbolnăvirilor şi prelungirea vieţii de bună calitate.
(3) Programele naţionale de sănătate publică se
adresează domeniilor de intervenţie ale sănătăţii publice şi răspund
priorităţilor naţionale identificate.
(4) Programele naţionale de sănătate sunt finanţate
de la bugetul de stat, bugetul Fondului naţional unic de asigurări sociale de
sănătate, din fonduri externe rambursabile şi nerambursabile, din venituri
proprii, donaţii şi sponsorizări, precum şi din alte surse, potrivit legii.
(5) Programele naţionale de sănătate sunt organizate,
monitorizate şi supuse controlului Ministerului Sănătăţii Publice.
Art. 10. - (1) Autoritatea centrală în domeniul
sănătăţii publice elaborează proiecte de acte normative în domeniul sănătăţii
publice şi avizează reglementări ale altor ministere şi instituţii referitoare
la activităţi cu impact asupra sănătăţii publice.
(2) Principalele domenii pentru care autoritatea
centrală de sănătate publică elaborează sau participă la elaborarea, după caz,
a unor proiecte de acte normative sunt:
a) calitatea principalilor factori de mediu: apa
potabilă şi de îmbăiere, aerul ambiant şi interior, zgomot, locuinţă şi
habitat, substanţe chimice, produse cosmetice, radiaţii ionizante, vectori,
deşeuri etc;
b) monitorizarea stării de sănătate;
c) promovarea sănătăţii;
d) calitatea alimentului;
e) calitatea unităţilor şi serviciilor turistice;
f) calitatea mediului de muncă şi sănătatea în muncă;
g) colectivităţile de copii şi
tineri;
h) evaluarea efectelor factorilor de mediu asupra
sănătăţii populaţiei;
i) asigurarea condiţiilor de igienă în unităţi
sanitare;
j) servicii de laborator;
k) planificare familială;
l) siguranţa transfuziei
sanguine;
m) norme privind alte domenii
ale sănătăţii publice;
n) prevenirea consumului ilegal de droguri.
(3) Ministerul Sănătăţii Publice, prin aparatul propriu
şi prin autorităţile de sănătate publică judeţene şi a municipiului Bucureşti
şi ale ministerelor şi instituţiilor cu reţea sanitară proprie, verifică
respectarea reglementărilor în domeniul sănătăţii publice, iar în caz de
nereguli sau neconformitate, aplică măsuri conform legii.
CAPITOLUL III
Autorităţile sistemului de sănătate publică
Art. 11. - Ministerul Sănătăţii
Publice este organ de specialitate al administraţiei publice centrale, cu
personalitate juridică, în subordinea Guvernului, cu sediul în municipiul
Bucureşti, str. Cristian Popişteanu nr. 1 -3, sectorul 1.
Art. 12. - Autorităţile de sănătate publică judeţene şi
a municipiului Bucureşti sunt servicii publice deconcentrate ale Ministerului
Sănătăţii Publice, cu personalitate juridică, reprezentând autoritatea de
sănătate publică la nivel local, In mod similar se pot organiza autorităţi de
sănătate publică în cadrul ministerelor care colaborează cu unităţile
deconcentrate ale Ministerului Sănătăţii Publice.
Art. 13. - (1) Institutele sau centrele de sănătate
publică sunt instituţii publice regionale sau naţionale, cu personalitate
juridică, în subordinea Ministerului Sănătăţii Publice, şi care coordonează
tehnic şi metodologic activitatea de specialitate în domeniul fundamentării,
elaborării şi implementării strategiilor privitoare la prevenirea
îmbolnăvirilor, controlul bolilor transmisibile şi netransmisibile şi a
politicilor de sănătate publică din domeniile specifice, la nivel naţional
şi/sau regional.
(2) Institutele naţionale de cercetare-dezvoltare în
domeniile sănătăţii publice sunt instituţii publice cu personalitate juridică,
în coordonarea Ministerului Sănătăţii Publice.
Art. 14. - Se înfiinţează Centrul naţional pentru
organizarea şi asigurarea sistemului informaţional şi informatic în domeniul
sănătăţii, instituţie publică de specialitate, cu personalitate juridică, în
subordinea Ministerului Sănătăţii Publice.
Art. 15. - (1) Ministerul Sănătăţii Publice stabileşte,
prin ordine ale ministrului sănătăţii publice, şi alte instituţii aflate în
coordonarea sau în subordonarea sa pentru a desfăşura activităţi de sănătate
publică la nivel regional şi local.
(2) Prin hotărâre a Guvernului se stabilesc şi alte
instituţii care să desfăşoare activităţi de sănătate publică la nivel naţional.
Art. 16. - Ministerul Sănătăţii Publice, ca autoritate
centrală în domeniul asistenţei de sănătate publică, are următoarele atribuţii
şi responsabilităţi:
a) asigură fundamentarea, elaborarea şi implementarea
politicii naţionale de sănătate publică;
b) elaborează sau avizează reglementări pentru
protecţia sănătăţii în relaţie cu mediul natural, alimentul, condiţiile de
viaţă şi de muncă şi pentru promovarea sănătăţii publice;
c) elaborează şi avizează reglementări privind
organizarea şi funcţionarea serviciilor de asistenţă medicală şi de sănătate
publică;
d) autorizează şi controlează condiţiile de
funcţionare a furnizorilor de servicii medicale prin autorităţile locale de
sănătate publică;
e) stabileşte priorităţile naţionale de sănătate
publică, elaborează programele naţionale de sănătate publică finanţate de la
bugetul de stat, coordonează şi monitorizează implementarea
acestora;
f) elaborează normele privind înfiinţarea, organizarea
şi funcţionarea unităţilor de distribuţie a medicamentelor, autorizează şi
controlează activitatea şi condiţiile de funcţionare a acestora;
g) autorizează şi controlează condiţiile de
funcţionare a farmaciilor de stat şi private şi, respectiv, avizează
Nomenclatorul medicamentelor şi produselor biologice de uz uman, în condiţiile
legii;
h) elaborează împreună cu Casa Naţională de Asigurări
de Sănătate, denumită în continuare CNAS, cu consultarea Colegiului Farmaciştilor din România, lista
medicamentelor de care beneficiază asiguraţii, cu sau fără contribuţie
personală;
i) elaborează normele de organizare şi funcţionare a
unităţilor care asigură asistenţa de sănătate publică, autorizează şi
controlează activitatea instituţiilor de sănătate publică şi asigură finanţarea
unităţilor din subordine;
j) asigură controlul calităţii serviciilor medicale
prin autorităţile locale de sănătate publică;
k) evaluează periodic indicatorii stării de sănătate a
populaţiei şi ai programelor de sănătate publică, indicatorii de performanţă ai
unităţilor sanitare şi prezintă informări periodice Guvernului;
l) stabileşte care sunt
instituţiile sau organismele care pot fi delegate pentru realizarea de
atribuţii şi responsabilităţi specifice în domeniul sănătăţii publice, pe bază
de selecţie de ofertă şi recomandare profesională;
m) stabileşte sau avizează liste de substanţe ori
produse destinate sau folosite pentru uz uman şi controlează respectarea
condiţiilor legale prin care produsele pot fi oferite spre consum sau folosinţă
populaţiei;
n) avizează codurile deontologice profesionale şi
ghidurile de practică în domeniul sănătăţii publice;
o) reprezintă statul român în relaţiile cu organismele
internaţionale din domeniul sănătăţii publice;
p) organizează şi coordonează sistemul naţional de
supraveghere şi control al bolilor;
q) organizează şi coordonează reţeaua naţională de
promovare a sănătăţii, în scopul adoptării de către populaţie a
comportamentelor favorabile sănătăţii;
r) avizează şi controlează activitatea de supraveghere
a stării de sănătate a personalului expus profesional;
s) participă la activităţile de promovare şi protecţie
a sănătăţii familiilor şi categoriilor de populaţie defavorizate;
t) participă la activităţile de
protecţie familială, planificare familială şi protecţia copilului;
u) organizează şi coordonează activitatea de inspecţie
sanitară de stat;
v) organizează şi coordonează Sistemul naţional
informaţional şi informatic privind sănătatea publică;
w) organizează şi coordonează implementarea unor
activităţi de protecţie a mediului, conform reglementărilor legale.
Art. 17. - (1) Autorităţile de sănătate publică
judeţene şi a municipiului Bucureşti sunt servicii publice deconcentrate,
cu personalitate juridică,
subordonate Ministerului Sănătăţii Publice, care pun în aplicare politica şi
programele naţionale de sănătate publică pe plan local, identifică problemele
locale prioritare de sănătate publică, elaborează şi implementează acţiuni
locale de sănătate publică.
(2) In scopul îndeplinirii acestor obiective,
autorităţile de sănătate publică judeţene şi a municipiului Bucureşti au, în
principal, următoarele atribuţii:
a) controlează şi evaluează modul de asigurare a
asistenţei medicale curative şi profilactice;
b) controlează aplicarea normelor de funcţionare a
unităţilor medicale şi farmaceutice, indiferent de forma de organizare, şi
aplică măsuri în caz de neconformitate;
c) urmăresc aplicarea criteriilor de control al
calităţii serviciilor medicale;
d) coordonează şi controlează asistenţa gravidei,
lăuzei şi nou-născutului;
e) evaluează resursele umane de la nivelul asistenţei
medicale în relaţie cu nevoile comunitare identificate prin acţiuni specifice;
f) participă activ la programele de instruire a
personalului din serviciile de sănătate publică şi a populaţiei;
g) organizează acţiuni de prevenire a îmbolnăvirilor
şi de promovare a sănătăţii;
h) organizează activităţile preventive în teritoriul
judeţului şi, respectiv, al municipiului Bucureşti;
i) colectează şi înregistrează date privind sănătatea
populaţiei, utilizând informaţiile în scopul identificării problemelor de
sănătate ale acesteia;
j) identifică posibilele probleme de sănătate publică
sau ameninţări la adresa sănătăţii unei comunităţi;
k) intervin în rezolvarea problemelor de sănătate
publică apărute în rândul persoanelor aparţinând grupurilor defavorizate;
l) coordonează studii asupra
problemelor de sănătate ale populaţiei din teritoriul dat;
m) stabilesc relaţii de colaborare cu instituţii şi
organizaţii în vederea desfăşurării de acţiuni comune în domeniul sănătăţii
publice;
n) colectează şi înregistrează datele privind tipurile,
cantitatea şi modul de gestionare a deşeurilor generate în unităţile medicale
din zona de jurisdicţie.
Art. 18. - (1) In subordinea autorităţilor de sănătate
publică funcţionează unităţi sanitare publice de pe raza teritoriului arondat,
cu excepţia unităţilor sanitare publice de interes naţional sau a celor
aparţinând ministerelor ori instituţiilor cu reţele sanitare proprii.
(2) Autorităţile de sănătate publică judeţene şi a
municipiului Bucureşti coordonează serviciile de ambulanţă judeţene şi al
municipiului Bucureşti, organizează şi coordonează asistenţa medicală în caz de
calamităţi, catastrofe şi situaţii deosebite.
Art. 19. - Autorităţile de sănătate publică judeţene şi
a municipiului Bucureşti colaborează cu autorităţile locale în asigurarea
asistenţei medicale.
Art. 20. - (1) Autorităţile de sănătate publică
judeţene şi a municipiului Bucureşti organizează culegerea şi prelucrarea
informaţiilor statistice medicale primite de la unităţile sanitare publice sau
private şi transmit rapoarte statistice lunare către instituţiile desemnate în
acest scop.
(2) Autorităţile de sănătate publică teritoriale
întocmesc rapoarte privind starea de sănătate a comunităţii, care sunt înaintate
Ministerului Sănătăţii Publice, precum şi partenerilor instituţionali la nivel
local.
Art. 21. - Autorităţile de sănătate publică judeţene şi
a municipiului Bucureşti coordonează la nivel local implementarea activităţilor
care decurg din obligaţiile asumate prin Tratatul de aderare a României la
Uniunea Europeană şi planurile de implementare a actelor comunitare referitoare
la domeniul sănătăţii.
Art. 22. - Regulamentul de
organizare şi funcţionare, precum şi structura organizatorică ale autorităţilor
de sănătate publică judeţene şi a municipiului Bucureşti se stabilesc prin
ordin al ministrului sănătăţii publice.
Art. 23. - Institutele/centrele naţionale şi/sau
regionale prevăzute la art. 13 şi 14, aflate în subordinea şi/sau în
coordonarea Ministerului Sănătăţii Publice, îndeplinesc, în principal,
următoarele atribuţii:
a) asigură îndrumarea tehnică şi metodologică a
reţelei de sănătate publică, în funcţie de domeniul lor de competenţă;
b) participă la elaborarea strategiilor şi
politicilor din domeniul lor de competenţă;
c) elaborează proiecte de acte normative, norme,
metodologii şi instrucţiuni privind domeniile specifice din cadrul sănătăţii
publice;
d) efectuează expertize,
oferă asistenţă tehnică şi realizează servicii de sănătate publică, la
solicitarea unor persoane fizice sau juridice;
e) supraveghează starea de sănătate a populaţiei,
bolile transmisibile şi netransmisibile, pentru identificarea problemelor de
sănătate comunitară;
f) asigură sistemul de supraveghere epidemiologică, precum
şi de alertă precoce şi răspuns rapid şi participă la schimbul de informaţii în
cadrul reţelei europene de supraveghere epidemiologică în domeniul bolilor
transmisibile;
g) participă la efectuarea de investigaţii
epidemiologice de teren, din proprie iniţiativă, la solicitarea Ministerului
Sănătăţii Publice sau a autorităţilor locale de sănătate publică;
h) elaborează metodologia, instrumentele şi indicatorii
de monitorizare şi evaluare a serviciilor şi programelor de sănătate publică,
de promovare a sănătăţii şi de educaţie pentru sănătate;
i) participă la procesul de învăţământ medical de
specializare şi perfecţionare în domeniile specifice din cadrul sănătăţii publice;
j) desfăşoară activităţi de cercetare-dezvoltare în
domeniul sănătăţii publice şi al managementului sanitar;
k) colectează, analizează şi diseminează date
statistice privind sănătatea publică;
l) asigură existenţa unui
sistem informaţional şi informatic integrat pentru managementul sănătăţii
publice.
Art. 24. - (1) Instituţiile şi unităţile sanitare care
asigură asistenţa de sănătate publică, în cazul apariţiei unui focar de boală
transmisibilă, precum şi în situaţia iminenţei izbucnirii unei epidemii, au
obligaţia să dispună măsuri specifice.
(2) Măsurile privind prevenirea şi gestionarea
situaţiilor de urgenţă generate de epidemii, precum şi bolile transmisibile
pentru care declararea, tratamentul sau internarea sunt obligatorii se
stabilesc prin ordin al ministrului sănătăţii publice.
CAPITOLUL IV
Inspecţia sanitară de stat
Art. 25. - (1) Activitatea de inspecţie sanitară de
stat se organizează pe domenii specifice de activitate coordonate de către
direcţiile de specialitate din cadrul Ministerului Sănătăţii Publice şi în
cadrul structurilor de specialitate din serviciile publice deconcentrate de la
nivel local şi din ministerele cu reţea sanitară proprie, conform
competenţelor, după cum urmează:
a) inspecţia farmaceutică;
b) inspecţia dispozitivelor
medicale;
c) inspecţia pentru controlul calităţii serviciilor
de asistenţă medicală;
d) inspecţia de sănătate publică.
(2) Activitatea de inspecţie sanitară de stat constă,
în principal, în:
a) verificarea conformităţii amplasamentelor,
activităţilor, proceselor, serviciilor, produselor,
factorilor de mediu;
b) verificarea respectării reglementărilor privind
starea de sănătate a personalului, cunoştinţele, atitudinile şi practicile
acestuia în raport cu normele igienico-sanitare;
c) depistarea şi evaluarea
riscurilor pentru sănătate şi impunerea măsurilor de eliminare sau, după caz,
de diminuare a acestora;
d) comunicarea datelor despre existenţa şi dimensiunea
riscului identificat persoanelor responsabile cu managementul riscului,
consumatorilor şi altor potenţiali receptori interesaţi.
Art. 26. - (1) Activitatea de inspecţie sanitară de
stat se exercită de către personalul de specialitate împuternicit de către
Ministerul Sănătăţii Publice, conform normelor stabilite de către acesta.
(2) Pentru exercitarea
activităţii de inspecţie, inspectorii sanitari de stat au drept de:
a) acces în orice tip de unităţi, la documente,
informaţii, conform competenţelor;
b) recoltare a produselor care pot constitui un risc
pentru sănătatea publică;
c) a constata şi a sancţiona
contravenţiile privind normele de igienă şi sănătate publică.
(3) In situaţii de risc pentru sănătatea publică,
inspectorii sanitari de stat pot interzice punerea în consum, pot decide
retragerea produselor, suspendarea temporară sau definitivă a activităţilor,
retragerea sau anularea autorizaţiei sanitare de funcţionare.
(4) In situaţii de risc epidemiologie, inspectorii
sanitari de stat pot dispune măsuri speciale pentru bolnavii, suspecţii şi
contacţii de boli transmisibile sau purtătorii de germeni patogeni, precum şi
alte măsuri de limitare a circulaţiei persoanelor.
(5) Concluziile activităţilor de inspecţie sanitară de
stat, abaterile de la normele legale, recomandările şi termenele de remediere a
deficienţelor, precum şi alte măsuri legale aplicate se vor consemna în
procese-verbale de constatare a condiţiilor igienico-sanitare, rapoarte de
inspecţie sau procese-verbale de constatare a contravenţiei.
(6) In exercitarea activităţii inspectorii sanitari de
stat vor asigura păstrarea confidenţialităţii datelor, cu excepţia situaţiilor
care constituie un risc pentru sănătatea publică.
Art. 27. - Activitatea de avizare, autorizare şi
notificare a activităţilor şi produselor cu impact asupra sănătăţii populaţiei
are ca scop certificarea conformării cu normele de sănătate publică a
produselor, serviciilor şi activităţilor, în scopul protejării sănătăţii
populaţiei.
Art. 28. - Activitatea de evaluare a impactului asupra
sănătăţii în relaţie cu programe, strategii, politici ale altor sectoare de
activitate cu efecte conexe asupra sănătăţii populaţiei reprezintă instrumentul
de integrare a priorităţilor de sănătate publică în dezvoltarea durabilă a
societăţii.
CAPITOLUL V
Asistenţa medicală
Art. 29. - Asistenţa medicală profilactică şi curativă
se asigură prin:
a) cabinete medicale ambulatorii ale medicilor de familie
şi de alte specialităţi, centre de diagnostic şi tratament, centre medicale,
centre de sănătate, laboratoare, precum şi prin alte unităţi sanitare publice
şi private;
b) unităţi sanitare publice şi
private cu paturi.
Art. 30. - Activitatea medicală de recuperare se
asigură prin unităţi medicale de specialitate cu personalitate juridică,
secţii, compartimente şi laboratoare de recuperare, unităţi ambulatorii de
recuperare, publice sau private, precum şi prin societăţi de turism balnear şi
de recuperare, constituite conform legii.
Art. 31. - Asistenţa medicală de urgenţă se asigură de
unităţi specializate de urgenţă şi transport sanitar publice sau private,
precum şi prin structurile de primire a urgenţelor, organizate în acest scop.
Art. 32. - Asistenţa medicală de hemotransfuziologie,
transfuzie sanguină sau alte servicii de asistenţă medicală şi prestaţii
autorizate se asigură prin unităţi specializate în acest scop.
Art. 33. - Asistenţa medicală
preventivă din colectivităţile de copii preşcolari, şcolari şi studenţi se
asigură prin cabinetele medicale organizate, conform legii, în unităţile de
învăţământ preşcolar, şcolar sau universitar, publice ori private, sau prin
cabinetele individuale ale medicilor de familie, după caz.
Art. 34. - Activităţile de asistenţă de sănătate
publică se finanţează de la bugetul de stat, de la bugetul Fondului naţional
unic de asigurări sociale de sănătate, de la bugetele locale, din venituri
proprii, fonduri externe rambursabile şi nerambursabile, contracte cu terţii, precum
şi din contribuţii personale şi plăţi directe, după caz, potrivit legii.
CAPITOLUL VI
Asistenţa farmaceutică
Art. 35. - Asistenţa farmaceutică se asigură în cadrul
sistemului de sănătate publică, potrivit legii, prin prepararea şi eliberarea
medicamentelor şi a altor produse stabilite prin ordin al ministrului sănătăţii
publice, cum ar fi: cosmetice, dispozitive medicale, suplimente alimentare şi
alte asemenea produse.
Art. 36. - Punerea pe piaţă a medicamentelor, precum şi
activitatea de farmacovigilenţă se realizează conform legii.
CAPITOLUL VII
Obligaţiile persoanelor fizice şi juridice
Art. 37. - Orice persoană fizică sau juridică, având
calitatea de angajator, este obligată să asigure fondurile şi condiţiile
necesare pentru:
a) efectuarea controlului medical periodic, conform
normelor de sănătate publică şi securitate în muncă;
b) aplicarea măsurilor de igienă, dezinfecţie,
dezinsecţie şi deratizare periodică;
c) vaccinarea şi profilaxia specifică impusă de
riscurile de la locul de muncă.
Art. 38. - Cetăţenii români şi orice altă persoană
aflată pe teritoriul României, precum şi unităţile şi agenţii economici au
obligaţia să se supună măsurilor de prevenire şi combatere a bolilor
transmisibile, să respecte întocmai normele de igienă şi sănătate publică, să
ofere informaţiile solicitate şi să aplice măsurile stabilite privind
instituirea condiţiilor pentru prevenirea îmbolnăvirilor şi pentru promovarea
sănătăţii individului şi a populaţiei.
Art. 39. - (1) Informaţiile privind sănătatea persoanelor
se păstrează la autorităţile de sănătate publică teritoriale, la autorităţile
de sănătate publică ale ministerelor cu reţea sanitară proprie, precum şi la
instituţiile desemnate şi pot fi folosite în scopul întocmirii rapoartelor
statistice nenominalizate, în vederea evaluării stării de sănătate a
populaţiei.
(2) Folosirea în alte scopuri a informaţiilor
înregistrate se poate admite numai dacă este îndeplinită una dintre următoarele
condiţii:
a) există o dispoziţie legală în acest sens;
b) există acordul persoanei în cauză;
c) datele sunt necesare pentru prevenirea
îmbolnăvirii unei persoane sau a comunităţii, după caz;
d) datele sunt necesare pentru efectuarea urmăririi penale.
(3) Păstrarea confidenţialităţii informaţiilor
referitoare la persoane este obligatorie pentru toţi salariaţii care prin
activitatea pe care o desfăşoară au acces la acestea în mod direct sau
indirect.
Art. 40. - (1) Pentru situaţii speciale cu implicaţii
asupra sănătăţii publice se constituie rezerva Ministerului Sănătăţii Publice,
care cuprinde medicamente, seruri, vaccinuri, dezinfectante, insecticide,
dispozitive medicale şi alte materiale specifice, iar la nivelul autorităţilor
de sănătate publică judeţene şi a municipiului Bucureşti, rezerva
antiepidemică.
(2) Normele metodologice de constituire, păstrare şi
utilizare a rezervei Ministerului Sănătăţii Publice şi a rezervei antiepidemice
se stabilesc prin ordin al ministrului sănătăţii publice.
Art. 41. - (1) Pentru servicii de asistenţă de sănătate
publică, efectuate de către autorităţile de sănătate publică la cererea unor
persoane fizice şi juridice, se percep tarife potrivit reglementărilor în
vigoare.
(2) Veniturile proprii obţinute potrivit alin. (1) se
folosesc în condiţiile legii.
CAPITOLUL VIII
Utilizarea mass-media în interesul sănătăţii publice
Art. 42. - (1) Campaniile de informare, educare şi
comunicare cu privire la teme care privesc sănătatea publică trebuie să fie
avizate de Ministerul Sănătăţii Publice.
(2) Societatea Română de Radiodifuziune şi Societatea
Română de Televiziune sunt obligate ca în cadrul grilelor de programe să
rezerve gratuit spaţiul de emisie necesar promovării campaniilor de informare,
educare şi comunicare referitoare la teme care privesc sănătatea publică.
(3) In termen de 30 de zile de la intrarea în vigoare
a prezentei legi, Ministerul Sănătăţii Publice sau, după caz, ministerele cu
reţea sanitară proprie, împreună cu Societatea Română de Radiodifuziune şi
Societatea Română de Televiziune vor stabili, în baza unui protocol,
modalităţile şi spaţiul acordat în grila de programe pentru promovarea
campaniilor pe teme care privesc sănătatea publică.
CAPITOLUL IX
Dispoziţii tranzitorii şi finale
Art. 43. - (1) In termen de 3
zile de la intrarea în vigoare a prezentului titlu, ministrul sănătăţii publice
va emite ordinul privind restructurarea actualelor direcţii de sănătate publică
judeţene şi a municipiului Bucureşti, precum şi ordinul pentru aprobarea
Normelor de organizare şi funcţionare a inspecţiei sanitare de stat.
(2) In termenul prevăzut la alin. (1), Ministerul
Sănătăţii Publice va elabora reglementările legale privind organizarea şi
funcţionarea instituţiilor prevăzute la art. 13 şi 14, pe care le va supune Guvernului spre aprobare.
Art. 44. - (1) Prevederile prezentului titlu se aplică
şi ministerelor cu reţea sanitară proprie.
(2) La data intrării în vigoare a prezentei legi se
abrogă Legea nr. 3/1978 privind asigurarea sănătăţii populaţiei, publicată în
Buletinul Oficial, Partea I, nr.
54 din 10 iulie 1978, cu modificările ulterioare,Legea nr.100/1998 privind
asistenţa de sănătate publică, publicată în Monitorul Oficial al României,
Partea I, nr. 204 din 1 iunie
1998, cu modificările şi completările ulterioare, precum şi orice alte
dispoziţii contrare.
TITLUL II
Programele naţionale de sănătate
CAPITOLUL I
Dispoziţii generale
Art. 45. - (1) Programele naţionale de sănătate
reprezintă un ansamblu de acţiuni organizate în scopul prevenirii şi
controlului bolilor cu impact major asupra stării de sănătate a populaţiei.
(2) Ministerul Sănătăţii Publice asigură proiectarea
şi coordonarea realizării programelor naţionale de sănătate, în acord cu
politicile şi strategiile naţionale de sănătate.
(3) Autorităţile de sănătate publică din ministerele
cu reţea sanitară proprie coordonează realizarea programelor de sănătate
specifice ministerului, cu impact asupra sănătăţii, în concordanţă cu strategia
Ministerului Sănătăţii Publice.
Art. 46. - Elaborarea
programelor naţionale de sănătate are la bază următoarele obiective:
a) rezolvarea cu prioritate a problemelor de sănătate,
în conformitate cu Strategia naţională de sănătate a Ministerului Sănătăţii
Publice;
b) utilizarea eficientă a resurselor alocate pentru
îndeplinirea obiectivelor şi indicatorilor aprobaţi;
c) fundamentarea programelor pe nevoile populaţiei,
evidenţiate din date obiective;
d) asigurarea concordanţei cu politicile, strategiile
şi recomandările instituţiilor şi organizaţiilor internaţionale în domeniu.
Art. 47. - (1) Pentru proiectarea şi realizarea
programelor naţionale de sănătate se înfiinţează Agenţia Naţională pentru
Programe de Sănătate, care funcţionează în structura Ministerului Sănătăţii
Publice, cu rang de direcţie.
(2) Pentru realizarea atribuţiilor, Agenţia Naţională pentru
Programe de Sănătate colaborează cu Casa Naţională de Asigurări de Sănătate,
Ministerul Muncii, Solidarităţii Sociale şi Familiei, precum şi cu alte
instituţii şi organizaţii guvernamentale şi neguvernamentale.
Art. 48. - Programele naţionale de sănătate, respectiv
subprogramele de sănătate, se aprobă anual prin ordin comun al ministrului
sănătăţii publice şi al preşedintelui Casei Naţionale de Asigurări de Sănătate.
In ordin sunt precizate obiectivele, activităţile, indicatorii specifici,
unităţile sanitare prin care se derulează programele şi subprogramele naţionale
de sănătate, precum şi normele metodologice de organizare, finanţare şi
monitorizare a acestora.
Art. 49. - Programele naţionale de sănătate se
derulează prin unităţi de specialitate selectate pe baza criteriilor stabilite
prin ordin al ministrului sănătăţii publice.
CAPITOLUL II
Atribuţii în realizarea programelor naţionale de
sănătate
Art. 50. - Ministerul Sănătăţii Publice, ca autoritate
centrală în domeniul asistenţei de sănătate, asigură coordonarea tuturor
programelor naţionale de sănătate prin îndeplinirea următoarelor atribuţii:
a) aprobă domeniile prioritare de acţiune şi strategia
programelor naţionale de sănătate pe termen scurt, mediu şi lung;
b) aprobă obiectivele anuale ale programelor
naţionale de sănătate şi ale subprogramelor de sănătate;
c) aprobă structura programelor naţionale de sănătate
şi a subprogramelor de sănătate;
d) aprobă necesarul de resurse financiare pentru
realizarea programelor naţionale de sănătate şi a subprogramelor de sănătate;
e) aprobă normele tehnice de implementare a
programelor naţionale de sănătate;
f) stabileşte programele naţionale de sănătate şi
subprogramele de sănătate pentru care se organizează licitaţii la nivel
naţional şi răspunde de organizarea acestora.
Art. 51. - Agenţia Naţională pentru Programe de
Sănătate are următoarele atribuţii:
a) propune spre aprobare ministrului sănătăţii
publice domeniile prioritare de acţiune în structurarea programelor naţionale
de sănătate, pe baza evaluării nevoilor reale ale populaţiei şi a problemelor
de sănătate identificate;
b) elaborează şi propune spre aprobare ministrului
sănătăţii publice strategia programelor naţionale de sănătate, de organizare şi
desfăşurare a acestora;
c) elaborează structura programelor şi
subprogramelor de sănătate, în colaborare cu direcţiile de specialitate din
Ministerul Sănătăţii Publice şi Casa Naţională de Asigurări de Sănătate;
d) fundamentează necesarul de
resurse financiare în raport cu obiectivele şi activităţile cuprinse în
programele de sănătate;
e) elaborează şi propune spre aprobare ministrului
sănătăţii publice norme tehnice de implementare şi evaluare a programelor
naţionale de sănătate;
f) evaluează trimestrial şi anual realizarea obiectivelor
programelor naţionale de sănătate şi face propuneri pentru îmbunătăţirea
acestora în scopul îndeplinirii obiectivelor aprobate.
Art. 52. - Casa Naţională de Asigurări de Sănătate
asigură organizarea şi monitorizarea programelor naţionale de sănătate cu scop
curativ finanţate din bugetul Fondului naţional unic de asigurări sociale de
sănătate, având următoarele atribuţii:
a) implementează programele naţionale de sănătate cu
scop curativ finanţate din bugetul Fondului naţional unic de asigurări sociale
de sănătate, conform strategiei aprobate de Ministerul Sănătăţii Publice;
b) răspunde de asigurarea, urmărirea şi controlul
fondurilor alocate pentru derularea programelor şi subprogramelor de sănătate
cu scop curativ, precum şi de monitorizarea, controlul şi analiza indicatorilor
fizici şi de eficienţă, prin intermediul caselor de asigurări de sănătate
judeţene;
c) transmite Agenţiei Naţionale pentru Programe de
Sănătate, trimestrial, anual şi ori de câte ori este nevoie, analiza modului în
care au fost derulate programele naţionale de sănătate cu scop curativ
finanţate din bugetul Fondului naţional unic de asigurări sociale de sănătate.
Art. 53. - (1) Programele naţionale de sănătate sunt
implementate şi coordonate la nivel naţional de Agenţia Naţională pentru
Programe de Sănătate.
(2) Coordonatorii regionali şi locali din cadrul
institutelor şi centrelor de sănătate publică, respectiv din cadrul
autorităţilor de sănătate publică judeţene şi a municipiului Bucureşti, asigură
implementarea şi monitorizarea programelor naţionale de sănătate la nivel
regional, respectiv local.
CAPITOLUL III
Finanţarea programelor naţionale de sănătate
Art. 54. - (1) Finanţarea programelor naţionale de
sănătate se realizează cu fonduri de la bugetul de stat, bugetul Fondului
naţional unic de asigurări sociale de sănătate, precum şi din alte surse,
inclusiv din donaţii şi sponsorizări, în condiţiile legii.
(2) Sumele alocate programelor naţionale de sănătate sunt aprobate anual prin legea bugetului de stat.
Art. 55. - (1) Sumele alocate pentru programele
naţionale de sănătate, respectiv pentru subprograme, sunt cuprinse în bugetele
de venituri şi cheltuieli ale unităţilor sanitare prin care acestea se
derulează şi se utilizează potrivit destinaţiilor stabilite.
(2) Sumele menţionate la alin. (1) vor fi publicate pe
site-ul Ministerului Sănătăţii Publice împreună cu bugetul de venituri şi
cheltuieli şi execuţia acestuia.
Art. 56. - Unităţile care derulează programele
naţionale de sănătate, respectiv subprograme, au obligaţia utilizării
fondurilor în limita bugetului alocat şi potrivit destinaţiei specificate, cu
respectarea dispoziţiilor legale, precum şi obligaţia gestionării eficiente a
mijloacelor materiale şi băneşti şi a organizării evidenţei contabile a
cheltuielilor pentru fiecare subprogram şi pe subdiviziunile clasificaţiei
bugetare, atât pentru bugetul aprobat, cât şi în execuţie.
Art. 57. - Ministerul Sănătăţii Publice, respectiv Casa
Naţională de Asigurări de Sănătate, asigură fondurile pentru finanţarea programelor
naţionale de sănătate, respectiv a subprogramelor, pe baza cererilor
fundamentate ale ordonatorilor de credite secundari şi terţiari, care vor
solicita finanţarea în funcţie de realizarea indicatorilor.
CAPITOLUL IV
Dispoziţii finale
Art. 58. - In termen de 3 zile de la intrarea în
vigoare a prezentului titlu, se aprobă Regulamentul de organizare şi
funcţionare a Agenţiei Naţionale pentru Programe de Sănătate, prin ordin al
ministrului sănătăţii publice.
TITLUL III
Asistenţa medicală primară
CAPITOLUL I
Dispoziţii generale
Art. 59. - (1) Obiectul prezentului titlu îl constituie
reglementarea domeniului asistenţei medicale primare, asigurată prin serviciile
de medicină de familie.
(2) Termenul asistenţă
medicală primară defineşte furnizarea îngrijirilor
de sănătate cuprinzătoare, de prim-contact, indiferent de natura problemei de
sănătate, în contextul unei relaţii continue cu pacienţii, în prezenţa bolii
sau în absenţa acesteia.
(3) Domeniul definit la alin.
(2) face obiectul specialităţii medicină de familie.
Art. 60. - In înţelesul prezentului titlu, termenii şi
noţiunile folosite au următoarea semnificaţie:
a) asistenţă medicală
primară - segmentul de asistenţă medicală care
furnizează îngrijiri ce întrunesc toate caracteristicile menţionate la art. 59
alin. (2) şi având ca furnizor specializat şi de sine stătător cabinetul de
medicină de familie;
b) medicină de familie - specialitatea medicală clinică, de practică publică autorizată,
dobândită în condiţiile legii;
c) medicul specialist de
medicină de familie - medicul care a obţinut
specialitatea medicină de familie, în condiţiile legii;
d) medicul de medicină
generală - absolventul de învăţământ medical
superior, cu diplomă de licenţă obţinută anterior promoţiei 2005, care nu a
urmat pregătirea într-o specialitate şi care a dobândit drept de liberă
practică în baza reglementărilor anterioare prezentei legi;
e) medic de familie - medicul
specialist de medicină de familie şi, prin asimilare, medicul de medicină
generală; acest termen nu constituie un titlu profesional;
f) cabinetul de medicină de
familie - cabinetul specializat în furnizarea de
servicii medicale în asistenţa medicală primară şi care are ca reprezentant
legal/titular un medic de familie;
g) grupul de practică - asocierea formală a doi sau mai mulţi medici de familie titulari de
cabinete de medicină de familie, în vederea furnizării de servicii şi/sau a
utilizării în comun a unor resurse;
h) patrimoniul de
afectaţiune profesională - totalitatea bunurilor,
drepturilor şi obligaţiilor medicului afectate scopului exercitării profesiei
sale, constituite ca o fracţiune distinctă a patrimoniului medicului, separată
de gajul general al creditorilor acestuia;
i) praxisul de
medicină de familie - reuneşte patrimoniul de
afectaţiune profesională, infrastructura cabinetului, aflată în proprietatea
sau în folosinţa medicului, şi clientela;
j) episodul de îngrijire - totalitatea consultaţiilor/ intervenţiilor determinate de o
problemă de sănătate, din momentul apariţiei sale până la remisiunea completă;
k) serviciile de medicină de
familie - serviciile furnizate de un cabinet de
medicină de familie unei populaţii desemnate;
l) cabinete santinelă - cabinete de medicină de familie care utilizează sisteme speciale de
înregistrare continuă a episoadelor de îngrijire la nivelul asistenţei medicale
primare, pentru populaţiile deservite.
CAPITOLUL II
Medicul de familie
Art. 61. - (1) Medicul de familie este furnizorul de
îngrijiri de sănătate care coordonează şi integrează
serviciile medicale furnizate pacienţilor de către el însuşi sau de către alţi
furnizori de servicii de sănătate.
(2) Medicul de familie asigură accesul în sistemul
sanitar pentru pacienţii săi, la nivelurile de competenţă cele mai adecvate
nevoilor acestora.
Art. 62. - Medicul de familie acordă îngrijiri
persoanelor în contextul familiei şi, respectiv, familiilor în cadrul
comunităţii, fără discriminare.
Art. 63. - Caracteristicile asistenţei acordate de
medicul de familie sunt următoarele:
a) constituie punctul de prim-contact în cadrul
sistemului de sănătate, oferind acces nediscriminatoriu pacienţilor şi
ocupându-se de toate problemele de sănătate ale acestora;
b) foloseşte eficient resursele sistemului de
sănătate, coordonând asistenţa medicală acordată pacienţilor; colaborează cu
ceilalţi furnizori de servicii din asistenţa medicală primară şi asigură
legătura cu celelalte specialităţi;
c) este orientată către individ, familie şi
comunitate;
d) se bazează pe comunicarea directă medic-pacient,
care conduce în timp la stabilirea unei relaţii interumane de încredere, în
care pacientul devine un partener responsabil al medicului pentru
menţinerea/restabilirea propriei sănătăţi;
e) asigură continuitatea actului medical şi a
îngrijirilor determinate de nevoile pacienţilor;
f) rezolvă problemele de sănătate acute şi cronice
ale pacienţilor;
g) promovează sănătatea şi starea de bine a
pacienţilor prin intervenţii adecvate şi eficiente;
h) urmăreşte rezolvarea problemelor de sănătate ale
comunităţii.
Art. 64. - (1) Medicul de familie este competent din
punct de vedere profesional să furnizeze îngrijirile cuprinzătoare de care are
nevoie o persoană.
(2) Incepând cu promoţia 2005 de absolvenţi licenţiaţi
ai instituţiilor de învăţământ superior medical, competenţele profesionale în
specialitatea medicină de familie se dobândesc numai prin rezidenţiat.
(3) Medicii de medicină generală prevăzuţi la art. 60
lit. d), care la data aderării României la Uniunea Europeană furnizează
servicii de asistenţă medicală primară în sistemul asigurărilor sociale de
sănătate, îşi pot continua activitatea în aceleaşi condiţii şi după această
dată.
Art. 65. - Pentru medicii de medicină generală cu drept
de liberă practică, care la data intrării în vigoare a prezentei legi nu sunt
confirmaţi rezidenţi în specialitatea medicină de familie, dar furnizează în
regim salarial sau independent servicii de medicină de familie în cabinete
acreditate în cadrul sistemului de asigurări sociale de sănătate, sau care au
întrerupt temporar, în condiţiile legii, exercitarea profesiei, vor fi
organizate modalităţi flexibile de formare în specialitatea medicină de
familie.
CAPITOLUL III
Cabinetul de medicină de familie
Art. 66. - Asistenţa medicală primară se desfăşoară în
cabinete de medicină de familie înfiinţate în condiţiile legii.
Art. 67. - Asistenţa medicală primară se poate asigura
prin practica individuală a medicilor de familie sau prin diferite forme de
asociere a cabinetelor în grupuri de practică, în locaţii comune sau prin
integrarea funcţională a unor cabinete cu locaţii distincte.
Art. 68. - Activitatea cabinetelor de medicină de
familie se desfăşoară prin medicii titulari, personalul angajat şi
colaboratorii externi.
Art. 69. - (1) Autorizarea
înfiinţării unui nou cabinet de medicină de familie într-o localitate se
realizează în conformitate cu prevederile legale. Incepând cu data aderării
României la Uniunea Europeană, autorizarea înfiinţării unui nou cabinet de
medicină de familie se va face numai pentru medicii specialişti de medicină de
familie. Metodologia se stabileşte prin norme aprobate prin hotărâre a
Guvernului.
(2) Preluarea activităţii unui praxis existent de către
un alt medic de familie, în condiţiile încetării activităţii medicului titular,
se face prin vânzarea patrimoniului de afectaţiune profesională. Noul titular
va aduce la cunoştinţă autorităţilor de sănătate publică teritoriale, caselor
de asigurări de sănătate, respectiv pacienţilor, preluarea praxisului.
Criteriile şi metodologia de preluare se stabilesc prin norme aprobate prin
ordin al ministrului sănătăţii publice.
Art. 70. - (1) Un medic de familie poate fi titularul
unui singur cabinet.
(2) Cabinetele de medicină de familie acreditate pot
deschide puncte de lucru. Criteriile şi metodologia vor fi precizate în normele
prevăzute la art. 69 alin. (1).
CAPITOLUL IV
Serviciile furnizate în cadrul asistenţei medicale
primare
Art. 71. - Cabinetul de medicină de familie furnizează
servicii medicale către pacienţii:
a) asiguraţi, înscrişi pe
lista proprie sau a altor cabinete;
b) neasiguraţi.
Art. 72. - Cabinetul de medicină de familie poate
desfăşura următoarele activităţi:
a) intervenţii de primă necesitate în urgenţele
medico-chirurgicale;
b) activităţi de medicină preventivă;
c) activităţi medicale curative;
d) activităţi de îngrijire la domiciliu;
e) activităţi de îngrijiri paliative;
f) activităţi de consiliere;
g) alte activităţi medicale, în conformitate cu
atestatele de studii complementare;
h) activităţi de învăţământ în specialitatea medicină
de familie, în cabinetele medicilor instructori formatori;
i) activităţi de cercetare ştiinţifică;
j) activităţi de suport.
Art. 73. - Activităţile medicale se pot desfăşura la
sediul cabinetului, la domiciliul pacienţilor, în centrele de permanenţă, în
alte locaţii special amenajate şi autorizate sau la locul solicitării, în cazul
intervenţiilor de primă necesitate în urgenţele medico-chirurgicale ori în caz
de risc epidemiologie.
Art. 74. - Cabinetul de medicină de familie poate oferi
servicii medicale esenţiale, servicii medicale extinse şi servicii medicale
adiţionale.
Art. 75. - (1) Serviciile
medicale esenţiale sunt acele servicii,
definitorii pentru domeniul de competenţă al asistenţei medicale primare, care
sunt oferite de toţi medicii de familie în cadrul consultaţiei medicale.
(2) Serviciile prevăzute la alin. (1) sunt următoarele:
a) intervenţii de primă necesitate în urgenţele
medico-chirurgicale;
b) asistenţa curentă a solicitărilor acute;
c) monitorizarea bolilor
cronice, care cuprinde: supraveghere medicală activă pentru cele mai frecvente
boli cronice, prescripţii de tratament medicamentos şi/sau igieno-dietetic,
coordonarea evaluărilor periodice efectuate de către medici de altă
specialitate decât cea de medicină de familie;
d) servicii medicale preventive, precum: imunizări,
monitorizarea evoluţiei sarcinii şi lăuziei, depistare activă a riscului de
îmbolnăvire pentru afecţiuni selecţionate conform dovezilor ştiinţifice,
supraveghere medicală activă, la adulţi şi copii asimptomatici cu risc normal
sau ridicat, pe grupe de vârstă şi sex.
Art. 76. - Serviciile medicale extinse sunt acele servicii care pot fi furnizate la nivelul asistenţei
medicale primare în mod opţional şi/sau în anumite condiţii de organizare, precum:
a) servicii speciale de consiliere;
b) planificare familială;
c) unele proceduri de mică chirurgie;
d) servicii medico-sociale: îngrijiri la domiciliu,
îngrijiri terminale.
Art. 77. - Serviciile
medicale adiţionale reprezintă manopere şi tehnici
însuşite de medicii practicieni, certificate prin atestate de studii
complementare şi/sau care necesită dotări speciale.
Art. 78. - (1) Colectarea şi transmiterea de date
pentru supravegherea bolilor comunicabile se realizează prin sisteme
informaţionale de rutină, care cuprind un set minimal de date, într-un format
unic, obligatoriu a fi transmise de către toţi furnizorii de servicii medicale
şi al căror conţinut, metodologie de colectare şi raportare se stabilesc prin
hotărâre a Guvernului.
(2) Supravegherea epidemiologică detaliată şi
colectarea de date privind utilizarea serviciilor medicale de către pacienţi
reprezintă un serviciu distinct şi se realizează prin cabinetele santinelă.
Acestea pot contracta servicii cu instituţiile interesate.
Art. 79. - Cabinetele de medicină de familie în care
îşi desfăşoară activitatea medici formatori de medicină de familie pot oferi
prestaţii de formare medicală, în cadrul colaborării cu instituţii de
învăţământ superior medical sau cu organizaţii acreditate ca furnizori de
educaţie medicală continuă, precum şi activităţi de cercetare, conform
dispoziţiilor legale în vigoare.
CAPITOLUL V
Finanţarea medicinei de familie
Art. 80. - Cabinetul de medicină de familie poate
realiza venituri din:
a) contracte încheiate cu
casele de asigurări de sănătate din cadrul sistemului de asigurări sociale de
sănătate, pentru serviciile esenţiale definite în prezenta lege, decontate din
fondul destinat asistenţei medicale primare;
b) contracte încheiate cu casele de asigurări de sănătate din cadrul sistemului de asigurări
sociale de sănătate, pentru serviciile extinse şi adiţionale definite în
prezenta lege şi decontate din fondurile destinate acestora;
c) contracte încheiate cu societăţile de asigurări
private de sănătate;
d) contracte pentru servicii furnizate în cadrul
programelor de sănătate publică;
e) contracte încheiate cu autorităţile teritoriale de
sănătate publică, pentru servicii de medicină comunitară;
f) contracte încheiate cu terţi, pentru servicii
aferente unor competenţe suplimentare;
g) plata directă de la consumatori, pentru serviciile
necontractate cu terţi plătitori;
h) copiata aferentă unor activităţi medicale;
i) contracte de cercetare;
j) contracte pentru activitatea didactică în educaţia
universitară şi postuniversitară;
k) donaţii, sponsorizări;
l) alte surse, conform
dispoziţiilor legale, inclusiv din valorificarea aparaturii proprii, uzată
fizic sau moral.
Art. 81. - Sumele alocate pentru finanţarea cabinetelor
de medicină de familie din Fondul naţional unic de asigurări sociale de
sănătate vor fi stabilite în cadrul negocierii Normelor de aplicare a
contractului-cadru anual, conform prevederilor legale.
CAPITOLUL VI
Rolul şi obligaţiile asistenţei medicale primare în
sistemul sanitar
Art. 82. - In procesul de furnizare de servicii
cabinetele medicilor de familie colaborează cu toate celelalte specialităţi
medicale, cu respectarea specificului specialităţii şi asigurarea transmiterii
reciproce a tuturor datelor relevante cu privire la starea
pacientului.
Art. 83. - Obligaţiile personalului şi cabinetelor de
medicină de familie se reglementează prin acte normative, după cum urmează:
a) obligaţiile de etică şi deontologie profesională -
prin legile şi codurile de deontologie profesională care guvernează exercitarea
profesiilor reglementate în sistemul sanitar;
b) obligaţiile privind sănătatea publică - conform
reglementărilor legale în vigoare şi dispoziţiilor autorităţilor de sănătate
publică;
c) obligaţiile faţă de sistemul asigurărilor sociale
de sănătate - prin contractul-cadru, normele anuale de aplicare şi contractele
cu casele de asigurări;
d) obligaţiile privind relaţiile de muncă - prin
contractul de muncă anual la nivel de ramură sanitară şi contractele
individuale/colective de muncă ale angajaţilor, precum şi prin alte prevederi
legale speciale;
e) obligaţiile faţă de pacienţi - prin îndeplinirea
prevederilor specifice din actele normative prevăzute la lit. a) şi c), precum
şi din legislaţia privind drepturile pacientului;
f) obligaţiile privind managementul evidenţei
medicale primare şi a informaţiei medicale gestionate - prin reglementările
legale în vigoare;
g) obligaţiile privind protecţia mediului şi
gestionarea deşeurilor rezultate din activitatea medicală - prin reglementările
legale în vigoare;
h) obligaţia de educaţie/formare continuă şi de
dezvoltare profesională a resursei umane din asistenţa medicală primară - prin
reglementările legale în vigoare.
CAPITOLUL VII
Dispoziţii finale
Art. 84. - In termen de 60 de
zile de la intrarea în vigoare a prezentului titlu, Ministerul Sănătăţii
Publice va elabora norme metodologice de aplicare a prezentului titlu, aprobate
prin hotărâre a Guvernului.
Art. 85. - La data intrării în vigoare a prezentului
titlu, orice dispoziţie contrară prevederilor prezentei legi se abrogă.
TITLUL IV
Sistemul naţional de asistenţă medicală de urgenţă şi
de prim ajutor calificat
CAPITOLUL I
Dispoziţii generale
SECŢIUNEA 1
Definiţii
Art. 86. - (1) In înţelesul prezentului titlu, în sistemul
naţional de servicii medicale de urgenţă şi de prim ajutor calificat, termenii
şi noţiunile folosite au următoarea semnificaţie:
a) Sistemul naţional de
servicii medicale de urgenţă şi prim ajutor calificat - ansamblul de structuri, forţe, mecanisme şi relaţii, organizate
după aceleaşi principii şi reguli, care utilizează proceduri integrate de
management specializat şi/sau calificat;
b) asistenţă publică
integrată de urgenţă - asistenţa asigurată de
instituţiile publice de stat aflate în structurile Ministerului Sănătăţii
Publice, Ministerului Administraţiei şi Internelor şi/sau în structura
autorităţilor publice locale, precum şi de Serviciul de Telecomunicaţii
Speciale prin Direcţia pentru apel unic de urgenţă 1-1-2. Ea include ansamblul
de măsuri şi activităţi cu caracter logistic, tehnic şi medical, destinate în
principal salvării şi păstrării vieţii;
c) asistenţă medicală
privată de urgenţă - ansamblul de măsuri şi
activităţi cu caracter logistic şi medical, având ca scop principal salvarea şi
păstrarea vieţii, asigurată de serviciile private de urgenţă aparţinând unor
organizaţii nonguvernamentale, care funcţionează în scop umanitar, nonprofit,
sau unor firme, asociaţii ori persoane fizice, care funcţionează în scop
comercial;
d) asistenţă
medicală de urgenţă - ansamblul de măsuri
diagnostice şi terapeutice întreprinse de către personal medical calificat. Ea
poate fi acordată la diferite niveluri de către medici şi asistenţi medicali cu
diferite grade de pregătire;
e) urgenţă medicală - accidentarea sau îmbolnăvirea acută,
care necesită acordarea primului ajutor calificat şi/sau a asistenţei medicale
de urgenţă, la unul sau mai multe niveluri de competenţă, după caz. Ea poate fi
urgenţă cu pericol vital, unde este necesară/sunt necesare una sau mai multe
resurse de intervenţie în faza prespitalicească, continuând îngrijirile într-un
spital local, judeţean ori regional, sau urgenţă fără pericol vital, unde
îngrijirile pot fi efectuate, după caz, cu sau fără utilizarea unor resurse
prespitaliceşti, la un centru ori cabinet medical autorizat sau, după caz, la
un spital;
f) pacient critic - pacientul
cu funcţiile vitale instabile sau cu afecţiuni care pot avea complicaţii
ireversibile şi care necesită intervenţie medicală de urgenţă sau îngrijiri
într-o secţie de terapie intensivă generală sau specializată;
g) primul ajutor de bază -
efectuarea unor acţiuni salvatoare de viaţă unor
persoane care au suferit o accidentare sau îmbolnăvire acută, de către persoane
fără pregătire medicală, fără utilizarea unor echipamente specifice acestui
scop. Primul ajutor de bază se acordă de orice persoană instruită în acest sens
sau de persoane fără instruire, la indicaţiile personalului din dispeceratele
de urgenţă;
h) primul ajutor calificat - efectuarea unor acţiuni salvatoare de viaţă unor persoane care au suferit o
accidentare sau îmbolnăvire acută, de către personal paramedical care a urmat
cursuri speciale de formare şi care are în dotare echipamentele specifice
acestui scop, inclusiv defibrilatoare semiautomate, funcţionând sub formă de
echipe de prim ajutor într-un cadru instituţionalizat;
i) defibrilator semiautomat - defibrilatorul care are drept caracteristici minime efectuarea
analizei ritmului cardiac într-un mod automat sau în urma apăsării unui buton
de către salvator, alegerea energiei şocului în vederea defibrilării în mod
automat, încărcarea la nivelul energiei necesare pentru defibrilare în mod
automat, urmând ca declanşarea şocului să se efectueze de către salvator, la
comanda verbală şi/sau scrisă a defibrilatorului;
j) spital local/centru local
de urgenţă - spitalul la nivelul unui municipiu,
al unui oraş, respectiv centru de permanenţă, cu competenţele şi resursele
umane şi materiale necesare rezolvării unei părţi din urgenţele locale, urmând
ca urgenţele ce nu pot fi rezolvate definitiv să fie stabilizate şi transferate
către spitalul judeţean sau direct către spitalul regional, după caz, în
conformitate cu protocoalele în vigoare;
k) spital judeţean de
urgenţă - spitalul aflat în reşedinţa unui judeţ,
care deţine competenţele şi resursele umane şi materiale în vederea asigurării
îngrijirilor medicale definitive de urgenţă pentru majoritatea cazurilor care
provin din judeţul respectiv şi care nu pot fi tratate definitiv la nivel
local, în spitalele municipale sau orăşeneşti ori în centrele de permanenţă, în
conformitate cu protocoalele în vigoare;
l) spital regional de
urgenţă - spitalul clinic judeţean cu competenţe
interjudeţene, care deţine competenţele şi resursele umane şi materiale suplimentare
necesare în vederea asigurării îngrijirilor medicale definitive pentru cazurile
medicale complexe, mai ales în cazul urgenţelor şi al pacienţilor aflaţi în
stare critică, pentru toate cazurile ce nu pot fi rezolvate local, în spitalele
municipale şi orăşeneşti, la nivelul judeţului respectiv, precum şi pentru
toate cazurile din judeţele arondate, ce nu pot fi rezolvate
definitiv la nivelul spitalelor judeţene din cauza
lipsei de resurse materiale şi/sau umane ori din cauza complexităţii cazului,
în conformitate cu protocoalele în vigoare. Spitalul regional de urgenţă
îndeplineşte rolul spitalului judeţean de urgenţă în judeţul în care se află;
m) serviciul de ambulanţă
judeţean, respectiv al municipiului Bucureşti - unităţile
sanitare publice de importanţă strategică, cu personalitate juridică, aflate în
coordonarea departamentului de specialitate din Ministerul Sănătăţii Publice şi
a autorităţilor de sănătate publică judeţene, respectiv a municipiului
Bucureşti, având în structura lor un compartiment pentru asistenţă medicală de
urgenţă şi transport medical asistat, cu echipaje medicale de urgenţă, cu sau
fără medic, şi un compartiment pentru consultaţii medicale de urgenţă la
domiciliu şi transport sanitar neasistat. Compartimentul pentru asistenţă
medicală de urgenţă funcţionează în regim de lucru continuu, în aşteptarea
solicitărilor de asistenţă medicală de urgenţă;
n) transport medical asistat - transportul de urgenţă al pacienţilor care necesită monitorizare şi
îngrijiri medicale pe durata transportului, asigurate de medic sau asistent
medical, utilizând ambulanţe tip B sau C;
o) transport sanitar neasistat - transportul pacienţilor care nu se află în stare critică şi nu
necesită monitorizare şi îngrijiri medicale speciale pe durata transportului,
transportul sanitar neasistat se efectuează cu ambulanţe tip A1 sau A2, precum
şi cu alte tipuri de autovehicule decât ambulanţele tip B şi C, aflate în
dotarea serviciilor de ambulanţă;
p) ambulanţă tip C - ambulanţa destinată intervenţiei medicale de urgenţă la cel mai
înalt nivel şi transportului medical asistat al pacientului critic, fiind
dotată cu echipamente, materiale şi medicamente de terapie intensivă. Echipajul
ambulanţei tip C este condus obligatoriu de un medic special pregătit, iar vehiculul
este astfel construit încât să permită accesul la pacientul aflat în vehicul
din toate părţile, targa fiind amplasată în mijloc, cu posibilitatea mutării
acesteia la dreapta şi la stânga şi ridicării ei la o înălţime care să permită
acordarea asistenţei medicale de urgenţă în mod corespunzător. Ambulanţele de
transport al nou-născuţilor aflaţi în stare critică fac parte din categoria
ambulanţelor tip C;
q) ambulanţă tip B - ambulanţa destinată intervenţiei de urgenţă şi transportului
medical asistat al pacienţilor. Ea poate fi, după caz, utilizată în acordarea
primului ajutor calificat sau în acordarea asistenţei medicale de urgenţă.
Dotarea ambulanţei tip B este formată din echipamente şi materiale sanitare
care includ, după caz, un defibrilator semiautomat sau un defibrilator manual
şi medicamentele necesare resuscitării şi acordării asistenţei medicale de
urgenţă;
r) ambulanţă tip A1 - ambulanţa destinată transportului sanitar neasistat al unui singur
pacient, fiind dotată cu echipamentele şi materialele minime necesare acordării
primului ajutor în caz de nevoie;
s) ambulanţă tip A2 - ambulanţa destinată transportului sanitar neasistat al unuia sau al
mai multor pacienţi pe targa şi/sau scaune, fiind dotată cu echipamentele şi
materialele minime necesare acordării primului ajutor în caz de nevoie;
t) Serviciul mobil de
urgenţă, reanimare şi descarcerare (SMURD) - unitatea
de intervenţie publică integrată, de importanţă strategică, fără personalitate
juridică, având în structura sa echipe integrate de reanimare, specializate în
acordarea asistenţei medicale şi tehnice de urgenţă, precum şi echipe cu
personal paramedical, specializat în acordarea primului ajutor calificat. SMURD
funcţionează în cadrul inspectoratelor pentru situaţii de urgenţă, având ca operator
aerian structurile de aviaţie ale Ministerului Administraţiei şi Internelor, în
colaborare cu spitalele judeţene, regionale şi cu autorităţile publice locale;
u) unitate de primire a
urgenţelor (UPU) - secţia sau secţia clinică
aflată în structura unui spital judeţean, regional sau în structura spitalelor
aparţinând ministerelor şi instituţiilor cu reţele sanitare proprii, cu
personal propriu, special pregătit, destinată triajului, evaluării şi
tratamentului de urgenţă al pacienţilor cu afecţiuni acute, care se prezintă la
spital spontan sau care sunt transportaţi de ambulanţe;
v) compartiment de primire a
urgenţelor (CPU) - secţia aflată în structura unui
spital orăşenesc, municipal sau în structura spitalelor aparţinând ministerelor
şi instituţiilor cu reţele sanitare proprii, cu personal propriu, special
pregătit, destinată triajului, evaluării şi tratamentului de urgenţă al
pacienţilor cu afecţiuni acute, care se prezintă la spital spontan sau care
sunt transportaţi de ambulanţe;
w) Sistemul naţional unic
pentru apeluri de urgenţă - 1-1-2 - ansamblul
integrat de puncte publice de acces al cetăţeanului la sistemul public de
urgenţă prin care este activat răspunsul adecvat de urgenţă. Punctul public de
acces este realizat prin integrarea centrului unic de apel de urgenţă şi a
dispeceratelor serviciilor publice specializate de intervenţie;
x) centrul unic de apel de
urgenţă - structura specializată de preluare şi
transfer al apelurilor de urgenţă primite la numărul unic de apel 1-1-2 şi la
numărul de apel 961 redirecţionat către 1-1-2 până la transformarea acestuia în
număr comercial la dispoziţia serviciilor de ambulanţă judeţene şi al
municipiului Bucureşti;
y) dispecerat medical de
urgenţă - structura specializată de preluare şi
tratare a apelurilor de urgenţă cu caracter medical, primite prin centrul unic
de apel de urgenţă sau la un număr propriu, în cazul serviciilor private de
ambulanţă. Dispeceratele medicale de urgenţă sunt coordonate de personal cu
pregătire medicală superioară, în serviciu permanent;
z) dispeceratul integrat de
urgenţă - structura specializată care, pe lângă
preluarea apelului la numărul de urgenţă, asigură alarmarea şi coordonarea
echipajelor de intervenţie ale tututor serviciilor specializate de intervenţie,
cu caracter medical şi nemedical, din aceeaşi locaţie fizică. Coordonarea se
face de către personal special pregătit, având un coordonator medical cu studii
superioare din cadrul serviciului de ambulanţă sau SMURD, în serviciu
permanent.
(2) In înţelesul prezentului titlu, în sistemul
naţional de servicii medicale de urgenţă şi de prim ajutor calificat, termenii
şi noţiunile folosite au următoarea semnificaţie:
a) centre de expertiză şi
coordonare medicală la distanţă - centrele aflate
în structura unor dispecerate medicale sau în
structura unor centre de apel unic 1-1-2, destinate furnizării de informaţii de
specialitate specifice necesare echipajelor de urgenţă din teren şi/sau
spitalelor de urgenţă, precum şi coordonării la distanţă a echipajelor de prim
ajutor calificat, pe baza informaţiilor primite telefonic de la membrii
echipajelor sau pe baza informaţiilor şi a datelor primite prin sistemele
telemedicale de transmisie de date;
b) misiuni de salvare
aeriană - intervenţii primare sau secundare ce se
desfăşoară utilizând aeronave special dotate, respectând standardele în
vigoare, în vederea salvării unei/unor vieţi aflate în pericol din cauza unei
accidentări sau îmbolnăviri acute ori care se află într-un mediu ostil vieţii;
c) misiuni de ambulanţă
aeriană - transporturi
sanitare, planificate în prealabil, în care starea pacientului sau a
pacienţilor nu impune efectuarea unei misiuni de salvare aeriană. Misiunile de ambulanţă aeriană
pot include şi cazurile critice transportate pe distanţe lungi, ce nu pot fi
efectuate decât cu avionul sanitar;
d) misiuni de salvare
navală - misiuni primare sau secundare care se
desfăşoară în zone accesibile mai rapid sau numai prin utilizarea de
ambarcaţiuni special dotate, respectând standardele în vigoare, în vederea
salvării persoanelor aflate în pericol din cauza unei accidentări sau
îmbolnăviri acute;
e) consultaţia de urgenţă
la domiciliu - asistenţa medicală de urgenţă
acordată de compartimentul de consultaţii şi transport sanitar neasistat al
serviciilor de ambulanţă, în colaborare cu medicii de familie, cazurilor
medicale de urgenţă care nu pun viaţa pacientului în pericol imediat şi care,
cel mai probabil, nu necesită transportul la o unitate sanitară;
f) personal paramedical - personalul fără pregătire medicală, instruit special la diferite
niveluri în acordarea primului ajutor calificat, utilizând echipamente
specifice, inclusiv defibrilatoarele semiautomate externe, activând în echipe,
într-un cadru instituţionalizat;
g) ambulanţierul - personal fără pregătire medicală care a absolvit cursurile de
ambulanţieri, autorizate de Ministerul Sănătăţii Publice, pentru a activa în
cadrul serviciilor de ambulanţă;
h) accident colectiv - evenimentul
care implică un număr de victime, care necesită declanşarea unui plan special de
intervenţie utilizând forţe de intervenţie suplimentare faţă de cele aflate de
gardă la momentul respectiv. Numărul victimelor pentru care este necesară
declanşarea unui plan special de intervenţie diferă de la caz la caz, luându-se
în considerare resursele umane şi materiale de intervenţie disponibile în zona
în care are loc accidentul.
SECŢIUNEA a 2-a
Primul ajutor de bază şi primul ajutor calificat
Art. 87. - (1) Acordarea primului ajutor de bază, fără
echipamente specifice, se efectuează de orice persoană instruită în acest sens
sau de persoane fără instruire prealabilă acţionând la indicaţiile personalului
specializat din cadrul dispeceratelor medicale de urgenţă sau al serviciilor de
urgenţă prespitalicească de tip SMURD şi serviciului de ambulanţă judeţean sau
al municipiului Bucureşti, având ca scop prevenirea complicaţiilor şi salvarea
vieţii până la sosirea unui echipaj de intervenţie.
(2) Fiecare cetăţean are obligaţia să anunţe direct
sau să se asigure că un caz de urgenţă a fost anunţat deja, la numărul 1-1-2,
înainte sau concomitent cu acordarea primului ajutor, fiind obligat să respecte
indicaţiile specializate oferite de personalul dispeceratului de urgenţă.
(3) Acordarea primului ajutor calificat se efectuează
în regim public, este o datorie a statului şi un drept al cetăţeanului şi nu
poate fi efectuată în scop comercial.
(4) Primul ajutor calificat se acordă într-un cadru
instituţionalizat, de echipe aflate sub coordonarea inspectoratelor pentru
situaţii de urgenţă, în colaborare cu autorităţile publice locale şi
structurile Ministerului Sănătăţii Publice.
(5) Echipele de prim ajutor calificat vor fi dotate
cu echipamente specifice, inclusiv pentru defibrilare semiautomată.
(6) Personalul din cadrul echipajelor de prim ajutor
calificat şi ambulanţierii vor fi formaţi şi
autorizaţi în utilizarea defibrilatoarelor semiautomate.
(7) Echipele de prim ajutor pot opera utilizând
ambulanţe tip B, conform normelor şi standardelor naţionale şi europene în
vigoare, şi autospeciale de intervenţie fără capacitate de transport pacient,
dotate cu echipamentele specifice, inclusiv defibrilatoare semiautomate.
(8) Acordarea primului ajutor calificat este
organizată astfel încât timpul maxim de sosire la locul intervenţiei de la apelul
de urgenţă să nu depăşească:
a) 8 minute, pentru echipajele de prim ajutor
calificat, în zonele urbane, la cel puţin 90% din cazurile de urgenţă;
b) 12 minute, pentru echipajele de prim ajutor
calificat, în zonele rurale, la cel puţin 75% din cazurile de urgenţă.
(9) Organizaţiile nonguvernamentale şi cele nonprofit
pot participa în această activitate, pe baza unor protocoale de colaborare cu
inspectoratele pentru situaţii de urgenţă şi cu autorităţile publice locale.
(10) Salvamontul, Salvamarul, Jandarmeria montană, Unitatea Specială de Intervenţie în Situaţii de Urgenţă
din subordinea Inspectoratului General pentru Situaţii de Urgenţă şi alte
instituţii publice similare pot avea personal instruit în primul ajutor
calificat, care acţionează în cadrul misiunilor specifice de salvare asigurate
de aceste instituţii.
Art. 88. - (1) Persoanele fără pregătire medicală care
acordă primul ajutor de bază în mod voluntar, pe baza indicaţiilor furnizate de
un dispecerat medical sau a unor cunoştinţe în domeniul primului ajutor de
bază, acţionând cu bună-credinţă şi cu intenţia de a salva viaţa sau sănătatea
unei persoane, nu răspund penal sau civil.
(2) Personalul paramedical nu răspunde penal ori civil,
după caz, dacă se constată, potrivit legii, îndeplinirea de către acesta, cu
bună-credinţă, a oricărui act în legătură cu acordarea primului ajutor
calificat, cu respectarea competenţei acordate, protocoalelor şi procedurilor
stabilite în condiţiile legii.
Art. 89. - (1) Personalul paramedical care activează în
cadrul echipajelor de prim ajutor calificat este pregătit în instituţiile de
învăţământ şi în centrele de formare specializate aflate în structura
Inspectoratului General pentru Situaţii de Urgenţă şi/sau în alte centre de
formare autorizate şi acreditate aflate în structura instituţiilor publice care
deţin echipaje de prim ajutor calificat conform prezentei legi.
(2) Formarea personalului specializat în acordarea
primului ajutor calificat se va efectua pe baza unui program aprobat de
inspectorul general al Inspectoratului General pentru
Situaţii de Urgenţă, acreditat şi autorizat de Ministerul Sănătăţii Publice şi
Ministerul Educaţiei şi Cercetării. Acesta include condiţiile de certificare şi
recertificare a personalului, precum şi necesităţile de formare continuă.
Art. 90. - Finanţarea activităţii echipajelor de prim
ajutor calificat şi dotarea acestora se fac de la bugetul de stat, bugetul
autorităţilor publice locale şi din alte resurse financiare prevăzute în lege,
inclusiv sponsorizări şi donaţii.
SECŢIUNEA a 3-a
Asistenţa medicală publică de urgenţă
Art. 91. - (1) Asistenţa medicală publică de urgenţă în
faza prespitaliceasca este asigurată de serviciile de ambulanţă judeţene şi de
cel al municipiului Bucureşti, precum şi de echipajele integrate ale
Serviciilor mobile de urgenţă, reanimare şi descarcerare (SMURD), aflate în
structura inspectoratelor pentru situaţii de urgenţă, a autorităţilor publice
locale şi a spitalelor judeţene şi regionale.
(2) Personalul medical, precum şi personalul nemedical
- ambulanţieri, pompieri şi conducători auto - din cadrul echipajelor care
participă la acordarea asistenţei medicale publice de urgenţă în faza
prespitaliceasca vor fi pregătite în centre de formare acreditate şi autorizate de Ministerul
Sănătăţii Publice.
(3) Personalul din cadrul
centrelor de apel unic de urgenţă 1-1-2, precum şi din cadrul dispeceratelor
medicale va fi special pregătit în centre de formare acreditate şi autorizate
de Ministerul Sănătăţii Publice, Ministerul Administraţiei şi Internelor şi
Serviciul de Telecomunicaţii Speciale.
(4) Centrele de apel unic de urgenţă 1-1-2 şi
dispeceratele medicale pot avea în structura lor centre de expertiză regionale,
în vederea furnizării unor informaţii specifice, precum şi în vederea
coordonării la distanţă a activităţii echipajelor de prim ajutor calificat
aflate în misiune, pe baza informaţiilor obţinute telefonic sau prin sisteme de
transmisie de date.
(5) Asistenţa medicală publică de urgenţă în faza
prespitaliceasca se va acorda utilizând ambulanţe tip B şi C, construite şi
dotate conform standardelor şi normelor europene în vigoare. In acordarea
asistenţei medicale publice de urgenţă se pot utiliza şi autospeciale de
transport echipaj medical, fără capacitate de transport pacient, nave, aeronave,
precum şi alte mijloace autorizate de Ministerul Sănătăţii Publice.
(6) Asistenţii medicali din cadrul echipajelor de
urgenţă prespitaliceasca vor fi instruiţi şi autorizaţi în utilizarea
defibrilatoarelor semiautomate, iar medicii vor fi unicii autorizaţi în utilizarea defibrilatoarelor manuale.
(7) Asistenţa medicală publică de urgenţă în faza
spitalicească este asigurată de spitalele orăşeneşti, municipale, judeţene şi
regionale aflate în structura Ministerului Sănătăţii Publice şi/sau a autorităţilor
publice locale.
Art. 92. - (1) Acordarea asistenţei medicale publice de
urgenţă, la toate nivelurile ei, este o datorie a statului şi un drept al
cetăţeanului. Aceasta va include şi misiunile de salvare aeriană şi navală.
(2) Acordarea asistenţei medicale publice de urgenţă
nu poate avea un scop comercial.
(3) Asistenţa medicală de urgenţă în prespital va fi
organizată astfel încât timpul maxim de sosire la locul intervenţiei de la
apelul de urgenţă să nu depăşească:
a) 15 minute, pentru echipajele de urgenţă sau de terapie intensivă, în zonele urbane, la cel puţin 90%
din cazurile de urgenţă;
b) 20 de minute, pentru echipajele de urgenţă sau de
terapie intensivă, în zonele rurale, la cel puţin 75% din cazurile de urgenţă.
Art. 93. - (1) Finanţarea acordării asistenţei medicale
publice de urgenţă se face de la bugetul de stat, prin bugetul Ministerului
Sănătăţii Publice şi bugetul Ministerului Administraţiei şi Internelor, din
bugetul Fondului naţional unic de asigurări sociale de sănătate, din bugetul
autorităţilor publice locale, precum şi din alte surse prevăzute prin lege,
inclusiv donaţii şi sponsorizări.
(2) Donaţiile şi sponsorizările către serviciile
publice de urgenţă nu pot fi efectuate în vederea obţinerii unor privilegii
care duc la discriminare în acordarea asistenţei de urgenţă, cum ar fi:
asigurarea asistenţei medicale de urgenţă sau a primului ajutor calificat în
mod preferenţial donatorului, sponsorului sau altor persoane.
(3) Serviciile medicale publice de urgenţă pot achiziţiona
echipamente, autospeciale şi alte mijloace de intervenţie direct, în sistem
leasing sau contractând credite având ca sursă de finanţare veniturile proprii
şi/sau bugetul de stat, precum şi alte surse prevăzute de lege, inclusiv
donaţii şi sponsorizări.
(4) In cadrul sumelor alocate
de la bugetul de stat potrivit alin. (1), Ministerul Sănătăţii Publice va
asigura în cadrul programelor de sănătate fonduri pentru spitalele regionale de
urgenţă şi spitalele judeţene de urgenţă de grad II,
pentru îngrijirea cazurilor critice ale căror costuri
nu pot fi acoperite din fondurile obţinute pe baza contractelor cu casele de
asigurări de sănătate.
(5) Unităţile şi compartimentele de primire a
urgenţelor din cadrul spitalelor de urgenţă sunt finanţate în mod distinct cu
sumele necesare acordării asistenţei medicale de urgenţă sub forma unui procent
calculat din veniturile obţinute de spitalul în structura căruia se află, în
baza contractelor încheiate cu casele de asigurări de sănătate, luându-se în
considerare numărul total al pacienţilor, procentul cazurilor critice şi
nivelul de competenţă al personalului care activează în UPU sau CPU. Stabilirea
procentului se face prin normele de aplicare a prezentului titlu.
SECŢIUNEA a 4-a
Asistenţa medicală privată de urgenţă
Art. 94. - (1) Asistenţa
medicală privată de urgenţă în faza prespitalicească este asigurată de
serviciile private de ambulanţă, pe baza unui contract direct cu beneficiarul,
cu asigurătorul privat al acestuia sau la solicitarea directă a beneficiarului
ori a oricărei alte persoane, cu consimţământul acestuia.
(2) Personalul medical, precum şi personalul nemedical
care participă la acordarea asistenţei medicale private de urgenţă în faza
prespitalicească sunt pregătite în centre de formare acreditate şi autorizate
de Ministerul Sănătăţii Publice. Programele de formare prevăd condiţiile de
certificare a personalului medical, necesităţile de formare continuă şi
recertificarea acestuia.
Art. 95. - (1) Asistenţa medicală privată de urgenţă în
faza spitalicească este asigurată de spitalele private, pe baza unui contract
direct cu beneficiarul, cu asigurătorul privat al acestuia sau la solicitarea
directă a beneficiarului ori a aparţinătorilor acestuia. In cazul pacienţilor
cu funcţiile vitale în pericol, spitalele private au obligaţia de a acorda
gratuit primul ajutor, până la transferul acestora în condiţii de siguranţă la
un spital public.
(2) Asistenţa medicală privată de urgenţă este
acordată de instituţii private, cu respectarea standardelor minime de calitate
şi de operare impuse serviciilor publice de Ministerul Sănătăţii Publice.
(3) Asistenţa medicală privată de urgenţă include şi
misiuni de ambulanţă aeriană asigurate în baza unor contracte cu beneficiarii
sau cu asigurătorii privaţi ai acestora.
Art. 96. - Publicitatea şi
reclama pentru asistenţa medicală privată de urgenţă cu scop comercial vor
specifica întotdeauna, în mod clar, că numerele de apel nu sunt gratuite şi că
serviciile se prestează contra cost.
CAPITOLUL II
Acordarea asistenţei publice medicale şi tehnice de
urgenţă şi a primului ajutor calificat
Art. 97. - Asistenţa publică de urgenţă
prespitalicească este coordonată la nivel judeţean sau regional de
dispeceratele medicale specializate, utilizând infrastructura Sistemului
naţional unic pentru apeluri de urgenţă, în conformitate cu prevederile legale
în vigoare şi cu normele de aplicare a prezentei legi. In activitatea de
dispecerizare se utilizează clasificarea unică a cazurilor de urgenţă, denumită
index medical, şi setul
de indicaţii şi planuri de acţiune şi coordonare asociate indexului medical şi
specificului local, care sunt aprobate de Ministerul Sănătăţii Publice,
Ministerul Administraţiei şi Internelor şi Serviciul de Telecomunicaţii
Speciale.
Art. 98. - (1) Asistenţa publică de urgenţă
prespitalicească se organizează la nivel rural, urban, judeţean/al municipiului
Bucureşti şi regional.
(2) Asistenţa publică de urgenţă prespitalicească se
acordă la diferite niveluri de competenţă, începând cu primul ajutor calificat,
asigurat de echipajele aflate la nivel rural, până la nivelul intervenţiei de
salvare aeriană cu personal medical specializat, care operează la nivel
regional.
(3) Competenţele şi atribuţiile echipajelor publice
de intervenţie de diferite niveluri în faza prespitalicească se stabilesc prin
ordin comun al ministrului sănătăţii publice şi al ministrului administraţiei
şi internelor.
(4) Ministerele şi instituţiile cu reţele sanitare
proprii pot avea în administrarea lor servicii proprii de ambulanţă, sub formă
de proprietate publică sau privată a statului.
(5) La nivel spitalicesc, asistenţa medicală de
urgenţă se asigură în spitalele orăşeneşti, municipale, judeţene şi regionale
şi ale municipiului Bucureşti, precum şi ale ministerelor şi instituţiilor
publice cu reţele sanitare proprii.
(6) In spitale pot opera unităţi proprii de transport
sanitar medicalizat, pentru transportul interclinic al pacienţilor proprii,
precum şi al nou-născuţilor aflaţi în stare critică. Modul de organizare şi funcţionare
a acestor unităţi se va stabili prin normele de
aplicare a prezentului titlu.
(7) Primul ajutor calificat şi asistenţa medicală de
urgenţă se acordă fără nici o discriminare legată de, dar nu limitată la,
venituri, sex, vârstă, etnie, religie, cetăţenie sau apartenenţă politică,
indiferent dacă pacientul are sau nu calitatea de asigurat medical.
(8) Personalul medical şi cel paramedical instruit în
primul ajutor calificat au obligaţia ca în afara programului, indiferent de
loc, să acorde primul ajutor, spontan sau la cerere, persoanelor aflate în
pericol vital, până la preluarea acestora de către un echipaj de intervenţie
specializat.
(9) Echipajele medicale publice de urgenţă, precum şi
echipajele de prim ajutor calificat, în cazuri deosebite, pot acorda asistenţă
de urgenţă şi în afara zonelor de responsabilitate, la solicitarea
dispeceratelor de urgenţă.
(10) Asistenţa medicală de urgenţă la spectacole în
aer liber, festivaluri şi manifestări sportive se solicită obligatoriu de către
organizator, pe baza unor contracte încheiate cu serviciile private sau publice
de urgenţă prespitalicească. Autorităţile publice aprobă desfăşurarea acestor
evenimente numai în cazul în care asistenţa medicală de urgenţă este asigurată
în mod adecvat, conform normelor în vigoare.
Art. 99. - (1) Serviciile
publice de urgenţă prespitalicească nu pot fi subcontractate de serviciile
private în vederea acoperirii lipsei de mijloace ale serviciilor private. Ele
nu pot acorda prioritate clienţilor serviciilor private sau unor clienţi
proprii şi nu pot rezerva echipaje de urgenţă pentru înlocuirea unor echipaje
ale unor servicii private.
(2) Societăţile comerciale care au în proprietatea
lor servicii private de ambulanţă nu pot acorda donaţii sau sponsorizări
serviciilor publice de urgenţă prespitalicească.
(3) Serviciile publice de urgenţă pot presta servicii
contra cost unor societăţi comerciale, altele decât serviciile de ambulanţă
private, cluburi sportive sau instituţii, în vederea asigurării asistenţei de
urgenţă în cazul unor manifestări sportive sau de altă natură, pe durată
limitată, cu condiţia ca personalul şi mijloacele folosite în asigurarea
evenimentului să nu fie retrase din resursele necesare asigurării asistenţei de
urgenţă a populaţiei în intervalul respectiv.
Art. 100. - (1) Pentru
realizarea managementului integrat al urgenţelor se creează o reţea regională
de spitale, având un spital regional de urgenţă de gradul I şi, în judeţele arondate acestuia,
spitale de urgenţă de gradul II sau III. In fiecare regiune va funcţiona minimum un spital de
urgenţă de gradul II, într-un
alt judeţ din afara centrului regional de gradul I.
(2) Criteriile de clasificare a spitalelor de urgenţă
locale şi judeţene, din punct de vedere al competenţelor şi resurselor materiale
şi umane, se aprobă prin ordin al ministrului sănătăţii publice.
Art. 101. - (1) Spitalele regionale de urgenţă se
înfiinţează în regiunile de dezvoltare socioeconomică, având la bază resursele
umane şi materiale aflate în centrele universitare tradiţionale.
(2) In structura spitalelor
regionale de urgenţă se află toate specialităţile chirurgicale şi medicale din
structura spitalului judeţean din judeţul respectiv, precum şi infrastructura
pentru investigaţii clinice şi paraclinice şi orice altă specialitate unică, cu
caracter de urgenţă, aflată în afara structurii spitalului judeţean din judeţul
respectiv.
(3) Spitalele regionale şi judeţene de urgenţă au în
structura lor unităţi de primire a urgenţelor.
(4) Conducerea şi organizarea unităţilor de primire a
urgenţelor se vor face conform normelor de aplicare a
prezentului titlu.
(5) Medicii şi asistenţii-şefi ai unităţilor de
primire a urgenţelor nu pot fi sponsorizaţi şi/sau finanţaţi, direct sau
indirect, pentru participare la conferinţe, congrese şi alte tipuri de
manifestări, de către firmele care comercializează produse farmaceutice şi/sau
materiale sanitare ori firmele care reprezintă interesele acestora şi nici de
către firmele de aparatură medicală. In situaţii speciale, bine justificate, se
pot obţine excepţii doar cu aprobarea Ministerului Sănătăţii Publice.
(6) Spitalele municipale şi orăşeneşti pot avea
compartimente de primire a urgenţelor sau camere de reanimare în zonele de
recepţie a urgenţelor, acestea urmând a fi deservite de personalul de gardă din
spital şi/sau de medici de urgenţă special angajaţi.
(7) Spitalele regionale de urgenţă şi spitalele
judeţene de urgenţă au în responsabilitate, prin unităţile de primire a
urgenţelor, echipaje integrate publice de intervenţie prespitalicească terestră
(SMURD), în colaborare cu structurile Ministerului Administraţiei şi Internelor
şi cu autorităţile publice locale, care sunt coordonate de dispeceratele
Sistemului naţional unic pentru apelul de urgenţă.
(8) Spitalele regionale de urgenţă au în
responsabilitate echipaje integrate publice de salvare aeriană, respectând
prevederile legale în vigoare.
(9) Implementarea prevederilor alin. (7) şi (8) se
realizează gradual, conform unui plan aprobat prin ordin comun al ministrului sănătăţii
publice şi al ministrului administraţiei şi internelor, având la bază resursele
materiale şi umane disponibile.
(10) Arondarea judeţelor la centrele regionale se
efectuează pe baza ordinului ministrului sănătăţii publice, luându-se în
considerare regiunile de dezvoltare socio-economică din care fac parte, precum
şi distanţele aeriene şi terestre dintre un spital judeţean şi un anumit centru
regional.
(11) In structura spitalelor regionale şi a spitalelor
de urgenţă de gradele II şi
III funcţionează unităţi de primire a urgenţelor, corespunzătoare nivelului
centrului în care se află şi numărului cazurilor de urgenţă asistate anual.
(12) Spitalele regionale de urgenţă au obligaţia de a
monitoriza şi de a îndruma metodologic întreaga activitate de asistenţă
medicală de urgenţă din regiunile pe care le deservesc.
(13) Modalităţile de monitorizare şi îndrumare, precum
şi modalităţile de colectare a datelor se stabilesc prin ordin al ministrului
sănătăţii publice.
Art. 102. - (1) Spitalele judeţene de urgenţă, precum
şi spitalele regionale de urgenţă au obligaţia de a accepta transferul
pacienţilor aflaţi în stare critică, dacă spitalul sau centrul unde se află
pacientul respectiv nu are resursele umane şi/sau materiale necesare acordării
asistenţei de urgenţă în mod corespunzător şi definitiv şi dacă transferul este
necesar în vederea salvării vieţii pacientului.
(2) Centrele şi spitalele locale de urgenţă, precum
şi spitalele judeţene de urgenţă organizează transferul pacienţilor critici, în
mod corespunzător, evitând întârzierile nejustificate, către un centru
superior, dacă rezolvarea definitivă a cazului depăşeşte competenţele sau
resursele spitalului în care se află aceştia.
(3) Protocoalele de transfer interclinic al
pacientului critic se aprobă prin ordin al ministrului sănătăţii publice.
Spitalele regionale şi cele judeţene de urgenţă, precum şi spitalele de urgenţă
din municipiul Bucureşti vor furniza dispeceratului de urgenţă, periodic sau la
solicitare, datele necesare privind locurile şi resursele medicale disponibile
pentru rezolvarea cazurilor de urgenţă.
(4) Criteriile de internare de urgenţă a pacienţilor
care sunt consultaţi şi asistaţi în unităţile/compartimentele de primire a
urgenţelor, precum şi criteriile de transfer de urgenţă către alte spitale vor
fi stabilite prin normele de aplicare a prezentului
titlu.
CAPITOLUL III
Acordarea asistenţei medicale private de urgenţă
Art. 103. - (1) Asistenţa medicală privată de urgenţă
în faza prespitalicească este coordonată la nivelul dispeceratului propriu al
furnizorului de servicii de către personal medical cu studii superioare.
(2) Asistenţa medicală privată de urgenţă în faza
prespitalicească se organizează pe o zonă stabilită de furnizorul de servicii,
cu condiţia ca acesta să aibă mijloacele necesare acoperirii zonei respective
în timpii prevăzuţi pentru serviciile publice pentru diferite categorii de
urgenţă.
(3) Asistenţa medicală privată de urgenţă în faza
prespitalicească este asigurată cu ambulanţe şi echipamente care respectă
normele şi standardele minime impuse serviciilor publice de urgenţă
prespitalicească.
Art. 104. - (1) Serviciile medicale private de urgenţă
prespitalicească nu pot contracta serviciile publice în vederea acoperirii unor
zone sau activităţi care nu pot fi acoperite prin capacitatea proprie.
(2) Serviciile medicale private spitaliceşti de
urgenţă se organizează în structura spitalelor private, respectând standardele
minime impuse de Ministerul Sănătăţii Publice pentru serviciile publice
spitaliceşti de urgenţă.
(3) Serviciile medicale
private de urgenţă spitalicească au obligaţia de a stabiliza orice pacient care
soseşte în serviciul respectiv în stare critică sau cu acuze ce ridică
suspiciunea unei afecţiuni acute grave, indiferent de capacitatea financiară a
acestuia de a achita costurile tratamentului şi de calitatea sa de asigurat,
acesta putând fi transportat la un spital public, în condiţii corespunzătoare,
numai după stabilizarea funcţiilor vitale şi acordarea tratamentului de
urgenţă.
(4) In cazul în care nu au în structură servicii de
gardă, spitalele private au obligaţia să acorde primul ajutor şi să alerteze
serviciile de urgenţă publice prin numărul unic pentru apeluri de urgenţă
1-1-2.
CAPITOLUL IV
Serviciile de ambulanţă judeţene şi al municipiului
Bucureşti
Art. 105. - (1) Serviciile de
ambulanţă judeţene şi al municipiului Bucureşti sunt servicii publice cu
personalitate juridică.
(2) Serviciile de ambulanţă judeţene şi al
municipiului Bucureşti au ca scop principal acordarea asistenţei medicale de
urgenţă şi transportul medical asistat, utilizând, după caz, personal medical
superior şi/sau mediu calificat la diferite niveluri, precum şi conducători
auto formaţi ca ambulanţieri.
(3) Personalul de intervenţie din cadrul serviciilor
de ambulanţă judeţene şi al municipiului Bucureşti va purta echipamente de
protecţie distincte conform normelor şi reglementărilor în vigoare.
Art. 106. - (1) Serviciile de ambulanţă judeţene şi al
municipiului Bucureşti au în structura lor două compartimente distincte:
compartimentul de asistenţă medicală de urgenţă şi transport medical asistat şi
compartimentul de consultaţii de urgenţă şi transport sanitar neasistat.
(2) Compartimentul de asistenţă medicală de urgenţă
are în dotare ambulanţe tip B şi C şi alte mijloace de intervenţie autorizate
în vederea asigurării asistenţei medicale de urgenţă cu sau fără medic.
(3) In cazul în care echipajele de urgenţă sunt fără
medic, acestea vor funcţiona cu un asistent medical ca şef de echipaj.
Echipajele pot include şi personal voluntar special pregătit.
(4) Ambulanţele tip B şi C şi celelalte mijloace de
intervenţie specifice din cadrul compartimentului de asistenţă medicală de
urgenţă nu vor fi utilizate în scop de consultaţii de urgenţă la domiciliu sau
transport sanitar neasistat al pacienţilor stabili, fără probleme medicale
acute.
Art. 107. - (1) Compartimentul de asistenţă medicală de
urgenţă efectuează şi transporturi medicale asistate ale pacienţilor critici şi
ale celor cu accidentări sau îmbolnăviri acute, care necesită supraveghere din
partea unui asistent medical ori medic şi monitorizarea cu echipamentele
medicale specifice.
(2) Compartimentul de asistenţă medicală de urgenţă
funcţionează în regim de aşteptare şi este finanţat din venituri proprii
obţinute din contractele cu casele de asigurări de sănătate sau din alte surse
în condiţiile legii, de la bugetul de stat pe bază de programe, din donaţii şi
sponsorizări.
(3) Compartimentul de asistenţă medicală de urgenţă
poate avea în organigramă personal medical cu studii superioare, personal
medical cu studii medii, ambulanţieri, operatori registratori de urgenţă şi
dispeceri/radiotelefonişti, precum şi alte categorii de personal necesare
funcţionării compartimentului.
Art. 108. - (1) Compartimentul de consultaţii de
urgenţă şi transport sanitar funcţionează ca structură distinctă în cadrul
serviciilor de ambulanţă judeţene şi al municipiului Bucureşti, având în
organigrama sa personal medical cu studii superioare, personal medical cu studii
medii, conducători auto ambulanţieri şi alte categorii de personal necesare
funcţionării acestuia.
(2) In dotarea
compartimentului de consultaţii de urgenţă şi transport sanitar se află
ambulanţe tip A1 şi A2, precum şi alte mijloace de transport autorizate conform
standardelor şi reglementărilor naţionale şi europene, precum şi autoturisme de
transport pentru medicii de gardă în vederea efectuării consultaţiilor la
domiciliu.
(3) In cadrul compartimentului de consultaţii de
urgenţă şi transport pot efectua gărzi şi medici de familie din afara
structurii serviciilor de ambulanţă.
(4) Coordonarea activităţii de consultaţii de urgenţă
se face prin dispeceratul medical de urgenţă, aceasta putând fi realizată, unde
este posibil, în colaborare cu medicii de familie.
(5) Compartimentul de consultaţii de urgenţă şi
transport sanitar neasistat funcţionează în regim de gardă şi/sau ture de cel
mult 12 ore.
Art. 109. - Activitatea de transport sanitar neasistat
va fi efectuată de ambulanţieri şi asistenţi sau doar de ambulanţieri, după
caz.
Art. 110. - (1) Activitatea de
consultaţii de urgenţă la domiciliu şi cea de transport sanitar neasistat sunt
finanţate din venituri proprii obţinute din contractele cu casele de asigurări
de sănătate sau din alte surse în condiţiile legii, din donaţii şi sponsorizări.
(2) Activitatea de consultaţii de urgenţă la
domiciliu şi de transport sanitar neasistat poate fi externalizată parţial sau
total, ea putând fi contractată ori subcontractată de servicii private de
ambulanţă şi de transport sanitar direct cu Casa Naţională de Asigurări de
Sănătate sau sub forma unui subcontract cu serviciile publice de ambulanţă.
(3) Serviciile de reparaţii auto, aprovizionare,
alimentare cu carburanţi, alimentare cu oxigen medicinal, piese auto şi
curăţenie pot fi externalizate prin contract de parteneriat public-privat,
contract de asociere prin participaţiune sau închirieri, sumele rezultate
constituind venituri proprii ale serviciului de ambulanţă contractant.
Art. 111. - (1) Conducerea serviciilor de ambulanţă
judeţene şi al municipiului Bucureşti este formată din:
a) manager general, care poate fi medic, economist sau
jurist cu studii în management;
b) director medical;
c) un comitet director format din managerul general,
directorul medical, directorul economic, directorul tehnic, asistentul-şef, medicii sau asistenţii coordonatori ai
substaţiilor serviciului de ambulanţă, un reprezentant al autorităţii de
sănătate publică judeţene, respectiv a municipiului Bucureşti, şi un
reprezentant al autorităţilor publice locale.
(2) Membrii comitetului
director vor fi numiţi de managerul general, cu excepţia reprezentantului
autorităţii de sănătate publică şi a reprezentantului autorităţilor publice
locale, care vor fi numiţi de conducerile instituţiilor din care fac parte.
(3) Managerul general şi
membrii comitetului director nu pot beneficia de sponsorizări şi/sau finanţări,
direct ori indirect, pentru participare la conferinţe, congrese şi alte tipuri
de manifestări, de către firmele care comercializează produse farmaceutice
şi/sau materiale sanitare ori firmele care reprezintă interesele acestora,
firmele de aparatură medicală, precum şi firmele care comercializează ambulanţe
şi alte vehicule de intervenţie sau reprezentanţii acestora. în situaţii
speciale, bine justificate, se pot obţine excepţii doar cu aprobarea
ministrului sănătăţii publice.
(4) Coordonarea activităţii compartimentului de
urgenţă se realizează la nivel judeţean şi al municipiului Bucureşti de un
medic specialist sau primar în medicină de urgenţă, anestezie-terapie intensivă
ori cu atestat în domeniul asistenţei medicale de urgenţă prespitalicească. La
nivelul substaţiilor, în lipsa unui medic, compartimentul de urgenţă poate fi
coordonat de un asistent medical.
(5) Coordonarea activităţii de consultaţii de urgenţă
la domiciliu se va efectua de către un medic specialist sau medic primar în
medicină de familie, medicină generală, pediatrie ori medicină internă.
(6) Coordonarea activităţii de transport sanitar
neasistat se realizează de către un asistent medical.
(7) Managerul general încheie
cu autoritatea de sănătate publică un contract de management pe o perioadă
maximă de 3 ani. Postul de manager general se va ocupa prin concurs, contractul
putând fi prelungit în urma evaluării activităţii depuse.
(8) Membrii comitetului director vor încheia un
contract de administrare cu managerul general.
(9) Conţinutul contractului de management, precum şi
al contractului de administrare, remunerarea şi indemnizaţiile aferente
managerului general şi membrilor comitetului director vor fi stabilite prin
ordin al ministrului sănătăţii publice.
(10) Funcţia de manager general este incompatibilă
cu:
a) exercitarea unor funcţii în cadrul unei autorităţi
executive, legislative ori judecătoreşti, pe toată durata mandatului, precum şi
cu deţinerea de orice alte funcţii salarizate;
b) deţinerea mai multor funcţii de manager salarizate
sau nesalarizate;
c) deţinerea unei funcţii de conducere salarizate în
cadrul Colegiului Medicilor din România, Colegiului Medicilor Dentişti din
România, Colegiului Farmaciştilor din România, Ordinului Asistenţilor Medicali
şi Moaşelor din România sau al filialelor locale ale acestora ori al
organizaţiilor sindicale de profil.
(11) Constituie conflict de interese deţinerea de
părţi sociale sau de acţiuni de către membrii comitetului director personal ori
de către rudele şi afinii lor până la gradul al IV-lea la societăţi comerciale
sau organizaţii nonguvernamentale care stabilesc relaţii comerciale cu
serviciul de ambulanţă respectiv.
(12) Managerul general şi
membrii comitetului director au obligaţia de a depune o declaraţie de interese,
precum şi de a semna o declaraţie cu privire la incompatibilităţile prevăzute
la alin. (10), în termen de 15 zile de la numirea în funcţie, la Ministerul
Sănătăţii Publice. Aceste declaraţii vor fi actualizate ori de câte ori
intervin schimbări care trebuie înscrise în ele. Actualizarea se face în termen
de 30 de zile de la data începerii modificării sau încetării funcţiilor ori
activităţilor. Declaraţiile se vor afişa pe site-ul serviciului de ambulanţă
respectiv. Modelul declaraţiei de interese şi cel al declaraţiei referitoare la
incompatibilităţi se aprobă prin ordin al ministrului sănătăţii publice.
CAPITOLUL V
Serviciile mobile de urgenţă, reanimare şi descarcerare (SMURD)
Art. 112. - Serviciile mobile de urgenţă, reanimare şi
descarcerare sunt structuri publice integrate de intervenţie, fără
personalitate juridică, care funcţionează în organigrama inspectoratelor pentru
situaţii de urgenţă, respectiv a Unităţii Speciale de Intervenţie în Situaţii
de Urgenţă, având ca operator aerian structurile de aviaţie ale Ministerului
Administraţiei şi Internelor, precum şi, concomitent, după caz, în structura
autorităţilor publice locale şi/sau a unor spitale judeţene şi regionale de
urgenţă.
Art. 113. - (1) Serviciile mobile de urgenţă, reanimare
şi descarcerare au în structura lor, după caz, echipaje de intervenţie
specializate în acordarea primului ajutor calificat, reanimarea, descarcerarea
şi executarea operaţiunilor de salvare, inclusiv salvarea aeriană.
(2) Echipajele integrate de terapie intensivă mobilă
din cadrul Serviciilor mobile de urgenţă, reanimare şi descarcerare sunt
formate din cel puţin 4 persoane, dintre care un conducător auto pompier şi un
medic special pregătit provenit dintr-o structură spitalicească de primire a urgenţelor. Celelalte persoane din
echipajele integrate de terapie intensivă mobilă pot fi asigurate de inspectoratele
pentru situaţii de urgenţă, de autorităţile publice locale şi/sau de
structurile spitaliceşti. In cadrul acestor echipaje pot acţiona şi voluntari
special pregătiţi.
(3) Echipajele de prim ajutor sunt formate din cel
puţin 3 persoane cu pregătire paramedicală din structura inspectoratelor pentru
situaţii de urgenţă, Unitatea Specială de Intervenţie în Situaţii de Urgenţă
şi/sau din structura autorităţilor publice locale. Echipajele pot include şi
personal voluntar special pregătit.
(4) Echipajele de salvare aeriană funcţionează
conform reglementărilor specifice prevăzute de lege.
(5) Echipajele integrate de terapie intensivă mobilă
au în dotare ambulanţe tip C, conform standardelor şi reglementărilor naţionale
şi europene.
(6) Echipajele de prim ajutor calificat au în dotare
ambulanţe tip B, echipate conform standardelor şi reglementărilor naţionale şi
europene, inclusiv cu defibrilatoare semiautomate.
(7) Echipajele de prim ajutor calificat pot acţiona
şi cu autospeciale de intervenţie din dotarea inspectoratelor pentru situaţii
de urgenţă, respectiv ale Unităţii Speciale de Intervenţie în Situaţii de
Urgenţă, fără capacitate de transport pacient, cu condiţia de a fi dotate cu
echipamentele specifice, inclusiv cu defibrilator semiautomat.
Art. 114. - (1) Serviciile mobile de urgenţă, reanimare
şi descarcerare, cu excepţia componentei de salvare aeriană, sunt coordonate
operativ de inspectoratele pentru situaţii de urgenţă, respectiv de Unitatea
Specială de Intervenţie în Situaţii de Urgenţă, având ca medic-şef un medic
specialist sau primar în medicină de urgenţă ori anestezie-terapie intensivă,
provenind dintr-o structură spitalicească de primire a urgenţelor dintr-un
spital regional ori judeţean de urgenţă, după caz.
(2) Personalul din cadrul Serviciilor mobile de
urgenţă, reanimare şi descarcerare îşi desfăşoară activitatea zilnică purtând
uniformele şi gradele profesionale şi/sau ierarhice specifice aprobate prin
ordin al ministrului administraţiei şi internelor. Pentru intervenţie personalul
va purta echipamente de protecţie distincte conform normelor şi reglementărilor
în vigoare.
(3) Coordonarea activităţii zilnice de intervenţie a
echipajelor Serviciilor mobile de urgenţă, reanimare şi descarcerare se face
prin dispeceratele integrate judeţene de urgenţă sau, după caz, prin
dispeceratele medicale ale serviciilor de ambulanţă judeţene şi al municipiului
Bucureşti.
(4) Echipajele de prim ajutor calificat pot fi
dispecerizate direct, după caz, inclusiv de centrele 1-1-2 şi/sau de
dispeceratele inspectoratelor pentru situaţii de urgenţă, pe baza unor
protocoale încheiate în prealabil cu dispeceratele medicale ale serviciilor de
ambulanţă judeţene şi al municipiului Bucureşti.
(5) In situaţia în care un echipaj de prim ajutor este
dispecerizat direct de un centru 1-1-2 sau de un dispecerat al unui inspectorat
pentru situaţii de urgenţă, dispeceratul medical va fi informat în momentul
dispecerizării echipajului de prim ajutor, iar echipajul de prim ajutor va
menţine legătura cu dispeceratul medical în vederea raportării şi coordonării
medicale a activităţii echipajului.
(6) Echipajele de salvare aeriană vor fi alertate
conform prevederilor legale în vigoare, ele putând fi alertate şi direct prin
1-1-2, urmând ca medicul de gardă să decidă oportunitatea intervenţiei pe baza
informaţiilor obţinute de la centrul 1-1-2 şi de la dispeceratele medicale şi
ale inspectoratelor pentru situaţii de urgenţă, de la centrul
operaţional/punctele operaţionale ale Unităţii Speciale de Aviaţie din cadrul
Ministerului Administraţiei şi Internelor sau direct de la locul incidentului.
Art. 115. - (1) Activitatea Serviciilor mobile de
urgenţă, reanimare şi descarcerare este finanţată de la bugetul de stat, prin
bugetul Ministerului Sănătăţii Publice şi al Ministerului Administraţiei şi
Internelor, de la bugetul autorităţilor publice locale, precum şi din alte
surse prevăzute de lege, inclusiv din donaţii şi sponsorizări.
(2) Activitatea cu caracter medical a echipajelor de
terapie intensivă mobilă, de salvare aeriană, precum şi materialele consumabile
pentru acordarea primului ajutor calificat utilizate de personalul paramedical
al inspectoratelor pentru situaţii de urgenţă şi al autorităţilor publice
locale este finanţată din bugetul Fondului naţional unic de asigurări sociale
de sănătate prin spitalele care coordonează medical activitatea la nivel
judeţean şi la nivelul municipiului Bucureşti, precum şi de la bugetul de stat
şi prin alte surse financiare prevăzute în lege.
(3) Medicii-şefi ai Serviciilor mobile de urgenţă,
reanimare şi descarcerare nu pot beneficia de sponsorizări şi/sau finanţări,
direct ori indirect, pentru participare la conferinţe, congrese şi alte tipuri
de manifestări de către firmele care comercializează produse farmaceutice
şi/sau materiale sanitare ori firmele care reprezintă interesele acestora,
firmele de aparatură medicală şi nici de către firmele care comercializează
ambulanţe şi alte vehicule de intervenţie sau reprezentanţii acestora. In
situaţii speciale, bine justificate, se pot obţine excepţii doar cu aprobarea,
după caz, a ministrului sănătăţii publice sau a ministrului administraţiei şi
internelor.
Art. 116. - Dotarea cu echipamente şi mijloace de
intervenţie a Serviciilor mobile de urgenţă, reanimare şi descarcerare va fi
asigurată de Ministerul Sănătăţii Publice, Ministerul Administraţiei şi
Internelor şi de autorităţile publice locale. Achiziţionarea acestora poate fi
realizată inclusiv prin sistem leasing sau credit în condiţiile legii.
CAPITOLUL VI
Asistenţa de urgenţă în caz de accidente colective,
calamităţi şi dezastre în faza prespitalicească
Art. 117. - (1) Asistenţa de urgenţă în cazul
accidentelor colective, calamităţilor şi dezastrelor va fi coordonată de
inspectoratele judeţene pentru situaţii de urgenţă, respectiv al municipiului
Bucureşti, sau direct de Inspectoratul General pentru Situaţii de Urgenţă
conform planurilor naţionale aprobate.
(2) Pentru situaţii de accidente colective,
calamităţi sau dezastre, cu urmări deosebit de grave, se vor întocmi planuri de
acţiune comune şi cu celelalte instituţii cu atribuţii în domeniu, care vor fi
puse în aplicare la solicitarea Inspectoratului General pentru Situaţii de
Urgenţă.
(3) In situaţii de accidente colective, calamităţi
sau dezastre, cu urmări deosebit de grave, acordarea asistenţei la nivel
spitalicesc se va face şi în unităţile spitaliceşti aparţinând ministerelor şi
instituţiilor cu reţea sanitară proprie.
Art. 118. - (1) Serviciile publice de urgenţă
prespitalicească intră cu toate forţele planificate sub comanda unică a
inspectorului-şef pentru situaţii de urgenţă din judeţul respectiv care se
subordonează direct prefectului judeţului şi inspectorului general al
Inspectoratului General pentru Situaţii de Urgenţă.
(2) Inspectorul general pentru situaţii de urgenţă
poate solicita serviciilor de ambulanţă judeţene şi al municipiului Bucureşti,
precum şi celorlalte ministere şi instituţii cu reţea sanitară proprie punerea
la dispoziţie a mijloacelor şi a personalului necesar intervenţiilor în cazul
unor accidente colective, calamităţi sau dezastre, pe durată determinată.
(3) Medicii directori ai
serviciilor de ambulanţă judeţene şi al municipiului Bucureşti au obligaţia
organizării sprijinului solicitat de inspectoratele pentru situaţii de urgenţă.
(4) Medicii directori ai serviciilor de ambulanţă
judeţene şi al municipiului Bucureşti, precum şi medicii-şefi ai unităţilor
Serviciilor mobile de urgenţă, reanimare şi descarcerare fac parte din
comitetele judeţene şi al municipiului Bucureşti pentru situaţii de urgenţă.
Art. 119. - (1) Din momentul direcţionării echipajelor
către un accident colectiv sau o zonă calamitata, încetează toate activităţile
din cadrul serviciilor de ambulanţă judeţene şi al municipiului Bucureşti care
nu au caracter de urgenţă. Echipajele de transport sanitar neasistat şi de
consultaţii de urgenţă vor fi direcţionate către compartimentul de urgenţă.
(2) Directorul serviciului de ambulanţă judeţean,
precum şi cel al municipiului Bucureşti au obligaţia de a dispune realizarea
condiţiilor necesare pentru îndeplinirea tuturor prevederilor planului de
acţiune în caz de necesitate. Pentru rezolvarea cazurilor curente dispeceratul
judeţean sau al municipiului Bucureşti păstrează un număr minim de echipaje de
urgenţă, iar dacă situaţia o impune, se alertează personalul din turele libere.
(3) Serviciile de ambulanţă judeţene şi al
municipiului Bucureşti împreună cu inspectoratele pentru situaţii de urgenţă
întocmesc planul de acţiune în situaţii de urgenţă pe baza listelor cu mijloacele
din dotare, precum şi cu personalul acestora transmise de toate instituţiile cu
atribuţii în domeniu.
(4) Echipajele din cadrul Serviciilor mobile de
urgenţă, reanimare şi descarcerare sunt direcţionate cu prioritate către zona
calamitata sau către accidentul colectiv ca echipaje de prim răspuns împreună
cu echipajele de ambulanţă disponibile.
(5) Inspectorul general al Inspectoratului General
pentru Situaţii de Urgenţă poate dispune echipajelor Serviciilor mobile de
urgenţă, reanimare şi descarcerare dintr-un judeţ participarea la intervenţie
la un accident colectiv sau o zonă calamitata din alt judeţ. La nevoie, el
poate dispune, cu acordul preşedintelui Comitetului pentru Situaţii de Urgenţă
al Ministerului Sănătăţii Publice, participarea la intervenţii, în alt judeţ, a
unor echipaje ale serviciilor publice sau private de ambulanţă dintr-un judeţ
sau din municipiul Bucureşti.
(6) Inspectorii-şefi ai inspectoratelor pentru
situaţii de urgenţă, la nevoie, pot solicita sprijinul serviciilor private de
ambulanţă în condiţiile stabilite prin lege.
(7) In cazul epidemiilor şi/sau pandemiilor,
coordonarea activităţii de intervenţie se face de către comitetele judeţene
pentru situaţii de urgenţă sau de Comitetul pentru Situaţii de Urgenţă al
Ministerului Sănătăţii Publice, după caz, potrivit legii.
Art. 120. - (1) Serviciile private de ambulanţă au obligaţia de a răspunde solicitării comitetelor
judeţene/al municipiului Bucureşti, respectiv Comitetului pentru Situaţii de
Urgenţă al Ministerului Sănătăţii Publice ori Comitetului Naţional pentru
Situaţii de Urgenţă, în caz de accident colectiv, calamităţi naturale sau
dezastre, contravaloarea cheltuielilor rezultate fiind decontată, la tarifele
Casei Naţionale de Asigurări de Sănătate, din bugetul de stat ori din bugetul
local.
(2) Inspectoratele judeţene pentru situaţii de urgenţă
şi cel al municipiului Bucureşti păstrează unităţile mobile de intervenţie la
accidente colective şi dezastre, aflate în dotarea lor, în stare de
funcţionare, prin Serviciile mobile de urgenţă, reanimare şi descarcerare, în
colaborare cu serviciile de ambulanţă judeţene şi al municipiului Bucureşti,
după caz.
(3) Serviciile medicale publice de urgenţă
prespitalicească care răspund de unităţile mobile pentru accidente colective şi
dezastre se asigură că aparatura medicală este în stare de funcţionare şi că
unitatea este dotată cu medicamente şi materiale, aflate în termen de
valabilitate, suficiente pentru îngrijirea unui număr de minimum 20 de persoane
aflate în stare critică.
(4) Managerii generali şi directorii medicali ai
serviciilor de ambulanţă judeţene şi al municipiului Bucureşti, medicii-şefi ai
Serviciilor mobile de urgenţă, reanimare şi descarcerare, precum şi
medicii-şefi ai unităţilor de primire a urgenţelor vor urma cursuri în
managementul dezastrelor organizate de Ministerul Sănătăţii Publice şi/sau de
Ministerul Administraţiei şi Internelor.
Art. 121. - Finanţarea exerciţiilor, a pregătirii şi a
intervenţiilor în caz de accidente colective, calamităţi sau dezastre se face
de la bugetul de stat şi bugetul autorităţilor publice locale.
CAPITOLUL VII
Dispoziţii finale
Art. 122. - Normele de aplicare a prevederilor
prezentului titlu se aprobă prin ordin comun al ministrului sănătăţii publice
şi al ministrului administraţiei şi internelor, în termen de 3 zile de la
intrarea în vigoare a prezentului titlu, şi se publică în Monitorul Oficial al
României, Partea I.
Art. 123. - In scopul apărării dreptului cetăţenilor la
sănătate, securitate şi viaţă, precum şi în scopul prevenirii şi limitării
consecinţelor unei calamităţi naturale sau ale unui dezastru, personalului din
cadrul serviciilor publice de urgenţă spitaliceşti şi prespitaliceşti i se
interzice participarea la greve sau la alte acţiuni revendicative menite să
afecteze activitatea prin scăderea capacităţii de intervenţie sau a calităţii
actului medical, organizate de sindicate sau de alte organizaţii, în timpul
programului de lucru, normal sau prelungit.
Art. 124. - Prevederile art. 87 alin. (8) şi ale art.
92 alin. (3) vor fi implementate gradual, conform normelor de aplicare a
prezentului titlu, luându-se în considerare resursele şi planurile de
dezvoltare astfel încât termenul final să nu depăşească anul 2014.
Art. 125. - Nerespectarea prevederilor prezentului
titlu atrage răspunderea juridică a persoanelor vinovate, în condiţiile legii.
TITLUL V
Asistenta medicală comunitară
CAPITOLUL I
Dispoziţii generale
Art. 126. - (1) Dispoziţiile prezentului titlu
reglementează serviciile şi activităţile din domeniul asistenţei medicale
comunitare.
(2) Asistenţa medicală comunitară cuprinde ansamblul de
activităţi şi servicii de sănătate organizate la nivelul comunităţii pentru
soluţionarea problemelor medico-sociale ale individului, în vederea menţinerii
acestuia în propriul mediu de viaţă şi care se acordă în sistem integrat cu
serviciile sociale.
Art. 127. - (1) Asistenţa
medicală comunitară presupune un ansamblu integrat de programe şi servicii de
sănătate centrate pe nevoile individuale ale omului sănătos şi bolnav, acordate
în sistem integrat cu serviciile sociale.
(2) Programele şi serviciile de asistenţă medicală
comunitară se realizează în concordanţă cu politicile şi strategiile
Ministerului Sănătăţii Publice, Ministerului Muncii, Solidarităţii Sociale şi
Familiei, Autorităţii Naţionale pentru Persoanele cu Handicap, Agenţiei
Naţionale pentru Protecţia Familiei, ale altor instituţii ale autorităţii
locale cu responsabilităţi în domeniu, precum şi cu cele ale autorităţilor locale.
CAPITOLUL II
Organizarea şi funcţionarea asistenţei medicale
comunitare
Art. 128. - (1) Pentru coordonarea programelor naţionale de asistenţă medicală comunitară se înfiinţează
Comisia Interdepartamentală pentru Asistenţă Medicală Comunitară aflată în
subordinea primului-ministru, denumită în continuare Comisia.
(2) Comisia se constituie dintr-un preşedinte şi un
număr impar de membri, reprezentanţi ai Ministerului Sănătăţii Publice,
Ministerului Muncii, Solidarităţii Sociale şi Familiei, Autorităţii Naţionale
pentru Persoanele cu Handicap, Agenţiei Naţionale pentru Protecţia Familiei,
Ministerului Administraţiei şi Internelor, precum şi ai organizaţiilor sau
asociaţiilor autorităţilor locale.
(3) Atribuţiile, regulamentul de organizare şi
funcţionare, precum şi componenţa nominală a Comisiei se stabilesc prin
hotărâre a Guvernului.
Art. 129. - (1) Comisia se întruneşte în şedinţe ordinare de două ori pe an şi în şedinţe
extraordinare ori de câte ori este nevoie.
(2) Comisia primeşte sinteza rapoartelor anuale privind
problemele medico-sociale de la nivelul comunităţilor.
Art. 130. - Comisia are următoarele atribuţii:
a) realizează Strategia naţională în domeniul
asistenţei medicale comunitare;
b) întocmeşte lista de priorităţi care să răspundă nevoilor
identificate la nivelul comunităţilor;
c) propune ordonatorului de credite necesarul de
fonduri pentru desfăşurarea activităţilor din domeniul asistenţei medicale
comunitare.
Art. 131. - Comisia îşi realizează atribuţiile
prevăzute la art. 130 cu suportul Unităţii de Management al Programelor de
Asistenţă Medicală Comunitară.
Art. 132. - (1) Pentru realizarea programelor naţionale de asistenţă medicală comunitară se înfiinţează
Unitatea de Management al Programelor de Asistenţă Medicală Comunitară (UMPAMC)
în cadrul Şcolii Naţionale de Sănătate Publică şi Management Sanitar, denumită
în continuare UMPAMC.
(2) UMPAMC are drept atribuţie
principală sprijinul tehnic şi metodologic pentru Comisia Interdepartamentală
pentru Asistenţă Medicală Comunitară.
Art. 133. - Pentru realizarea atribuţiilor, UMPAMC
poate solicita expertiza şi suportul tehnic al specialiştilor din instituţiile
aflate în subordinea şi/sau în coordonarea Ministerului Sănătăţii Publice,
Ministerului Muncii, Solidarităţii Sociale şi Familiei, Autorităţii Naţionale
pentru Protecţia Drepturilor Copilului, Ministerului Administraţiei şi
Internelor, Ministerului Finanţelor Publice şi a altor organe ale autorităţii
centrale cu responsabilităţi în domeniu.
Art. 134. - Programele naţionale de asistenţă medicală
comunitară se derulează prin instituţiile aflate în subordinea şi/sau în
coordonarea Ministerului Sănătăţii Publice, Ministerului Muncii, Solidarităţii
Sociale şi Familiei, Ministerului Administraţiei şi Internelor şi a
ministerelor şi instituţiilor cu reţea sanitară proprie.
CAPITOLUL III
Beneficiarii, obiectivele şi acordarea serviciilor
şi activităţilor de asistenţa medicală comunitară
Art. 135. - (1) Beneficiarul serviciilor şi
activităţilor de asistenţă medicală comunitară este comunitatea dintr-o arie
geografică definită, precum: judeţul, oraşul, comuna, satul, după caz, iar în
cadrul acesteia în mod deosebit categoriile de persoane
vulnerabile.
(2) Categoriile de persoane vulnerabile sunt persoanele
care se găsesc în următoarele situaţii:
a) nivel economic sub pragul sărăciei;
b) şomaj;
c) nivel educaţional scăzut;
d) diferite dizabilităţi, boli cronice;
e) boli aflate în faze terminale, care necesită
tratamente paleative;
f) graviditate;
g) vârsta a treia;
h) vârstă sub 5 ani;
i) fac parte din familii monoparentale.
Art. 136. - (1) Serviciile şi activităţile de asistenţă
medicală comunitară sunt derulate de următoarele categorii profesionale:
a) asistent social;
b) asistent medical comunitar;
c) mediator sanitar;
d) asistent medical comunitar de psihiatrie;
e) asistent medical de îngrijiri la domiciliu.
(2) Categoriile profesionale prevăzute la alin. (1)
lit. b)-d) se încadrează cu contract individual de muncă pe perioadă
determinată la unităţile sanitare desemnate, iar cheltuielile de personal se
suportă în cadrul programelor naţionale de sănătate.
(3) Categoriile profesionale prevăzute la alin. (1)
colaborează cu autorităţile locale şi cu serviciile de asistenţă medicală şi
socială.
(4) Categoriile profesionale care activează în
domeniul asistenţei medicale comunitare se includ în Clasificarea Ocupaţiilor
din România (C.O.R.).
Art. 137. - Obiectivele
generale ale serviciilor şi activităţilor de asistenţă medicală comunitară
sunt:
a) implicarea comunităţii în identificarea
problemelor medico-sociale ale acesteia;
b) definirea şi caracterizarea problemelor
medico-sociale ale comunităţii;
c) dezvoltarea programelor de intervenţie, privind
asistenţa medicală comunitară, adaptate nevoilor comunităţii;
d) monitorizarea şi evaluarea serviciilor şi
activităţilor de asistenţă medicală comunitară;
e) asigurarea eficacităţii acţiunilor şi a eficienţei
utilizării resurselor.
Art. 138. - Obiectivele generale ale asistenţei
medicale comunitare sunt:
a) educarea comunităţii pentru sănătate;
b) promovarea sănătăţii reproducerii şi a
planificării familiale;
c) promovarea unor atitudini şi comportamente
favorabile unui stil de viaţă sănătos;
d) educaţie şi acţiuni direcţionate pentru asigurarea
unui mediu de viaţă sănătos;
e) activităţi de prevenire şi profilaxie primară,
secundară şi terţiară;
f) activităţi medicale curative, la domiciliu,
complementare asistenţei medicale primare, secundare şi terţiare;
g) activităţi de consiliere medicală şi socială;
h) dezvoltarea serviciilor de îngrijire medicală la
domiciliu a gravidei, nou-născutului şi mamei, a bolnavului cronic, a
bolnavului mintal şi a bătrânului;
i) activităţi de recuperare medicală.
CAPITOLUL IV
Finanţare
Art. 139. - Finanţarea programelor de asistenţă
comunitară se realizează cu fonduri din bugetul de stat, bugetul autorităţilor
locale, precum şi din alte surse, inclusiv din donaţii şi sponsorizări, în
condiţiile legii.
CAPITOLUL V
Dispoziţii finale
Art. 140. - Ministerul Sănătăţii Publice va elabora, în
colaborare cu Ministerul Muncii, Solidarităţii Sociale şi Familiei şi
Ministerul Administraţiei şi Internelor, norme de aplicare a prezentului titlu,
în termen de 30 de zile de la data intrării în vigoare a acestuia.
TITLUL VI
Efectuarea prelevării şi transplantului de organe,
ţesuturi şi celule de origine umană în scop terapeutic
CAPITOLUL I
Dispoziţii generale
Art. 141. - Prelevarea şi
transplantul de organe, ţesuturi şi celule de origine umană se fac în scop
terapeutic, în condiţiile prezentului titlu.
Art. 142. - In înţelesul prezentului titlu, termenii şi
noţiunile folosite au următoarele semnificaţii:
a) celulă - unitatea elementară anatomică şi
funcţională a materiei vii. In sensul prezentei legi, termenul celulă/celule se
referă la celula umană individuală sau la o colecţie de celule umane, care nu
sunt unite prin nici o formă de substanţă intercelulară;
b) ţesut - gruparea de celule diferenţiată,
unite prin substanţă intercelulară amorfă, care formează împreună o asociere
topografică şi funcţională;
c) organ - partea
diferenţiată în structura unui organism, adaptată la o funcţie definită,
alcătuită din mai multe ţesuturi sau tipuri celulare, prezentând vascularizaţie
şi inervaţie proprii;
d) prelevare - recoltarea
de organe şi/sau ţesuturi şi/sau celule de origine umană sănătoase morfologic
şi funcţional, cu excepţia autotransplantului de celule stern hematopoietice
când celulele sunt recoltate de la pacient, în vederea realizării unui
transplant;
e) transplant - acea
activitate medicală prin care, în scop terapeutic, în organismul unui pacient
este implantat sau grefat un organ, ţesut ori celulă. Reglementările cuprinse
în prezenta lege se adresează inclusiv tehnicilor de fertilizare in vitro;
f) donator - subiectul
în viaţă sau decedat, de la care se prelevează organe, ţesuturi şi/sau celule
de origine umană pentru utilizare terapeutică;
g) primitor - subiectul
care beneficiază de transplant de organe şi/sau ţesuturi şi/sau celule.
Art. 143. - Coordonarea, supravegherea, aprobarea şi
implementarea oricăror dispoziţii privind activitatea de transplant revin
Agenţiei Naţionale de Transplant.
CAPITOLUL II
Donarea şi donatorul de organe, ţesuturi şi celule
de origine umană
Art. 144. - Prelevarea de organe, ţesuturi şi celule de
origine umană de la donatorul în viaţă se face în următoarele condiţii:
a) prelevarea de organe, ţesuturi şi celule de
origine umană, în scop terapeutic, se poate efectua de la persoane majore în
viaţă, având capacitate de exerciţiu deplină, după obţinerea consimţământului
informat, scris, liber, prealabil şi expres al acestora, conform modelului
prevăzut în anexa nr. 1. Se interzice prelevarea de organe, ţesuturi şi celule
de la persoane fără capacitate de exerciţiu;
b) consimţământul se semnează numai după ce donatorul
a fost informat de medic, asistentul social sau alte persoane cu pregătire de
specialitate asupra eventualelor riscuri şi consecinţe pe plan fizic, psihic,
familial şi profesional, rezultate din actul prelevării;
c) donatorul poate reveni asupra consimţământului dat,
până în momentul prelevării;
d) prelevarea şi transplantul de organe, ţesuturi şi
celule de origine umană ca urmare a exercitării unei constrângeri de natură
fizică sau morală asupra unei persoane sunt interzise;
e) donarea şi transplantul de organe, ţesuturi şi
celule de origine umană nu pot face obiectul unor acte şi fapte juridice, în
scopul obţinerii unui folos material sau de altă natură.
f) donatorul şi primitorul vor semna un act legalizat
prin care declară că donarea se face în scop umanitar, are caracter altruist şi
nu constituie obiectul unor acte şi fapte juridice în scopul obţinerii unui
folos material sau de altă natură, conform modelului prevăzut în anexa nr. 1.
Art. 145. - (1) Se interzice prelevarea de organe,
ţesuturi şi celule de la potenţiali donatori minori în viaţă, cu excepţia
cazurilor prevăzute în prezenta lege.
(2) Prin derogare de la alin.
(1), în cazul în care donatorul este minor, prelevarea de celule stern
hematopoietice medulare sau periferice se face în următoarele condiţii:
a) prelevarea de celule stern hematopoietice medulare
sau periferice de la minori se poate face numai cu
consimţământul minorului dacă acesta a împlinit vârsta de 14 ani şi cu acordul
scris al ocrotitorului legal, respectiv al părinţilor, tutorelui sau al
curatorului. Dacă minorul nu a împlinit vârsta de 14 ani, prelevarea se poate
face cu acordul ocrotitorului legal;
b) în cazul donatorului care are cel puţin 14 ani,
consimţământul acestuia, scris sau verbal, se exprimă în faţa preşedintelui
tribunalului în a cărui circumscripţie teritorială se află sediul centrului
unde se efectuează transplantul, după efectuarea obligatorie a unei anchete de
către autoritatea tutelară competentă, conform modelului prevăzut în anexa nr.
2.
(3) Refuzul scris sau verbal al minorului împiedică
orice prelevare.
Art. 146. - (1) Prelevarea de organe, ţesuturi sau
celule de la donatorul viu se va efectua cu avizul comisiei de avizare a
donării de la donatorul viu, constituită în cadrul spitalului în care se
efectuează transplantul; această comisie va evalua motivaţia donării şi va
controla respectarea drepturilor pacienţilor, conform modelului prevăzut în
anexa nr. 1.
(2) Comisia de avizare a donării de la donatorul viu
va avea următoarea componenţă: un medic cu pregătire în bioetică din partea
colegiului medicilor judeţean sau al municipiului Bucureşti, un psiholog sau un
medic psihiatru şi un medic primar, angajat al spitalului şi având atribuţii de
conducere în cadrul acestuia, neimplicat în echipa de transplant.
(3) Această comisie va funcţiona conform unui
regulament emis de Agenţia Naţională de Transplant, cu consultarea Comisiei de
bioetică a Ministerului Sănătăţii
Publice. Regulamentul va fi aprobat prin ordin al
ministrului sănătăţii publice.
(4) Comisia va evalua atât donatorul, cât şi
primitorul care vor fi supuşi unui examen psihologic şi/sau psihiatric, având
ca scop testarea capacităţii de exerciţiu, precum şi stabilirea motivaţiei
donării.
(5) Examenul psihologic/psihiatric va fi efectuat de
un specialist, psiholog sau psihiatru, independent atât de echipa care
efectuează transplantul, cât şi de familiile donatorului şi primitorului.
(6) Prelevarea, de la donatori vii, de sânge, piele,
spermă, cap femural, placentă, sânge din cordonul ombilical, membrane
amniotice, ce vor fi utilizate în scop terapeutic, se face cu respectarea
regulilor de bioetică cuprinse în regulamentul comisiei de avizare a donării de
la donatorul viu, fără a fi necesar avizul acestei comisii.
(7) Datele privind donatorul şi receptorul, inclusiv
informaţiile genetice, la care pot avea acces terţe părţi, vor fi comunicate
sub anonimat, astfel încât nici donatorul, nici receptorul să nu poată fi
identificaţi.
(8) Dacă donatorul nu doreşte să-şi divulge
identitatea, se va respecta confidenţialitatea donării, cu excepţia cazurilor
în care declararea identităţii este obligatorie prin
lege.
Art. 147. - Prelevarea de organe, ţesuturi şi celule de
la donatorul decedat se face în următoarele condiţii:
1. se defineşte ca donator decedat fără activitate
cardiacă persoana la care s-a constatat oprirea cardiorespiratorie
iresuscitabilă şi ireversibilă, confirmată în spital de 2 medici primari.
Confirmarea donatorului decedat fără activitate cardiacă se face conform
protocolului de resuscitare, prevăzut în anexa nr. 6, excepţie făcând
situaţiile fără echivoc;
2. se defineşte ca donator
decedat cu activitate cardiacă persoana la care s-a constatat încetarea ireversibilă a tuturor
funcţiilor creierului, conform protocolului de declarare a morţii cerebrale
prevăzut în anexa nr. 3;
3. declararea morţii cerebrale se face de către
medici care nu fac parte din echipele de coordonare, prelevare, transplant de
organe, ţesuturi şi celule de origine umană;
4. prelevarea de organe, ţesuturi şi/sau celule de la
persoanele decedate se face numai cu consimţământul scris a cel puţin unu
dintre membrii majori ai familiei sau al rudelor, în următoarea ordine: soţ,
părinte, copil, frate, soră. In absenţa acestora, consimţământul va fi luat de
la persoana autorizată, în mod legal, conform legislaţiei în domeniu, să îl
reprezinte pe defunct; în ambele situaţii se procedează conform modelului
prevăzut în anexa nr. 4;
5. prelevarea se poate face fără consimţământul
membrilor familiei dacă, în timpul vieţii, persoana decedată şi-a exprimat deja
opţiunea în favoarea donării, printr-un act notarial de consimţământ pentru
prelevare sau înscrierea în Registrul naţional al donatorilor de organe, ţesuturi
şi celule, conform modelului prevăzut în anexa nr. 5;
6. prelevarea nu se poate face sub nici o formă dacă,
în timpul vieţii, persoana decedată şi-a exprimat deja opţiunea împotriva
donării, prin act de refuz al donării avizat de medicul de familie sau prin
înscrierea în Registrul naţional al celor care refuză să doneze organe,
ţesuturi şi celule. Actul de refuz al donării, avizat de medicul de familie, va
fi prezentat de către aparţinători coordonatorului de transplant.
Art 148. - (1) Prelevarea de organe, ţesuturi şi celule
de la donatori decedaţi se efectuează numai după un control clinic şi de
laborator care să excludă orice boală infecţioasă, o posibilă contaminare sau
alte afecţiuni care reprezintă un risc pentru primitor, conform protocoalelor
stabilite pentru fiecare organ, ţesut sau celulă în parte.
(2) Repartiţia organelor, ţesuturilor şi celulelor de
origine umană prelevate la nivel naţional se efectuează de către Agenţia
Naţională de Transplant, în funcţie de regulile stabilite de aceasta privind
alocarea organelor, ţesuturilor şi celulelor de origine umană în cadrul
sistemului de transplant din România.
(3) In condiţiile în care pe teritoriul naţional nu
există nici un primitor compatibil cu organele, ţesuturile şi celulele de
origine umană disponibile, acestea pot fi alocate în reţeaua internaţională de
transplant, pe baza unei autorizaţii speciale emise de Agenţia Naţională de
Transplant, conform modelului prevăzut în anexa nr. 7
(4) Ţesuturile şi celulele de origine umană prelevate
pot fi utilizate imediat pentru transplant sau pot fi procesate şi depozitate
în băncile de ţesuturi şi celule, acreditate sau agreate de Agenţia Naţională
de Transplant.
(5) Transplantul de ţesuturi
sau celule de origine umană se efectuează numai din băncile acreditate sau
agreate de Agenţia Naţională de Transplant.
(6) Fiecare prelevare de organ, ţesut sau celulă de
origine umană este anunţată imediat şi înregistrată în Registrul naţional de
transplant, conform procedurilor stabilite de Agenţia Naţională de Transplant.
(7) Medicii care au efectuat prelevarea de organe şi
ţesuturi de la o persoană decedată vor asigura restaurarea cadavrului şi a
fizionomiei sale prin îngrijiri şi mijloace specifice, inclusiv chirurgicale
dacă este necesar, în scopul obţinerii unei înfăţişări demne a corpului
defunctului.
(8) Prelevarea de organe, ţesuturi şi celule de
origine umană, în cazuri medico-legale, se face numai cu consimţământul
medicului legist şi nu trebuie să compromită rezultatul autopsiei
medico-legale, conform modelului prevăzut în anexa nr. 8.
(9) Introducerea sau scoaterea din ţară de organe,
ţesuturi, celule de origine umană se face numai pe baza autorizaţiei speciale
emise de Agenţia Naţională de Transplant, după modelul prevăzut în anexa nr. 7,
respectiv anexa nr. 9, conform legislaţiei vamale.
(10) Se interzice divulgarea oricărei informaţii
privind identitatea donatorului cadavru, precum şi a primitorului, exceptând
cazurile în care familia donatorului, respectiv primitorul sunt de acord, precum
şi cazurile în care declararea identităţii este obligatorie prin lege. Datele
privind donatorul şi receptorul, inclusiv informaţiile genetice, la care pot
avea acces terţe părţi, vor fi comunicate sub anonimat, astfel încât nici
donatorul, nici receptorul să nu poată fi identificaţi.
(11) Agenţia Naţională de Transplant poate acorda
servicii funerare şi/sau transportul cadavrului, în cazul donatorilor de la
care s-au prelevat organe şi/sau ţesuturi şi/sau celule.
(12) După fiecare prelevare de organe, ţesuturi
şi/sau celule de la donatorii cadavru se vor completa, cu datele din momentul
prelevării, Fişa de declarare a donatorului şi Fişa de prelevare de organe şi
ţesuturi, prevăzute în anexa nr. 10.
(13) Agenţia Naţională de Transplant stabileşte un sistem
de vigilenţă pentru raportarea, investigarea, înregistrarea şi transmiterea
informaţiilor despre incidentele grave şi reacţiile adverse severe care pot
influenţa calitatea şi siguranţa organelor, ţesuturilor şi celulelor, ce pot fi
datorate procurării, testării, procesării, stocării şi distribuţiei acestora,
astfel încât orice reacţie adversă severă observată în timpul sau după
procedura de transplant ar putea fi legată de calitatea şi siguranţa organelor,
ţesuturilor şi celulelor.
CAPITOLUL III
Transplantul de organe, ţesuturi şi celule de
origine umană
Art. 149. - Transplantul de organe, ţesuturi şi celule
de origine umană se efectuează numai în scop terapeutic.
Art. 150. - Transplantul de
organe, ţesuturi şi celule de origine umană se efectuează cu consimţământul
scris al primitorului, după ce acesta a fost informat asupra riscurilor şi
beneficiilor procedeului, conform modelului prevăzut în anexa nr. 11.
Art. 151. - (1) In cazul în
care primitorul este în imposibilitatea de a-şi exprima consimţământul, acesta
poate fi dat în scris de către unul din membrii familiei sau de către
reprezentantul legal al acestuia, conform modelului prevăzut în anexa nr. 11.
(2) In cazul primitorului
aflat în imposibilitatea de a-şi exprima consimţământul, transplantul se poate
efectua fără consimţământul prevăzut anterior dacă, datorită unor împrejurări
obiective, nu se poate lua legătura în timp util cu familia ori cu
reprezentantul legal al acestuia, iar întârzierea ar
conduce inevitabil la decesul pacientului.
(3) Situaţia descrisă la alin. (2) va fi consemnată
de medicul şef de secţie şi de medicul curant al pacientului, în formularul
prevăzut în anexa nr. 12.
Art. 152. - In cazul minorilor
sau persoanelor lipsite de capacitate de exerciţiu, consimţământul va fi dat de
părinţi sau de celelalte persoane care au calitatea de ocrotitor legal al
acestora, după caz, conform modelului prevăzut în anexa nr. 13.
CAPITOLUL IV
Finanţarea activităţii de transplant
Art. 153. - Costul investigaţiilor, spitalizării,
intervenţiilor chirurgicale, medicamentelor, materialelor sanitare, al
îngrijirilor postoperatorii, precum şi cheltuielile legate de coordonarea de
transplant se pot deconta după cum urmează:
a) din bugetul Fondului naţional unic de asigurări
sociale de sănătate, pentru pacienţii incluşi în Programul naţional de
transplant;
b) de la bugetul de stat, pentru pacienţii incluşi în
Programul naţional de transplant;
c) prin contribuţia personală a pacientului sau,
pentru el, a unui sistem de asigurări voluntare de sănătate;
d) donaţii şi sponsorizări de la persoane fizice sau
juridice, organizaţii neguvernamentale ori alte organisme interesate.
CAPITOLUL V
Sancţiuni
Art. 154. - Organizarea şi
efectuarea prelevării de organe, ţesuturi şi/sau celule de origine umană, în
scopul transplantului, în alte condiţii decât cele prevăzute de prezentul
titlu, constituie infracţiune şi se pedepseşte conform legii penale.
Art. 155. - Prelevarea sau
transplanul de organe şi/sau ţesuturi şi/sau celule de origine umană fără
consimţământ dat în condiţiile prezentului titlu constituie infracţiune şi se
pedepseşte cu închisoare de la 5 la 7 ani.
Art. 156. - Fapta persoanei care a dispus sau a efectuat
prelevarea atunci când prin aceasta se compromite o autopsie
medico-legală, solicitată în condiţiile legii, constituie infracţiune şi se
pedepseşte cu închisoare de la 1 la 3 ani.
Art. 157. - (1) Constituie infracţiune şi se pedepseşte
cu închisoare de la 3 la 5 ani fapta persoanei de a
dona organe şi/sau ţesuturi şi/sau celule de origine
umană, în scopul obţinerii de foloase materiale sau de altă natură, pentru sine
sau pentru altul.
(2) Determinarea cu rea-credinţă sau constrângerea
unei persoane să doneze organe şi/sau ţesuturi şi/sau celule de origine umană
constituie infracţiune şi se pedepseşte cu închisoare de la 3 la 10 ani.
(3) Publicitatea în folosul unei persoane, în scopul
obţinerii de organe şi/sau ţesuturi şi/sau celule de origine umană, precum şi
publicarea sau mediatizarea unor anunţuri privind donarea de organe şi/sau
ţesuturi şi/sau celule umane în scopul obţinerii unor avantaje materiale sau de
altă natură pentru sine, familie ori terţe persoane fizice sau juridice
constituie infracţiune şi se pedepseşte cu închisoare de la 2 la 7 ani.
Art. 158. - (1) Organizarea şi/sau efectuarea
prelevării de organe şi/sau ţesuturi şi/sau celule de origine umană pentru
transplant, în scopul obţinerii unui profit material pentru donator sau
organizator, constituie infracţiunea de trafic de organe şi/sau ţesuturi şi/sau
celule de origine umană şi se pedepseşte cu închisoare de la 3 la 10 ani.
(2) Cu aceeaşi pedeapsă se sancţionează şi
cumpărarea de organe, ţesuturi şi/sau celule de origine umană, în scopul
revânzării, în vederea obţinerii unui profit.
(3) Tentativa se pedepseşte.
Art. 159. - Introducerea sau scoaterea din ţară de
organe, ţesuturi, celule de origine umană fără autorizaţia specială emisă de
Agenţia Naţională de Transplant constituie infracţiune şi se pedepseşte cu
închisoare de la 3 la 10 ani.
CAPITOLUL VI
Dispoziţii tranzitorii şi finale
Art. 160. - (1) Prelevarea şi transplantul de organe,
ţesuturi şi celule de origine umană se efectuează de către medici de
specialitate, în unităţi sanitare publice sau private autorizate de Ministerul
Sănătăţii Publice şi acreditate, la propunerea Agenţiei Naţionale de
Transplant.
(2) Condiţiile de acreditare a unităţilor sanitare
prevăzute la alin. (1) sunt stabilite de Agenţia Naţională de Transplant, iar
acreditarea se face prin ordin al ministrului sănătăţii publice. Criteriile de
acreditare vor fi stabilite prin normele metodologice de aplicare a prezentului
titlu, în conformitate cu legislaţia europeană în domeniu.
(3) Agenţia Naţională de Transplant poate suspenda sau
revoca acreditarea în cazul în care inspecţiile efectuate împreună cu
autoritatea naţională competentă în domeniul securităţii sanitare a produselor
de origine umană pentru utilizare terapeutică constată că unitatea sanitară
respectivă nu respectă prevederile legale în vigoare. Inspecţiile vor fi
efectuate periodic, iar intervalul dintre două inspecţii nu trebuie să
depăşească 2 ani.
(4) Unităţile sanitare acreditate vor stabili un
sistem de identificare a fiecărui act de donare, prin intermediul unui cod
unic, precum şi fiecărui produs asociat cu el. Pentru ţesuturi şi celule este
necesară etichetarea codificată care să permită stabilirea unei legături de la
donator la primitor şi invers. Informaţiile vor fi păstrate cel puţin 30 de ani.
(5) Unităţile sanitare acreditate pentru activitatea
de procesare şi/sau utilizare de ţesuturi şi/sau celule vor păstra o
înregistrare a activităţii lor, incluzând tipurile şi cantităţile de ţesuturi
şi/sau celule procurate, testate, conservate, depozitate, distribuite sau
casate, precum şi originea şi destinaţia acestor ţesuturi şi/sau celule pentru
utilizare umană. Ele vor trimite anual un raport de activitate Agenţiei
Naţionale de Transplant.
Art. 161. - Unităţile sanitare acreditate pentru
activitatea de transplant tisular şi/sau celular vor trebui să desemneze o
persoană responsabilă pentru asigurarea calităţii ţesuturilor şi/sau celulelor
procesate şi/sau utilizate în conformitate cu legislaţia europeană şi cea
română în domeniu. Standardul de instruire profesională a acestei persoane va
fi stabilit prin norme.
Art. 162. - Normele metodologice de aplicare a
prezentului titlu vor fi elaborate în termen de 90 de zile de la publicarea
legii şi vor fi aprobate prin ordin al ministrului sănătăţii publice.
Art. 163. - Anexele nr. 1-13 fac parte integrantă din
prezenta lege.
Art. 164. - La data intrării în vigoare a prezentului
titlu, Legea nr. 2/1998 privind prelevarea şi transplantul de ţesuturi şi
organe umane, publicată în Monitorul Oficial al României,
Partea I, nr. 8 din 13 ianuarie 1998, cu modificările
ulterioare, şi art. 17 alin. (3), art. 21, 23 şi 25 din Legea nr. 104/2003
privind manipularea cadavrelor umane şi prelevarea organelor şi ţesuturilor de
la cadavre în vederea transplantului, publicată în Monitorul Oficial al
României, Partea I, nr. 222 din
3 aprilie 2003, cu modificările şi completările ulterioare, se abrogă.
Prevederile prezentului titlu transpun Directiva
23/2004/CE a Parlamentului European şi a Consiliului din 31 martie 2004 asupra
stabilirii standardelor de calitate şi siguranţă asupra donării, procurării,
testării, procesării, conservării, depozitării şi distribuirii ţesuturilor şi
celulelor umane.
TITLUL VII
Spitalele
CAPITOLUL I
Dispoziţii generale
Art. 165. - (1) Spitalul este
unitatea sanitară cu paturi, de utilitate publică, cu personalitate juridică,
ce furnizează servicii medicale.
(2) Spitalul poate fi public, public cu secţii
private sau privat. Spitalele de urgenţă se înfiinţează şi funcţionează numai
ca spitale publice.
(3) Secţiile private ale spitalelor publice sau
spitalele private pot furniza servicii medicale cu plată.
(4) Serviciile medicale acordate de spital pot fi
preventive, curative, de recuperare şi/sau paleative.
(5) Spitalele participă la asigurarea stării de
sănătate a populaţiei.
(6) Competenţele pe tipuri de spitale se stabilesc în
conformitate cu criteriile Comisiei Naţionale de Acreditare a Spitalelor şi se
aprobă prin ordin al ministrului sănătăţii publice, iar pentru spitalele din
subordinea ministerelor şi instituţiilor cu reţea sanitară proprie şi cu avizul
ministrului de resort sau al conducătorului instituţiei.
Art. 166. - (1) Activităţile organizatorice şi
funcţionale cu caracter medico-sanitar din spitale sunt reglementate şi supuse
controlului Ministerului Sănătăţii Publice, iar în spitalele din subordinea
ministerelor şi instituţiilor cu reţea sanitară proprie, controlul este
efectuat de structurile specializate ale acestora.
(2) Spitalul poate furniza servicii medicale numai dacă funcţionează în condiţiile autorizaţiei de funcţionare, în caz
contrar, activitatea spitalelor se suspendă, potrivit normelor aprobate prin
ordin al ministrului sănătăţii publice.
Art. 167. - (1) In spital se pot desfăşura şi
activităţi de învăţământ medico-farmaceutic, postliceal, universitar şi
postuniversitar, precum şi activităţi de cercetare ştiinţifică medicală. Aceste
activităţi se desfăşoară sub îndrumarea personalului didactic care este integrat în spital. Activităţile de
învăţământ şi cercetare vor fi astfel organizate încât să consolideze calitatea
actului medical, cu respectarea drepturilor pacienţilor, a eticii şi
deontologiei medicale.
(2) Colaborarea dintre spitale şi instituţiile de
învăţământ superior medical, respectiv unităţile de învăţământ medical, se
desfăşoară pe bază de contract, încheiat conform metodologiei aprobate prin
ordin comun al ministrului sănătăţii publice şi al ministrului educaţiei şi
cercetării.
(3) Cercetarea ştiinţifică medicală se efectuează pe
bază de contract de cercetare, încheiat între spital şi finanţatorul cercetării.
(4) Spitalele au obligaţia să desfăşoare activitatea
de educaţie medicală şi cercetare (EMC) pentru medici, asistenţi medicali şi
alt personal. Costurile acestor activităţi sunt suportate de personalul
beneficiar. Spitalul clinic poate suporta astfel de costuri, în condiţiile
alocărilor bugetare.
Art. 168. - (1) Spitalul asigură condiţii de
investigaţii medicale, tratament, cazare, igienă, alimentaţie şi de prevenire a
infecţiilor nozocomiale, conform normelor aprobate prin ordin al ministrului
sănătăţii publice.
(2) Spitalul răspunde, în condiţiile legii, pentru
calitatea actului medical, pentru respectarea condiţiilor de cazare, igienă,
alimentaţie şi de prevenire a infecţiilor nozocomiale, precum şi pentru
acoperirea prejudiciilor cauzate pacienţilor.
Art. 169. - (1) Ministerul Sănătăţii Publice
reglementează şi aplică măsuri de creştere a eficienţei şi calităţii
serviciilor medicale şi de asigurare a accesului echitabil al populaţiei la serviciile medicale.
(2) Pentru asigurarea dreptului la ocrotirea sănătăţii,
Ministerul Sănătăţii Publice propune, o dată la 3 ani, Planul naţional de
paturi, care se aprobă prin hotărâre a Guvernului.
Art. 170. - (1) Orice spital are obligaţia de a acorda
primul ajutor şi asistenţă medicală de urgenţă oricărei persoane care se
prezintă la spital, dacă starea sănătăţii persoanei este critică. După
stabilizarea funcţiilor vitale, spitalul va asigura, după caz, transportul
obligatoriu medicalizat la o altă unitate medico-sanitară de profil.
(2) Spitalul va fi în permanenţă pregătit pentru
asigurarea asistenţei medicale în caz de război, dezastre, atacuri teroriste,
conflicte sociale şi alte situaţii de criză şi este obligat să participe cu
toate resursele la înlăturarea efectelor acestora.
(3) Cheltuielile efectuate de unităţile spitaliceşti,
în cazurile menţionate la alin. (2), se rambursează de la bugetul de stat, prin
bugetele ministerelor sau instituţiilor în reţeaua cărora funcţionează, prin
hotărâre a Guvernului, în termen de maximum 30 de zile de la data încetării
cauzei care Ie-a generat.
CAPITOLUL II
Organizarea şi funcţionarea spitalelor
Art. 171. - (1) Spitalele se organizează şi
funcţionează, pe criteriul teritorial, în spitale regionale, spitale judeţene
şi spitale locale (municipale, orăşeneşti sau comunale).
(2) Spitalele se organizează şi funcţionează, în
funcţie de specificul patologiei, în spitale generale, spitale de urgenţă,
spitale de specialitate şi spitale pentru bolnavi cu afecţiuni cronice.
(3) Spitalele se organizează şi funcţionează, în
funcţie de regimul proprietăţii, în:
a) spitale publice, organizate ca instituţii publice;
b) spitale private, organizate ca persoane juridice de
drept privat;
c) spitale publice în care funcţionează şi secţii
private.
(4) Din punct de vedere al învăţământului şi al
cercetării ştiinţifice medicale, spitalele pot fi:
a) spitale clinice cu secţii universitare;
b) institute.
Art. 172. - (1) In înţelesul prezentului titlu,
termenii şi noţiunile folosite au următoarele semnificaţii:
a) spitalul regional - spitalul
clinic judeţean care deţine competenţele şi resursele umane şi materiale
suplimentare necesare, în vederea asigurării îngrijirilor medicale complete
pentru cazurile medicale complexe, mai ales în cazul urgenţelor şi al
pacienţilor aflaţi în stare critică, pentru cazurile ce nu pot fi rezolvate la
nivel local, în spitalele municipale şi orăşeneşti, la nivelul judeţului
respectiv, precum şi pentru toate cazurile din judeţele arondate, ce nu pot fi
rezolvate complet la nivelul spitalelor judeţene, din cauza lipsei de resurse
materiale şi/sau umane sau din cauza complexităţii cazului, în conformitate cu
protocoalele în vigoare;
b) spitalul judeţean - spitalul general organizat în reşedinţa de judeţ, cu o structură
complexă de specialităţi medico-chirurgicale, cu unitate de primire urgenţe,
care asigură urgenţele medico-chirurgicale şi acordă asistenţă medicală de
specialitate, inclusiv pentru cazurile grave din judeţ care nu pot fi rezolvate la nivelul spitalelor locale;
c) spitalul local - spitalul
general care acordă asistenţă medicală de specialitate în teritoriul unde
funcţionează, respectiv municipiu, oraş, comună;
d) spitalul de urgenţă - spitalul care dispune de o structură complexă de specialităţi,
dotare cu aparatură medicală corespunzătoare, personal specializat, având
amplasament şi accesibilitate pentru teritorii extinse. In structura spitalului
de urgenţă funcţionează obligatoriu o structură de urgenţă (U.P.U., C.P.U.)
care, în funcţie de necesităţi, poate avea şi un serviciu mobil de urgenţă -
reanimare şi transport medicalizat;
e) spitalul general - spitalul
care are organizate în structură, de regulă, două dintre specialităţile de
bază, respectiv medicină internă, pediatrie, obstetrică-ginecologie, chirurgie
generală;
f) spitalul de specialitate - spitalul care asigură asistenţă medicală într-o specialitate în
conexiune cu alte specialităţi complementare;
g) spitalul pentru bolnavi
cu afecţiuni cronice - spitalul în care durata de spitalizare este prelungită datorită specificului
patologiei. Bolnavii cu afecţiuni cronice şi probleme sociale vor fi preluaţi
de unităţile de asistenţă medico-sociale, precum şi de aşezamintele de
asistenţă socială prevăzute de lege, după evaluarea medicală;
h) spitalul clinic - spitalul
care are în componenţă secţii clinice universitare care asigură asistenţă
medicală, desfăşoară activitate de învăţământ, cercetare ştiinţifică-medicală
şi de educaţie continuă, având relaţii contractuale cu o instituţie de
învăţământ medical superior acreditată. Institutele, centrele medicale şi
spitalele de specialitate, care au în componenţă o secţie clinică universitară
sunt spitale clinice. Pentru activitatea medicală, diagnostică şi terapeutică,
personalul didactic este în subordinea administraţiei spitalului, în
conformitate cu prevederile contractului de muncă;
i) secţiile clinice
universitare - secţiile de spital în care se
desfăşoară activităţi de asistenţă medicală, învăţământ medical, cercetare
ştiinţifică-medicală şi de educaţie medicală continuă (EMC). In aceste secţii
este încadrat cel puţin un cadru didactic universitar, prin integrare clinică.
Pentru activitatea medicală, diagnostică şi terapeutică, personalul didactic
este în subordinea administraţiei spitalului, în conformitate cu prevederile contractului
de muncă;
j) institutele şi centrele
medicale clinice - unităţi de asistenţă medicală
de specialitate în care se desfăşoară şi activitate de învăţământ şi cercetare
ştiinţifică-medicală, de îndrumare şi coordonare metodologică pe domeniile lor
de activitate, precum şi de educaţie medicală continuă; pentru asistenţa
medicală de specialitate se pot organiza centre medicale în care nu se
desfăşoară activitate de învăţământ medical şi cercetare ştiinţifică;
k) unităţile de asistenţă
medico-sociale - instituţii publice specializate,
în subordinea autorităţilor administraţiei publice locale, care acordă servicii
de îngrijire, servicii medicale, precum şi servicii sociale persoanelor cu
nevoi medico-sociale;
l) sanatoriul - unitatea
sanitară cu paturi care asigură asistenţă medicală utilizând factori curativi
naturali asociaţi cu celelalte procedee, tehnici şi mijloace terapeutice;
m) preventoriul - unitatea
sanitară cu paturi care asigură prevenirea şi combaterea tuberculozei la copii
şi tineri, precum şi la bolnavii de tuberculoză stabilizaţi clinic şi
necontagioşi;
n) centrele de sănătate - unităţi sanitare cu paturi care asigură asistenţă medicală de
specialitate pentru populaţia din mai multe localităţi apropiate, în cel puţin
două specialităţi.
(2) In sensul prezentului titlu, în categoria
spitalelor se includ şi următoarele unităţi sanitare cu paturi: institute şi
centre medicale, sanatorii, preventorii, centre de sănătate şi unităţi de
asistenţă medico-socială.
Art. 173. - (1) Structura organizatorică a unui spital
poate cuprinde, după caz: secţii, laboratoare, servicii de diagnostic şi
tratament, compartimente, servicii sau birouri tehnice, economice şi
administrative, serviciu de asistenţă prespitalicească şi transport urgenţe,
structuri de primiri urgenţe şi alte structuri aprobate prin ordin al
ministrului sănătăţii publice.
(2) Spitalele pot avea în componenţa lor structuri care
acordă servicii ambulatorii de specialitate, servicii de spitalizare de zi,
îngrijiri la domiciliu, servicii paraclinice ambulatorii. Furnizarea acestor
servicii se negociază şi se contractează în mod distinct cu casele de asigurări
de sănătate sau cu terţi în cadrul asistenţei medicale spitaliceşti sau din
fondurile alocate pentru serviciile respective.
Art. 174. - (1) Spitalele publice se înfiinţează şi,
respectiv, se desfiinţează prin hotărâre a Guvernului, iniţiată de Ministerul
Sănătăţii Publice, cu avizul consiliului local, respectiv judeţean, după caz.
(2) Spitalele din reţeaua
sanitară proprie a ministerelor şi instituţiilor, altele decât cele ale
Ministerului Sănătăţii Publice, se înfiinţează şi, respectiv, se desfiinţează
prin hotărâre a Guvernului, iniţiată de ministerul sau instituţia publică
respectivă, cu avizul Ministerului Sănătăţii Publice.
(3) Structura organizatorică, reorganizarea,
restructurarea, schimbarea sediului şi a denumirilor pentru spitalele publice
se aprobă prin ordin al ministrului sănătăţii publice, la propunerea conducerii
spitalelor, prin autorităţile de sănătate publică, cu avizul consiliului
judeţean sau al consiliului local, după caz. Structura organizatorică a
unităţilor sanitare din subordinea ministerelor şi instituţiilor cu reţea
sanitară proprie se stabileşte prin ordin al ministrului, respectiv prin
decizie a conducătorului instituţiei, cu avizul Ministerului Sănătăţii Publice.
(4) Spitalele private se înfiinţează sau se
desfiinţează cu avizul Ministerului Sănătăţii Publice, în condiţiile legii.
Structura organizatorică, reorganizarea, restructurarea şi schimbarea sediului
şi a denumirilor pentru spitalele private se fac cu avizul Ministerului
Sănătăţii Publice, în condiţiile legii.
(5) Secţia privată se poate organiza în structura
oricărui spital public. Condiţiile de înfiinţare, organizare şi funcţionare se
stabilesc prin ordin al ministrului sănătăţii publice.
(6) Se asimilează spitalelor private şi unităţile
sanitare private înfiinţate în cadrul unor organizaţii nonguvernamentale sau al
unor societăţi comerciale, care acordă servicii medicale spitaliceşti.
Art. 175. - (1) Autorizaţia sanitară de funcţionare se
emite în condiţiile stabilite prin normele aprobate prin ordin al ministrului
sănătăţii publice şi dă dreptul spitalului să funcţioneze. După obţinerea
autorizaţiei sanitare de funcţionare, spitalul intră, la cerere, în procedura
de acreditare. Procedura de acreditare nu se poate extinde pe o perioadă mai
mare de 5 ani. Neobţinerea acreditării în termen de 5 ani de la emiterea
autorizaţiei de funcţionare conduce la desfiinţarea spitalului în cauză.
(2) Acreditarea garantează faptul că spitalele
funcţionează la standardele stabilite potrivit prezentului titlu, privind
acordarea serviciilor medicale şi conexe actului medical, certificând calitatea
serviciilor de sănătate în conformitate cu clasificarea
spitalelor, pe categorii de acreditare.
(3) Acreditarea se acordă de Comisia Naţională de
Acreditare a Spitalelor, instituţie cu personalitate juridică, ce funcţionează
în coordonarea primului-ministru, finanţată din venituri proprii şi subvenţii
acordate de la bugetul de stat.
(4) Componenţa, atribuţiile, modul de organizare şi
funcţionare ale Comisiei Naţionale de Acreditare a Spitalelor se aprobă prin
hotărâre a Guvernului, la propunerea Ministerului Sănătăţii Publice.
(5) Din Comisia Naţională de Acreditare a Spitalelor
vor face parte reprezentanţi ai Preşedinţiei, Guvernului, Academiei Române,
Colegiului Medicilor din România, Ordinului Asistenţilor Medicali şi Moaşelor
din România. Membrii Comisiei Naţionale de Acreditare a Spitalelor, precum şi
rudele sau afinii acestora până la gradul al IV-lea inclusiv sunt incompatibili
cu calitatea de membru în organele de conducere ale spitalelor şi nu pot deţine
cabinete sau clinici private.
(6) Pentru obţinerea acreditării se percepe o taxă de
acreditare, al cărei nivel se aprobă prin ordin al Comisiei Naţionale de
Acreditare a Spitalelor, la propunerea ministrului sănătăţii publice.
(7) Veniturile încasate din activitatea de acreditare
sunt venituri proprii ale Comisiei Naţionale de
Acreditare a Spitalelor, care urmează a fi utilizate pentru organizarea şi
funcţionarea Comisiei Naţionale de Acreditare a Spitalelor, în condiţiile
legii.
Art. 176. - (1) Procedurile, standardele şi metodologia
de acreditare se elaborează de către Comisia Naţională de Acreditare a Spitalelor
şi se aprobă prin ordin al ministrului sănătăţii publice.
(2) Lista cu unităţile spitaliceşti acreditate şi
categoria acreditării se publică în Monitorul Oficial al României, Partea I.
Art. 177. - (1) Acreditarea
este valabilă 5 ani. Inainte de expirarea termenului, spitalul solicită
evaluarea în vederea reacreditării.
(2) Reevaluarea unui spital se poate face şi la
solicitarea Ministerului Sănătăţii Publice, a casei Naţionale de Asigurări de
Sănătate sau, după caz, a ministerelor şi instituţiilor cu reţea sanitară
proprie. Taxele legate de reevaluare sunt suportate de solicitant.
(3) Dacă în urma evaluării se constată că nu mai sunt
îndeplinite standardele de acreditare, Comisia Naţională de Acreditare a
Spitalelor acordă un termen pentru conformare sau retrage acreditarea pentru
categoria solicitată.
CAPITOLUL III
Conducerea spitalelor
Art. 178. - (1) Spitalul public este condus de un
manager, persoană fizică sau juridică.
(2) Managerul persoană fizică sau reprezentantul
desemnat de managerul persoană juridică trebuie să fie absolvent al unei
instituţii de învăţământ superior şi al unor cursuri de perfecţionare în
management sau management sanitar, agreate de Ministerul Sănătăţii Publice şi
stabilite prin ordin al ministrului sănătăţii publice.
(3) Managerul, persoană fizică sau juridică, încheie
contract de management cu Ministerul Sănătăţii Publice sau cu ministerele,
respectiv instituţiile cu reţea sanitară proprie, după caz, pe o perioadă de 3
ani. Contractul de management poate fi prelungit sau poate înceta înainte de
termen, în urma evaluării anuale efectuate pe baza criteriilor de performanţă
stabilite prin ordin al ministrului sănătăţii publice.
(4) Modelul contractului de management, în cuprinsul căruia sunt prevăzuţi şi indicatorii de performanţă a
activităţii, se aprobă prin ordin al ministrului sănătăţii publice, cu
consultarea ministerelor şi instituţiilor cu reţea sanitară proprie. Nivelul
indicatorilor de performanţă a activităţii se stabileşte anual de Ministerul
Sănătăţii Publice, respectiv de ministrul de resort, în funcţie de subordonarea
spitalului. Contractul de management va avea la bază un buget global negociat,
a cărui execuţie va fi evaluată anual.
Art. 179. - (1) Ministerul
Sănătăţii Publice, respectiv Ministerul Transporturilor, Construcţiilor şi
Turismului organizează concurs sau licitaţie publică, după caz, pentru
selecţionarea managerului, respectiv a unei persoane juridice care să asigure
managementul unităţii sanitare, care va fi numit prin ordin al ministrului
sănătăţii publice sau, după caz, al ministrului transporturilor, construcţiilor
şi turismului.
(2) Managerul persoană fizică va fi selectat prin
concurs de o comisie numită de ministrul sănătăţii publice sau, după caz, de
ministrul transporturilor, construcţiilor şi turismului, potrivit normelor
aprobate prin ordin al ministrului sănătăţii publice sau, după caz, al
ministrului transporturilor, construcţiilor şi turismului, avizate de
Ministerul Sănătăţii Publice.
(3) Pentru spitalele din sistemul de apărare, ordine
publică, siguranţă naţională şi autoritate judecătorească, funcţia de
comandant/director general sau, după caz, de manager se ocupă de o persoană
numită de conducătorul ministerului sau al instituţiei care are în structură
spitalul, conform reglementărilor proprii adaptate la specificul prevederilor
prezentului titlu.
(4) Selecţia managerului persoană juridică se
efectuează prin licitaţie publică, conform dispoziţiilor legii achiziţiilor
publice.
Art. 180. - (1) Funcţia de
manager persoană fizică este incompatibilă cu:
a) exercitarea oricăror alte funcţii salarizate,
nesalarizate sau/şi indemnizate inclusiv în cadrul unei autorităţi executive,
legislative ori judecătoreşti;
b) exercitarea oricărei activităţi sau oricărei alte
funcţii de manager, inclusiv cele neremunerate;
c) exercitarea unei activităţi sau a unei funcţii de
membru în structurile de conducere ale unei alte unităţi spitaliceşti;
d) exercitarea oricărei funcţii în cadrul
organizaţiilor sindicale sau patronale de profil.
(2) Constituie conflict de interese deţinerea de către
manager persoană fizică, manager persoană juridică ori reprezentant al
persoanei juridice de părţi sociale, acţiuni sau interese la societăţi comerciale ori organizaţii nonguvernamentale
care stabilesc relaţii comerciale cu spitalul la care persoana în cauză
exercită sau intenţionează să exercite funcţia de manager. Dispoziţia de mai
sus se aplică şi în cazurile în care astfel de părţi sociale, acţiuni sau
interese sunt deţinute de către rudele ori afinii până la gradul al IV-lea
inclusiv ale persoanei în cauză.
(3) Incompatibilităţile şi conflictul de interese
sunt aplicabile atât persoanei fizice, cât şi reprezentantului desemnat al
persoanei juridice care exercită sau intenţionează să exercite funcţia de
manager de spital.
(4) Dacă managerul selectat prin concurs ori
reprezentantul desemnat al persoanei juridice selectate în urma licitaţiei se
află în stare de incompatibilitate sau în conflict de interese, acesta este
obligat să înlăture motivele de incompatibilitate ori de conflict de interese
în termen de 30 de zile de la apariţia acestora. In caz contrar, contractul de
management este reziliat de plin drept. Ministerul Sănătăţii Publice sau, după
caz, ministerul ori instituţia publică semnatară a contractului de management
va putea cere persoanelor în cauză despăgubiri, conform clauzelor contractului
de management.
(5) Persoanele care îndeplinesc funcţia de manager la
spitalele şi celelalte unităţi sanitare care au sub 400 de paturi, cu excepţia
spitalelor din subordinea Ministerului Transporturilor, Construcţiilor şi
Turismului, pot desfăşura activitate medicală în instituţia respectivă.
Art. 181. - Atribuţiile managerului sunt stabilite prin
contractul de management.
Art. 182. - In domeniul politicii de personal şi al
structurii organizatorice managerul are, în principal, următoarele atribuţii:
a) stabileşte şi aprobă numărul de personal, pe
categorii şi locuri de muncă, în funcţie de normativul de personal în vigoare;
b) aprobă organizarea concursurilor pentru posturile
vacante, numeşte şi eliberează din funcţie personalul spitalului;
c) aprobă programul de lucru, pe locuri de muncă şi
categorii de personal;
d) propune structura organizatorică, reorganizarea,
schimbarea sediului şi a denumirii unităţii, în vederea aprobării de către
Ministerul Sănătăţii Publice sau, după caz, de ministerele care au spitale în
subordine ori în administrare sau reţea sanitară proprie;
e) numeşte, conform art. 183, membrii
comitetului director. Art. 183. - (1) In cadrul spitalelor publice
se organizează şi funcţionează un comitet director,
format din managerul spitalului, directorul medical, directorul de
cercetare-dezvoltare pentru spitalele clinice, directorul financiar-contabil
şi, după caz, directorul de îngrijiri, precum şi alţi directori, potrivit
normelor interne de organizare a spitalelor. Ocuparea funcţiilor specifice
comitetului director se face prin concurs organizat de managerul spitalului.
(2) Pentru ministerele şi
instituţiile cu reţea sanitară proprie, structura comitetului director se
stabileşte de către acestea, în conformitate cu regulamentele interne proprii.
(3) Atribuţiile comitetului director sunt stabilite
prin ordin al ministrului sănătăţii publice.
(4) In spitalele clinice, directorul medical poate fi
un cadru didactic universitar medical.
Art. 184. - (1) Secţiile, laboratoarele şi serviciile
medicale ale spitalului public sunt conduse de un şef de secţie, şef de
laborator sau, după caz, şef de serviciu. Aceste funcţii se ocupă prin concurs
sau examen, după caz, în condiţiile legii, organizat conform normelor aprobate
prin ordin al ministrului sănătăţii publice.
(2) In spitalele publice funcţiile de şef de secţie,
şef de laborator, farmacist-şef, asistent medical şef sunt funcţii de conducere şi vor putea fi ocupate numai
de medici, farmacişti, biologi, chimişti şi biochimişti sau, după caz,
asistenţi medicali, cu o vechime de cel puţin 5 ani în specialitatea
respectivă.
(3) Şefii de secţie au ca atribuţii îndrumarea şi
realizarea activităţii de acordare a îngrijirilor medicale în cadrul secţiei
respective şi răspund de calitatea actului medical, precum şi atribuţiile
asumate prin contractul de administrare.
(4) La numirea în funcţie,
şefii de secţie, de laborator sau de serviciu vor încheia cu spitalul public,
reprezentat de managerul acestuia, un contract de administrare cu o durată de 3
ani, în cuprinsul căruia sunt prevăzuţi indicatori specifici de performanţă.
Contractul de administrare poate fi prelungit şi poate înceta înainte de
termen, în principal, în cazul neîndeplinirii indicatorilor specifici de
performanţă. Pe perioada existenţei contractului de administrare, eventualul
contract de muncă încheiat cu o altă instituţie publică din domeniul sanitar se
suspendă. Conţinutul contractului şi metodologia de încheiere a acestuia se vor
stabili prin ordin al ministrului sănătăţii publice. Dacă şeful de secţie
selectat prin concurs se află în stare de incompatibilitate sau conflict de
interese, acesta este obligat să le înlăture în termen de maximum 30 de zile
sub sancţiunea rezilierii unilaterale a contractului de administrare.
(5) Calitatea de şef de secţie este compatibilă cu
funcţia de cadru didactic universitar.
(6) In secţiile clinice universitare
funcţia de şef de secţie se ocupă de cadrul didactic cu gradul cel mai mare de
predare, la recomandarea senatului sau a consiliului profesoral al instituţiei
de învăţământ medical superior în cauză.
(7) In cazul în care contractul
de administrare, prevăzut la alin. (4), nu se semnează în termen de 7 zile de
la emiterea recomandării, se va constitui o comisie de mediere numită prin
ordin al ministrului sănătăţii publice sau, după caz, al ministrului
transporturilor, construcţiilor şi turismului. In cazul în care conflictul nu
se soluţionează într-un nou termen de 7 zile, postul va fi scos la concurs, în
condiţiile legii.
(8) Pentru secţiile clinice, altele decât cele
prevăzute la alin. (6), precum şi pentru secţiile neclinice condiţiile de participare
la concurs vor fi stabilite prin ordin al ministrului sănătăţii publice, iar în
cazul spitalelor aparţinând ministerelor sau instituţiilor cu reţea sanitară
proprie, condiţiile de participare la concurs vor fi stabilite prin ordin al
ministrului, respectiv prin decizie a conducătorului instituţiei, cu avizul
Ministerului Sănătăţii Publice. In cazul în care la concurs nu se prezintă nici
un candidat în termenul legal, managerul spitalului public va delega un alt
medic în funcţia de şef de secţie, pe o perioadă de până la 6 luni, după care
se vor repeta procedurile prevăzute la alin. (1).
(9) Şefii de secţie vor face publice, prin declaraţie
pe propria răspundere, afişată pe site-ul spitalului şi al autorităţii de
sănătate publică teritorială sau pe site-ul Ministerului Sănătăţii Publice ori,
după caz, al Ministerului Transporturilor, Construcţiilor şi Turismului pentru
unităţile sanitare subordonate acestuia, legăturile de rudenie până la gradul
al IV-lea inclusiv cu personalul angajat în secţia pe care o conduce.
(10) Medicii care împlinesc vârsta de pensionare după
dobândirea funcţiei de manager de spital, director medical sau şef de secţie
vor fi pensionaţi conform legii. Medicii în vârstă de cel puţin 65 de ani nu
pot participa la concurs şi nu pot fi numiţi în nici una dintre funcţiile de
manager de spital, director medical sau şef de secţie.
(11) In spitalele clinice, profesorii universitari pot
ocupa funcţii de şef de secţie până la vârsta de 70 de ani, cu avizul
Colegiului Medicilor din România şi cu aprobarea ministrului sănătăţii publice.
(12) Dispoziţiile art. 180 alin. (1) lit. b)-d)
referitoare la incompatibilităţi, conflicte de interese şi sancţiunea
rezilierii contractului de administrare se aplică şi şefilor de secţie, de laborator sau de serviciu din spitalele publice.
Art. 185. - (1) In cadrul spitalelor publice
funcţionează un consiliu etic, un consiliu medical şi un consiliu ştiinţific,
pentru spitalele clinice şi institutele şi centrele medicale clinice.
Directorul medical este preşedintele consiliului medical. Directorul ştiinţific
este preşedintele consiliului ştiinţific.
(2) Componenţa şi atribuţiile consiliului etic şi ale
consiliului ştiinţific se stabilesc prin ordin al ministrului sănătăţii
publice.
(3) Consiliul medical este
alcătuit din şefii de secţii, de laboratoare, farmacistul-şef şi asistentul
şef.
(4) Principalele atribuţii ale consiliului medical
sunt următoarele:
a) îmbunătăţirea standardelor clinice şi a modelelor
de practică în scopul acordării de servicii medicale de calitate în scopul
creşterii gradului de satisfacţie a pacienţilor;
b) monitorizarea şi evaluarea activităţii medicale
desfăşurate în spital în scopul creşterii performanţelor profesionale şi
utilizării eficiente a resurselor alocate;
c) elaborarea proiectului de plan de achiziţii al
spitalului în limita bugetului estimat;
d) întărirea disciplinei economico-financiare.
Art. 186. - (1) In cadrul spitalului public
funcţionează un consiliu consultativ, care are rolul de a dezbate principalele
probleme de strategie şi de organizare şi funcţionare a spitalului şi de a face
recomandări managerilor spitalului în urma dezbaterilor.
(2) Membrii consiliului consultativ sunt:
a) 2 reprezentanţi ai Ministerului Sănătăţii Publice
sau ai autorităţii de sănătate publică, cu personalitate juridică pentru
spitalele din subordinea Ministerului Sănătăţii Publice;
b) 2 reprezentanţi ai ministerelor şi instituţiilor cu
reţea sanitară proprie pentru spitalele aflate în subordinea acestora;
c) 2 reprezentanţi numiţi de
consiliul judeţean ori local, respectiv de Consiliul General al Municipiului
Bucureşti, dintre care unul specialist în finanţe publice locale, pentru
spitalele aflate în administrarea consiliilor judeţene sau locale, după caz;
d) managerul spitalului public;
e) 2 reprezentanţi ai universităţii sau facultăţii de
medicină, pentru spitalele clinice, institutele şi centrele medicale clinice;
f) 2 reprezentanţi ai mediului de afaceri,
nominalizaţi de patronatele reprezentantive la nivel naţional pentru spitalele
din reţeaua Ministerului Sănătăţii Publice.
(3) Reprezentanţii sindicatelor legal constituite în
unitate, afiliate federaţiilor sindicale semnatare ale contractului colectiv de
muncă la nivel de ramură sanitară, au statut de invitaţi permanenţi la
şedinţele consiliului consultativ.
(4) Membrii consiliului consultativ al spitalului
public se numesc prin ordin al ministrului sănătăţii publice după nominalizarea
acestora de către instituţiile enumerate la alin. (2) lit. a)-c) şi e). O
persoană nu poate fi membru decât într-un singur consiliu consultativ al unui
spital public.
(5) Consiliul consultativ se întruneşte, în şedinţă
ordinară, cel puţin o dată la 3 luni, precum şi ori de câte ori va fi nevoie,
în şedinţe extraordinare. Deciziile consiliului se iau în prezenţa a cel puţin
două treimi din numărul membrilor săi, cu majoritatea absolută a membrilor
prezenţi.
(6) Pentru ministerele şi instituţiile cu reţea
sanitară proprie, componenţa consiliului consultativ se stabileşte conform
reglementărilor proprii, prin ordin sau decizie, după caz.
(7) Dispoziţiile art. 180 alin. (3) referitoare la
conflicte de interese se aplică şi membrilor consiliului consultativ.
Art. 187. - (1) Persoanele din conducerea spitalului
public, respectiv managerul, membrii comitetului
director, şefii de secţie, de laborator sau de serviciu şi membrii consiliului
consultativ, au obligaţia de a depune o declaraţie de interese, precum şi o
declaraţie cu privire la incompatibilităţile prevăzute la art. 180, în termen
de 15 zile de la numirea în funcţie, la Ministerul Sănătăţii Publice sau, după
caz, la ministerele şi instituţiile cu reţea sanitară proprie.
(2) Declaraţia prevăzută la alin. (1) se actualizează
ori de câte ori intervin modificări în situaţia persoanelor în cauză;
actualizarea se face în termen de 30 de zile de la data apariţiei modificării,
precum şi a încetării funcţiilor sau activităţilor.
(3) Declaraţiile se afişează pe site-ul spitalului.
(4) Modelul declaraţiei de interese şi cel al
declaraţiei referitoare la incompatibilităţi se aprobă prin ordin al
ministrului sănătăţii publice.
(5) In condiţiile prevăzute la alin. (1) şi (2),
persoanele din conducerea spitalului au obligaţia de a depune şi o declaraţie
de avere, al cărei model se aprobă prin ordin al ministrului sănătăţii publice.
CAPITOLUL IV
Finanţarea spitalelor
Art. 188. - (1) Spitalele publice sunt instituţii
publice finanţate integral din venituri proprii şi funcţionează pe principiul
autonomiei financiare. Veniturile proprii ale spitalelor publice provin din
sumele încasate pentru serviciile medicale, alte prestaţii efectuate pe bază de
contract, precum şi din alte surse, conform legii.
(2) Prin autonomie financiară se înţelege:
a) organizarea activităţii spitalului pe baza
bugetului de venituri şi cheltuieli propriu, aprobat de conducerea unităţii şi
cu acordul ordonatorului de credite ierarhic superior;
b) elaborarea bugetului propriu de venituri şi
cheltuieli, pe baza evaluării veniturilor proprii din anul bugetar şi a
repartizării cheltuielilor pe baza propunerilor fundamentate ale secţiilor şi
compartimentelor din structura spitalului.
(3) Spitalele publice au obligaţia de a asigura
realizarea veniturilor şi de a fundamenta cheltuielile în raport cu acţiunile
şi obiectivele din anul bugetar pe titluri, articole şi alineate, conform
clasificaţiei bugetare.
(4) Prevederile alin. (2) sunt aplicabile şi în
cadrul ministerelor cu reţea sanitară proprie.
Art. 189. - (1) Contractul de furnizare de servicii
medicale al spitalului public cu casa de asigurări
sociale de sănătate reprezintă sursa principală a veniturilor în cadrul
bugetului de venituri şi cheltuieli şi se negociază de către manager cu
conducerea casei de asigurări sociale de sănătate, în funcţie de indicatorii
stabiliţi în contractul-cadru de furnizare de servicii medicale.
(2) In cazul refuzului uneia dintre părţi de a semna
contractul de furnizare de servicii medicale, se constituie o comisie de mediere
formată din reprezentanţi ai Ministerului Sănătăţii Publice, respectiv ai
ministerului de resort, precum şi ai Casei Naţionale de Asigurări de Sănătate,
care, în termen de maximum 10 zile, soluţionează divergenţele.
(3) Spitalele pot încheia contracte de furnizare de
servicii medicale şi cu casele de asigurări de sănătate private.
Art. 190. - (1) Spitalele publice primesc, în
completare, sume de la bugetul de stat sau de la bugetele locale, care vor fi utilizate numai pentru destinaţiile pentru care au fost
alocate, după cum urmează:
a) de la bugetul de stat prin
bugetul Ministerului Sănătăţii Publice sau al ministerelor ori instituţiilor
centrale cu reţea sanitară proprie, precum şi prin bugetul Ministerului
Educaţiei şi Cercetării, pentru spitalele clinice cu secţii universitare;
b) de la bugetul propriu al
judeţului, pentru spitalele judeţene;
c) de la bugetele locale, pentru spitalele de interes
judeţean sau local.
(2) de la bugetul de stat se asigură:
a) desfăşurarea activităţilor cuprinse în programele
naţionale de sănătate;
b) dotarea cu echipamente
medicale, în condiţiile legii;
c) investiţii legate de construirea de noi spitale,
inclusiv pentru finalizarea celor aflate în execuţie;
d) expertizarea, transformarea şi consolidarea construcţiilor
grav afectate de seisme şi de alte cazuri de forţă majoră;
e) modernizarea, transformarea şi extinderea
construcţiilor existente, precum şi efectuarea de reparaţii capitale;
f) activităţi specifice unităţilor şi instituţiilor
cu reţea sanitară proprie;
g) activităţi didactice şi de cercetare; h) alte
cheltuieli curente şi de capital.
(3) Bugetele locale participă la finanţarea unor
cheltuieli de întreţinere, gospodărire, reparaţii, consolidare, extindere şi
modernizare a unităţilor sanitare publice, de interes judeţean sau local, în
limita creditelor bugetare aprobate cu această destinaţie în bugetele locale.
(4) Spitalele publice pot realiza venituri suplimentare
din:
a) donaţii şi sponsorizări;
b) legate;
c) asocieri investiţionale în domenii medicale ori de
cercetare medicală şi farmaceutică;
d) închirierea unor spaţii medicale, echipamente sau
aparatură medicală către alţi furnizori de servicii medicale, în condiţiile
legii;
e) contracte privind furnizarea de servicii medicale
încheiate cu casele de asigurări private sau agenţi economici;
f) editarea şi difuzarea unor publicaţii cu caracter
medical;
g) servicii medicale, hoteliere sau de altă natură,
furnizate la cererea unor terţi;
h) servicii de asistenţă medicală la domiciliu,
furnizate la cererea pacienţilor;
i) contracte de cercetare şi
alte surse;
j) alte surse, conform legii.
Art. 191. - (1) Proiectul bugetului de venituri şi
cheltuieli al spitalului public se elaborează de către comitetul director pe
baza propunerilor fundamentate ale conducătorilor secţiilor şi compartimentelor
din structura spitalului, în conformitate cu normele metodologice aprobate prin
ordin al ministrului sănătăţii publice şi cu contractele colective de muncă, şi
se publică pe site-ul Ministerului Sănătăţii Publice pentru unităţile
subordonate, al autorităţii de sănătate publică sau pe site-urile ministerelor
şi instituţiilor sanitare cu reţele sanitare proprii, după caz, în termen de 15
zile calendaristice de la aprobarea lui.
(2) Pentru ministerele şi instituţiile cu reţea
sanitară proprie, normele metodologice prevăzute la alin. (1) se aprobă, prin
ordin sau decizie, de conducătorul acestora, cu avizul Ministerului Sănătăţii
Publice.
(3) Bugetul de venituri şi cheltuieli al spitalului
public se aprobă de ordonatorul de credite ierarhic superior, la propunerea managerului spitalului.
(4) Bugetul de venituri şi cheltuieli al spitalului
public se repartizează pe secţiile şi compartimentele din structura spitalului,
nivelul acestora fiind indicator al contractului de administrare.
(5) Execuţia bugetului de venituri şi cheltuieli se
urmăreşte pe secţii şi compartimente, fiind un indicator al contractului
încheiat între manager şi şefii secţiilor şi compartimentelor din structura
spitalului. Abaterile faţă de indicatorii din contractul cu managerul se
analizează şi se soluţionează de conducerea spitalului cu conducerile
structurilor în cauză.
(6) Execuţia bugetului de venituri şi cheltuieli se
raportează lunar, respectiv trimestrial, unităţilor deconcentrate cu
personalitate juridică ale Ministerului Sănătăţii Publice şi, respectiv,
ministerului sau instituţiei cu reţea sanitară proprie, în funcţie de
subordonare, şi se publică pe site-ul Ministerului Sănătăţii Publice pentru
unităţile subordonate, al autorităţii de sănătate publică sau pe site-urile
ministerelor şi instituţiilor sanitare cu reţele sanitare proprii.
(7) Execuţia bugetului de venituri şi cheltuieli se
raportează lunar şi trimestrial şi consiliului local şi/sau judeţean, după caz,
dacă beneficiază de finanţare din bugetele locale.
(8) Unităţile deconcentrate
cu personalitate juridică ale Ministerului Sănătăţii Publice, respectiv
direcţiile medicale ori similare ale ministerelor şi instituţiilor cu reţea
sanitară proprie analizează execuţia bugetelor de venituri şi cheltuieli lunare
şi trimestriale şi le înaintează Ministerului Sănătăţii Publice, respectiv
ministerului sau instituţiei cu reţea sanitară proprie, după caz. Dacă se
constată abateri faţă de indicatorii din contractul de administrare, le
sesizează şi fac propuneri, pe care le supun spre aprobare conducerii
Ministerului Sănătăţii Publice, respectiv ministerului sau instituţiei cu reţea
sanitară proprie.
Art. 192. - In cazul existenţei unor datorii la data
încheierii contractului de management, acestea vor fi evidenţiate separat,
stabilindu-se posibilităţile şi intervalul în care vor fi lichidate, în
condiţiile legii.
Art. 193. - (1) Auditul public intern se exercită de
către structura deconcentrată a Ministerului Sănătăţii Publice pentru spitalele
cu mai puţin de 400 de paturi, iar pentru spitalele cu peste 400 de paturi, de
către un compartiment funcţional de audit la nivelul spitalului.
(2) Auditul public intern pentru spitalele aparţinând
ministerelor şi instituţiilor cu reţea sanitară proprie se exercită în
conformitate cu dispoziţiile legale şi cu reglementările specifice ale
acestora.
(3) Controlul asupra activităţii financiare a
spitalului public se face, în condiţiile legii, de Curtea de Conturi,
Ministerul Sănătăţii Publice, de ministerele şi instituţiile cu reţea sanitară
proprie sau de alte organe abilitate prin lege.
Art. 194. - (1) Fondul de dezvoltare al spitalului se
constituie din următoarele surse:
a) cotă-parte din amortizarea calculată lunar şi
cuprinsă în bugetul de venituri şi cheltuieli al spitalului, cu păstrarea
echilibrului financiar;
b) sume rezultate din valorificarea bunurilor
disponibile, precum şi din cele casate cu respectarea dispoziţiilor legale în
vigoare;
c) sponsorizări cu destinaţia „dezvoltare";
d) o cotă de 20% din excedentul bugetului de venituri
şi cheltuieli înregistrat la finele exerciţiului financiar;
e) sume rezultate din închirieri, în condiţiile legii.
(2) Fondul de dezvoltare se utilizează pentru dotarea
spitalului.
(3) Soldul fondului de dezvoltare rămas la finele
anului se reportează în anul următor, fiind utilizat potrivit destinaţiei
prevăzute la alin. (2).
Art. 195. - Decontarea contravalorii serviciilor
medicale contractate se face conform contractului de furnizare de servicii
medicale, pe bază de documente justificative, în funcţie de realizarea
acestora, cu respectarea prevederilor contractului-cadru privind condiţiile
acordării asistenţei medicale în cadrul sistemului asigurărilor sociale de
sănătate.
Art. 196. - In cazul unor activităţi medicale sau
farmaceutice pentru care unitatea spitalicească nu are specialişti competenţi
în astfel de activităţi sau manopere medicale, se poate încheia un contract
privind furnizarea unor astfel de servicii medicale sau farmaceutice cu un
cabinet medical specializat, respectiv furnizor de servicii farmaceutice ori cu
o altă unitate medicală publică sau privată acreditată. Unităţile spitaliceşti
pot încheia contracte privind furnizarea de servicii auxiliare necesare
funcţionării spitalului.
Art. 197. - (1) Salarizarea personalului de conducere din spitalele publice, precum şi a celorlalte categorii de
personal se stabileşte potrivit legii.
(2) Salarizarea personalului din spitalele private se
stabileşte prin negociere între părţi.
CAPITOLUL V
Dispoziţii tranzitorii şi finale
Art. 198. - (1) Spitalul are
obligaţia să înregistreze, să stocheze, să prelucreze şi să transmită informaţiile
legate de activitatea sa, conform normelor aprobate prin ordin al ministrului
sănătăţii publice.
(2) Raportările se fac către Ministerul Sănătăţii
Publice şi/sau unităţile deconcentrate cu personalitate juridică ale
Ministerului Sănătăţii Publice sau către ministerele şi instituţiile cu reţea
sanitară proprie, după caz, şi constituie baza de date, la nivel naţional,
pentru decizii majore de politică sanitară şi pentru raportările necesare
organismelor Uniunii Europene şi Organizaţiei Mondiale a Sănătăţii.
(3) Documentaţia primară, ca sursă a acestor date, se
păstrează, securizată şi asigurată sub formă de document scris şi electronic,
constituind arhiva spitalului, conform reglementărilor legale în vigoare.
(4) Informaţiile prevăzute la alin. (1), care
constituie secrete de stat şi de serviciu, vor fi accesate şi gestionate
conform standardelor naţionale de protecţie a informaţiilor clasificate.
Art. 199. - Ministerul
Sănătăţii Publice, ministerele şi instituţiile cu reţea sanitară proprie vor
lua măsuri pentru reorganizarea spitalelor publice existente, în conformitate
cu prevederile prezentului titlu, în termen de maximum 180 de zile de la data
intrării în vigoare a acestuia.
Art. 200. - (1) Ministerul Sănătăţii Publice analizează
şi evaluează periodic şi ori de câte ori este nevoie sau la sesizarea organelor
abilitate ale statului performanţele unităţilor sanitare publice cu paturi,
care sunt în relaţii contractuale cu casele de asigurări de sănătate,
indiferent de subordonarea lor sau de titularul dreptului de administrare
asupra lor, numind o comisie de evaluare.
(2) Pentru analiza şi evaluarea spitalelor din
reţelele sanitare ale ministerelor sau instituţiilor, altele decât cele ale
Ministerului Sănătăţii Publice, comisia prevăzută la alin. (1) va fi
constituită prin ordin comun al ministrului sănătăţii publice şi ministrului
sau conducătorului instituţiei care are în subordine spitalul.
(3) La propunerea comisiei
prevăzute la alin. (1) şi (2), managerul şi consiliile consultative pot fi
revocate prin ordin al ministrului sănătăţii publice sau, după caz, prin ordin
ori decizie a miniştrilor şi
conducătorilor instituţiilor cu reţele sanitare proprii, cu avizul ministrului
sănătăţii publice.
(4) Pentru unităţile sanitare publice aparţinând ministerelor
şi instituţiilor cu reţea sanitară proprie conducătorii acestora vor emite
ordinele de revocare cu avizul ministrului sănătăţii publice.
(5) Preşedinţii consiliilor consultative şi
comitetelor directoare interimare se numesc pe o perioadă de maximum 6 luni,
prin ordin al ministrului sănătăţii publice sau, după caz, al conducătorilor
instituţiilor şi ministerelor cu reţea sanitară proprie.
Art. 201. - (1) Imobilele din
domeniul public al statului sau al unor unităţi administrativ-teritoriale, aflate
în administrarea unor spitale publice, care se reorganizează şi devin
disponibile, precum şi aparatura medicală pot fi, în condiţiile legii,
închiriate sau concesionate, după caz, unor persoane fizice ori juridice, în
scopul organizării şi funcţionării unor spitale private sau pentru alte forme
de asistenţă medicală ori socială, în condiţiile legii.
(2) Fac excepţie de la prevederile alin. (1) spaţiile
destinate desfăşurării activităţii de învăţământ superior medical şi
farmaceutic uman.
(3) Sumele obţinute în condiţiile legii din
închirierea bunurilor constituie venituri proprii ale spitalului şi se
utilizează pentru cheltuieli curente şi de capital, în conformitate cu bugetul
de venituri şi cheltuieli aprobat.
Art. 202. - Prevederile prezentului titlu se aplică şi
spitalelor care aparţin ministerelor şi instituţiilor cu reţea sanitară
proprie.
Art. 203. - Anual, ministrul sănătăţii publice va
prezenta Guvernului situaţia privind:
a) numărul de spitale, pe diferite categorii;
b) numărul de paturi de spital raportat la numărul de
locuitori;
c) gradul de dotare a spitalelor;
d) principalii indicatori de morbiditate şi
mortalitate;
e) situaţia acreditării
spitalelor publice;
f) zonele şi judeţele ţării în care necesarul de
servicii medicale spitaliceşti nu este acoperit.
Art. 204. - Dacă în termen de un an de la înfiinţarea
Comisei Naţionale de Acreditare a Spitalelor spitalele finanţate în condiţiile
art. 188 alin. (1) nu au început procesul de acreditare sau de reacreditare,
vor pierde dreptul de a mai fi finanţate din aceste fonduri.
Art. 205. - Nerespectarea prevederilor prezentului
titlu atrage răspunderea disciplinară, contravenţională, civilă sau penală,
după caz, în condiţiile legii, a persoanelor vinovate.
Art. 206. - Numirea managerilor selectaţi prin concurs
se face în termen de maximum 90 de zile de la data intrării în vigoare a
prezentului titlu.
Art. 207. - La data intrării în vigoare a prezentului
titlu, Legea spitalelor nr. 270/2003, publicată în Monitorul Oficial al României,
Partea I, nr. 438 din 20 iunie
2003, cu modificările şi completările ulterioare, precum şi orice alte
dispoziţii contrare se abrogă.
TITLUL VIII
Asigurările sociale de sănătate
CAPITOLUL I
Dispoziţii generale
Art. 208. - (1) Asigurările sociale de sănătate
reprezintă principalul sistem de finanţare a ocrotirii sănătăţii populaţiei
care asigură accesul la un pachet de servicii de bază pentru asiguraţi.
(2) Obiectivele sistemului de
asigurări sociale de sănătate sunt:
a) protejarea asiguraţilor faţă de costurile
serviciilor medicale în caz de boală sau accident;
b) asigurarea protecţiei asiguraţilor în mod
universal, echitabil şi nediscriminatoriu în condiţiile utilizării eficiente a
Fondului naţional unic de asigurări sociale de sănătate.
(3) Asigurările sociale de sănătate sunt obligatorii
şi funcţionează ca un sistem unitar, iar obiectivele menţionate la alin. (2) se
realizează pe baza următoarelor principii:
a) alegerea liberă de către asiguraţi a casei de
asigurări;
b) solidaritate şi subsidiaritate în constituirea şi
utilizarea fondurilor;
c) alegerea liberă de către asiguraţi a furnizorilor
de servicii medicale, de medicamente şi de dispozitive medicale, în condiţiile
prezentei legi şi ale contractului-cadru;
d) descentralizarea şi autonomia în conducere şi
administrare;
e) participarea obligatorie la plata contribuţiei de
asigurări sociale de sănătate pentru formarea Fondului naţional unic de
asigurări sociale de sănătate;
f) participarea persoanelor asigurate, a statului şi
a angajatorilor la managementul Fondului naţional unic de asigurări sociale de
sănătate;
g) acordarea unui pachet de servicii medicale de bază,
în mod echitabil şi nediscriminatoriu, oricărui asigurat;
h) transparenţa activităţii sistemului de asigurări sociale
de sănătate;
i) libera concurenţă între furnizorii care încheie
contracte cu casele de asigurări de sănătate.
(4) Pot funcţiona şi alte forme de asigurare a
sănătăţii în diferite situaţii speciale. Aceste asigurări nu sunt obligatorii
şi pot fi oferite voluntar de organismele de asigurare autorizate conform
legii.
(5) Asigurarea voluntară complementară sau
suplimentară de sănătate poate acoperi riscurile individuale în situaţii
speciale şi/sau pe lângă serviciile acoperite de asigurările sociale de
sănătate.
(6) Asigurarea voluntară de sănătate nu exclude
obligaţia de a plăti contribuţia pentru asigurarea socială de sănătate.
(7) Ministerul Sănătăţii Publice, ca autoritate
naţională în domeniul sănătăţii, exercită controlul asupra sistemului de
asigurări sociale de sănătate, din punct de vedere al aplicării politicilor de
sănătate aprobate de Guvernul României.
Art. 209. - (1) Fondul naţional unic de asigurări
sociale de sănătate, denumit în continuare fondul, este un fond special care se constituie şi se utilizează potrivit
prezentei legi.
(2) Constituirea fondului se face din contribuţia
pentru asigurări sociale de sănătate, denumită în continuare contribuţie, suportată de asiguraţi, de persoanele
fizice şi juridice care angajează personal salariat, din subvenţii de la
bugetul de stat, precum şi din alte surse - donaţii, sponsorizări, dobânzi,
exploatarea patrimoniului Casei Naţionale de Asigurări de Sănătate şi al
caselor de asigurări de sănătate potrivit legii.
(3) Gestionarea fondului se face, în condiţiile legii,
prin Casa Naţională de Asigurări de Sănătate, denumită în Continuare CNAS, şi, respectiv, prin casele de
asigurări sociale de sănătate judeţene şi a municipiului Bucureşti, denumite în
continuare case de asigurări. Gestionarea fondului se realizează şi prin
Casa Asigurărilor de Sănătate a Apărării, Ordinii Publice, Siguranţei Naţionale
şi Autorităţii Judecătoreşti şi Casa Asigurărilor de Sănătate a Ministerului
transporturilor, Construcţiilor şi Turismului până la reorganizarea acestora.
(4) CNAS propune, cu avizul Ministerului Sănătăţii
Publice, proiecte de acte normative pentru asigurarea funcţionării sistemului
de asigurări sociale de sănătate şi acordă aviz conform proiectelor de acte
normative care au incidenţă asupra Fondului naţional unic de asigurări sociale
de sănătate.
Art. 210. - (1) In înţelesul prezentului titlu,
termenii şi noţiunile folosite au următoarele semnificaţii:
a) serviciile medicale - acele servicii nominalizate în pachetele de servicii, furnizate
de către persoanele fizice şi juridice, potrivit prezentului titlu;
b) furnizorii -
persoane fizice sau juridice autorizate de Ministerul Sănătăţii Publice pentru
a furniza servicii medicale, medicamente şi dispozitive medicale;
c) pachetul de servicii de
bază - se acordă asiguraţilor şi cuprinde
serviciile medicale, serviciile de îngrijire a sănătăţii, medicamentele,
materialele sanitare, dispozitivele medicale şi alte servicii la care au
dreptul asiguraţii şi se suportă din fond, în condiţiile contractului-cadru;
d) pachetul de servicii ce
se acordă persoanelor care se asigură facultativ -
cuprinde serviciile medicale, serviciile de îngrijire a sănătăţii,
medicamentele, materialele sanitare, dispozitivele medicale şi alte servicii la
care are dreptul această categorie de asiguraţi şi se suportă din fond, în
condiţiile contractului-cadru;
e) pachetul minimal de servicii - se acordă persoanelor care nu fac dovada calităţii de asigurat şi
cuprinde servicii medicale numai în cazul urgenţelor medico-chirurgicale şi al
bolilor cu potenţial edemo-epidemic, inclusiv cele prevăzute în Programul
naţional de imunizări, monitorizarea evoluţiei sarcinii şi a lăuzei, servicii
de planificare familială, stabilite prin contractul-cadru;
f) autorizarea -
reprezintă un control al calificării şi al respectării legislaţiei existente în
domeniu, efectuat pentru toate tipurile de furnizori, necesar pentru a obţine
permisiunea de a furniza servicii medicale în România;
g) evaluarea - o
procedură externă de verificare a performanţelor unui furnizor de servicii
medicale prin care se recunoaşte că furnizorul supus acestui proces corespunde
standardelor prealabil stabilite în scopul de a garanta calitatea tuturor serviciilor medicale furnizate;
h) contractarea -
procesul prin care se reglementează relaţiile dintre casele de asigurări de
sănătate şi furnizori, în vederea asigurării drepturilor pentru persoanele
asigurate în cadrul sistemului de asigurări sociale de sănătate;
i) preţ de referinţă - preţul utilizat în sistemul de asigurări sociale de sănătate
pentru plata unor servicii medicale, a medicamentelor şi a dispozitivelor
medicale, potrivit politicii de preţuri a Ministerului Sănătăţii Publice;
j) dispozitivele medicale - sunt utilizate pentru corectarea văzului, auzului, pentru
protezarea membrelor, respectiv proteze, orteze, dispozitive de mers, necesare
în scopul recuperării unor deficienţe organice sau fiziologice;
k) preţul de decontare - preţul suportat din Fondul naţional unic de asigurări sociale de
sănătate pentru unele medicamente la care nu se stabileşte preţ de referinţă.
Lista acestora şi preţul de decontare se aprobă prin ordin al ministrului
sănătăţii publice;
l) copiata - diferenţa
suportată de asigurat între tariful decontat de casa de asigurări de sănătate
din Fondul naţional unic de asigurări sociale de sănătate şi tariful maximal
stabilit de Ministerul Sănătăţii Publice, ca autoritate naţională în politica
de preţuri a serviciilor medicale, medicamentelor şi dispozitivelor medicale.
(2) Definiţiile care pot exista în alte legi şi care
sunt diferite de cele prevăzute la alin. (1) nu se aplică în cazul prezentei
legi.
CAPITOLUL II
Asiguraţii
SECŢIUNEA 1
Persoanele asigurate
Art. 211. - (1) Sunt asiguraţi,
potrivit prezentei legi, toţi cetăţenii români cu domiciliul în ţară, precum şi
cetăţenii străini şi apatrizii care au solicitat şi obţinut prelungirea
dreptului de şedere temporară sau au domiciliul în România şi fac dovada plăţii
contribuţiei la fond, în condiţiile prezentei legi. In această calitate,
persoana în cauză încheie un contract de asigurare cu casele de asigurări de
sănătate, direct sau prin angajator, al cărui model se stabileşte prin ordin al
preşedintelui CNAS cu avizul consiliului de administraţie.
(2) Calitatea de asigurat şi drepturile de asigurare
încetează odată cu pierderea dreptului de domiciliu sau de şedere în România.
(3) Documentele justificative privind dobândirea
calităţii de asigurat se stabilesc prin ordin al preşedintelui CNAS.
Art. 212. - (1) Calitatea de asigurat se dovedeşte cu
un document justificativ - adeverinţă sau carnet de asigurat - eliberat prin
grija casei de asigurări la care este înscris asiguratul. După implementarea
dispoziţiilor titlului IX din
prezenta lege, aceste documente justificative vor fi înlocuite cu cardul
electronic de asigurat, care se suportă din fond.
(2) Metodologia şi modalităţile de gestionare şi de
distribuire ale cardului de asigurat se stabilesc de către CNAS.
(3) Emiterea cardului electronic de asigurat se face
numai prin sistemul informatic unic integrat al sistemului de asigurări sociale
de sănătate.
Art. 213. - (1) Următoarele categorii de persoane
beneficiază de asigurare, fără plata contribuţiei:
a) toţi copiii până la vârsta de 18 ani, tinerii de la
18 ani până la vârsta de 26 de ani, dacă sunt elevi, inclusiv absolvenţii de
liceu, până la începerea anului universitar, dar nu mai mult de 3 luni, ucenici
sau studenţi şi dacă nu realizează venituri din muncă;
b) tinerii cu vârsta de până la 26 de ani, inclusiv
cei care părăsesc sistemul de protecţie a copilului şi nu realizează venituri
din muncă sau nu sunt beneficiari de ajutor social acordat în temeiul Legii nr.
416/2001 privind venitul minim garantat, cu modificările şi completările
ulterioare; soţul, soţia şi părinţii fără venituri proprii, aflaţi în
întreţinerea unei persoane asigurate;
c) persoanele ale căror drepturi sunt stabilite prin
Decretul-lege nr. 118/1990 privind acordarea unor drepturi persoanelor
persecutate din motive politice de dictatura instaurată cu începere de la 6
martie 1945, precum şi celor deportate în străinătate ori constituite în
prizonieri, republicat, cu modificările şi completările ulterioare, prin
Ordonanţa Guvernului nr. 105/1999 privind acordarea unor drepturi persoanelor
persecutate de către regimurile instaurate în România cu începere de la 6
septembrie 1940 până la 6 martie 1945 din motive etnice, aprobată cu modificări
şi completări prin Legea nr. 189/2000, cu modificările şi completările ulterioare,
prin Legea nr. 44/1994 privind veteranii de război, precum şi unele drepturi
ale invalizilor şi văduvelor de război, republicată, cu modificările şi
completările ulterioare, prin Legea nr. 309/2002 privind recunoaşterea şi
acordarea unor drepturi persoanelor care au efectuat stagiul militar în cadrul
Direcţiei Generale a Serviciului Muncii în perioada 1950-1961, cu modificările
şi completările ulterioare, precum şi persoanele prevăzute la art. 3 alin. (1) lit. b) din Legea
recunoştinţei faţă de eroii martiri şi luptătorii care au contribuit la
victoria Revoluţiei române din decembrie 1989 nr. 341/2004, cu modificările şi
completările ulterioare, dacă nu realizează alte venituri decât cele provenite
din drepturile băneşti acordate de aceste legi, precum şi cele provenite din
pensii;
d) persoanele cu handicap care nu realizează venituri
din muncă, pensie sau alte surse, cu excepţia celor obţinute în baza Ordonanţei
de urgenţă a Guvernului nr. 102/1999 privind protecţia specială şi încadrarea
în muncă a persoanelor cu handicap, aprobată cu modificări şi completări prin
Legea nr. 519/2002, cu modificările şi completările ulterioare;
e) bolnavii cu afecţiuni incluse în programele
naţionale de sănătate stabilite de Ministerul Sănătăţii Publice, până la vindecarea
respectivei afecţiuni, dacă nu realizează venituri din muncă, pensie sau din
alte resurse;
f) femeile însărcinate şi lăuzele, dacă nu au nici un
venit sau au venituri sub salariul de bază minim brut pe ţară.
(2) Sunt asigurate persoanele
aflate în una dintre următoarele situaţii, pe durata acesteia, cu plata
contribuţiei din alte surse, în condiţiile prezentei legi:
a) satisfac serviciul militar în termen;
b) se află în concediu pentru incapacitate temporară
de muncă, acordat în urma unui accident de muncă sau a unei boli profesionale;
c) se află în concediu pentru creşterea copilului până
la împlinirea vârstei de 2 ani şi în cazul copilului cu handicap, până la
împlinirea de către copil a vârstei de 3 ani;
d) execută o pedeapsă
privativă de libertate sau se află în arest preventiv;
e) persoanele care beneficiază de indemnizaţie de
şomaj;
f) sunt returnate sau expulzate ori sunt victime ale
traficului de persoane şi se află în timpul procedurilor necesare stabilirii
identităţii;
g) persoanele care fac parte dintr-o familie care are
dreptul la ajutor social, potrivit Legii nr. 416/2001, cu modificările şi
completările ulterioare;
h) pensionarii, pentru veniturile din pensii până la
limita supusă impozitului pe venit;
i) persoanele care se află în executarea măsurilor
prevăzute la art. 105, 113, 114 din Codul penal; persoanele care se află în
perioada de amânare sau întrerupere a executării pedepsei privative de
libertate, dacă nu au venituri.
(3) Persoanele care au
calitatea de asigurat fără plata contribuţiei vor primi un document
justificativ special, carnet sau adeverinţă de asigurat fără plata contribuţiei
eliberat de casa de asigurări de sănătate, care atestă această calitate în urma
prezentării la casa de asigurări a documentelor care dovedesc că se încadrează
în prevederile alin. (1) sau alin. (2). Acest document va fi vizat periodic,
după caz, în urma prezentării, de către persoana interesată, la casa de
asigurări, a documentelor care dovedesc menţinerea condiţiilor de încadrare în
categoria asiguraţilor fără plata contribuţiei, în condiţiile stabilite prin
ordin al preşedintelui CNAS.
(4) Categoriile de persoane care nu sunt prevăzute la
alin. (1) şi (2) au obligaţia să se asigure în condiţiile art. 211 şi să
plătească contribuţia la asigurările sociale de sănătate în condiţiile
prezentei legi.
Art. 214. - (1) Persoanele asigurate din statele cu
care România a încheiat documente internaţionale cu prevederi în domeniul
sănătăţii beneficiază de servicii medicale şi alte prestaţii acordate pe
teritoriul României, în condiţiile prevăzute de respectivele documente
internaţionale.
(2) Asigurarea socială de sănătate este facultativă
pentru următoarele categorii de persoane care nu se încadrează în prevederile
alin. (1):
a) membrii misiunilor diplomatice acreditate în
România;
b) cetăţenii străini şi apatrizii care se află
temporar în ţară, fără a solicita viză de lungă şedere;
c) cetăţenii români cu domiciliul în străinătate care
se află temporar în ţară.
Art. 215. - (1) Obligaţia virării
contribuţiei pentru asigurările sociale de sănătate revine persoanei juridice
sau fizice care angajează persoane pe bază de contract individual de muncă ori
în baza unui statut special prevăzut de lege, precum şi persoanelor fizice,
după caz.
(2) Persoanele juridice sau fizice la care îşi
desfăşoară activitatea asiguraţii sunt obligate să depună lunar la casele de
asigurări alese în mod liber de asiguraţi declaraţii nominale privind
obligaţiile ce le revin faţă de fond şi dovada plăţii contribuţiilor.
(3) Prevederile alin. (1) şi (2) se aplică şi
persoanelor care exercită profesii libere sau celor care sunt autorizate,
potrivit legii, să desfăşoare activităţi independente.
Art. 216. - In cazul neachitării la termen, potrivit
legii, a contribuţiilor datorate fondului de către persoanele fizice, altele
decât cele pentru care colectarea veniturilor se face de Agenţia Naţională de
Administrare Fiscală, denumită în continuare ANAF, CNAS, prin casele de asigurări sau persoane fizice ori juridice
specializate, procedează la aplicarea măsurilor de executare silită pentru
încasarea sumelor cuvenite bugetului fondului şi a majorărilor de întârziere în
condiţiile Ordonanţei Guvernului nr. 92/2003 privind Codul de procedură
fiscală, republicată, cu modificările şi completările ulterioare.
SECŢIUNEA a 2-a
Drepturile şi obligaţiile asiguraţilor
Art. 217. - (1) Asiguraţii au dreptul la un pachet de
servicii de bază în condiţiile prezentei legi.
(2) Drepturile prevăzute la alin. (1) se stabilesc pe
baza contractului-cadru care se elaborează de CNAS pe baza consultării
Colegiului Medicilor din România, denumit în continuare CMR, Colegiului Medicilor Dentişti din
România, denumit în continuare CMDR, Colegiului Farmaciştilor din România, denumit
în continuare CFR, Ordinului Asistenţilor
Medicali şi Moaşelor din România, denumit în continuare OAMMR, Ordinului Biochimiştilor,
Biologilor şi Chimiştilor, denumit în continuare OBBC,
precum şi a organizaţiilor patronale şi sindicale
reprezentative din domeniul medical, până la data de 31 octombrie a anului în
curs pentru anul următor. Proiectul se avizează de Ministerul Sănătăţii Publice
şi se aprobă prin hotărâre a Guvernului. In cazul nefinalizării elaborării
contractului-cadru în termenul prevăzut, se prelungeşte prin hotărâre a
Guvernului aplicabilitatea contractului-cadru din anul în curs.
(3) Contractul-cadru reglementează, în principal,
condiţiile acordării asistenţei medicale cu privire la:
a) pachetul de servicii de bază la care au dreptul persoanele asigurate;
b) lista serviciilor medicale, a serviciilor de
îngrijiri, inclusiv la domiciliu, a medicamentelor, dispozitivelor medicale şi
a altor servicii pentru asiguraţi, aferente pachetului de servicii de bază
prevăzut la lit. a);
c) criteriile şi standardele
calităţii pachetului de servicii;
d) alocarea resurselor şi controlul costurilor
sistemului de asigurări sociale de sănătate în vederea realizării echilibrului
financiar al fondului;
e) tarifele utilizate în contractarea pachetului de servicii de bază, modul de decontare şi actele necesare în
acest scop;
f) internarea şi externarea bolnavilor;
g) măsuri de îngrijire la domiciliu şi de recuperare;
h) condiţiile acordării serviciilor la nivel regional
şi lista serviciilor care se pot contracta la nivel judeţean, precum şi a celor
care se pot contracta la nivel regional;
i) prescrierea şi eliberarea medicamentelor, a
materialelor sanitare, a procedurilor terapeutice, a protezelor şi a ortezelor,
a dispozitivelor medicale;
j) modul de informare a
asiguraţilor;
k) copiata pentru unele servicii medicale.
(4) Ministerul Sănătăţii Publice împreună cu CNAS sunt
abilitate să organizeze licitaţii şi alte proceduri de achiziţii publice în
vederea derulării programelor naţionale de sănătate, în condiţiile legii.
(5) CNAS va elabora norme metodologice de aplicare a
contractului-cadru, cu consultarea CMR, CFR, CMDR, OAMMR, OBBC, precum şi a
organizaţiilor patronale şi sindicale reprezentative din domeniul medical, până
la 15 decembrie a anului în curs pentru anul următor, care se aprobă prin ordin
al ministrului sănătăţii publice şi al preşedintelui CNAS.
(6) In cazul nefinalizării normelor metodologice,
Ministerul Sănătăţii Publice le va elabora şi le va aproba prin ordin în termen
de 5 zile de la data expirării termenului prevăzut la alin. (5).
Art. 218. - (1) Asiguraţii beneficiază de pachetul de
servicii de bază în caz de boală sau de accident, din prima zi de îmbolnăvire
sau de la data accidentului şi până la vindecare, în condiţiile stabilite de prezenta lege.
(2) Asiguraţii au următoarele drepturi:
a) să aleagă furnizorul de servicii medicale, precum
şi casa de asigurări de sănătate la care se asigură, în condiţiile prezentei
legi şi ale contractului-cadru;
b) să fie înscrişi pe lista unui medic de familie pe
care îl solicită, dacă îndeplinesc toate condiţiile prezentei legi, suportând
cheltuielile de transport dacă opţiunea este pentru un medic din altă
localitate;
c) să îşi schimbe medicul de familie ales numai după
expirarea a cel puţin 6 luni de la data înscrierii pe listele acestuia;
d) să beneficieze de servicii medicale, medicamente,
materiale sanitare şi dispozitive medicale în mod nediscriminatoriu, în
condiţiile legii;
e) să efectueze controale profilactice, în condiţiile stabilite prin contractul-cadru;
f) să beneficieze de servicii de asistenţă medicală
preventivă şi de promovare a sănătăţii, inclusiv pentru depistarea precoce a
bolilor;
g) să beneficieze de servicii medicale în ambulatorii
şi în spitale aflate în relaţie contractuală cu casele de asigurări de
sănătate;
h) să beneficieze de servicii medicale de urgenţă;
i) să beneficieze de unele servicii de asistenţă
stomatologică;
j) să beneficieze de tratament fizioterapeutic şi de
recuperare;
k) să beneficieze de dispozitive
medicale;
l) să beneficieze de servicii
de îngrijiri medicale la domiciliu;
m) să li se garanteze confidenţialitatea privind
datele, în special în ceea ce priveşte diagnosticul şi tratamentul;
n) să aibă dreptul la informaţie în cazul tratamentelor medicale;
o) să beneficieze de concedii şi indemnizaţii de
asigurări sociale de sănătate în condiţiile legii.
(3) Asiguraţii prevăzuţi în Legea nr. 80/1995 privind
statutul cadrelor militare, cu modificările şi completările ulterioare, şi în
Legea nr. 360/2002 privind Statutul poliţistului, cu modificările şi
completările ulterioare, beneficiază de asistenţă medicală gratuită, respectiv
servicii medicale, medicamente
şi dispozitive medicale, suportate din fond, în condiţiile contractului-cadru
şi din bugetele ministerelor şi instituţiilor respective, în condiţiile plăţii
contribuţiei de asigurări sociale de sănătate.
(4) Personalităţile internaţionale cu statut de
demnitar primesc asistenţă medicală de specialitate în unităţi sanitare nominalizate
prin ordin al ministrului sănătăţii publice.
Art. 219. - Obligaţiile asiguraţilor pentru a putea
beneficia de drepturile prevăzute la art. 218 sunt următoarele:
a) să se înscrie pe lista unui medic de familie;
b) să anunţe medicul de familie ori de câte ori apar
modificări în starea lor de sănătate;
c) să se prezinte la controalele profilactice şi
periodice stabilite prin contractul-cadru;
d) să anunţe în termen de 15 zile medicul de familie
şi casa de asigurări asupra modificărilor datelor de identitate sau a
modificărilor referitoare la încadrarea lor într-o anumită categorie de
asiguraţi;
e) să respecte cu stricteţe tratamentul şi
indicaţiile medicului;
f) să aibă o conduită civilizată faţă de personalul
medico-sanitar;
g) să achite contribuţia datorată fondului şi suma
reprezentând copiata, în condiţiile stabilite prin contractul-cadru;
h) să prezinte furnizorilor de servicii medicale
documentele justificative care atestă calitatea de asigurat.
Art. 220. - Persoanele care nu fac dovada calităţii de
asigurat beneficiază de servicii medicale numai în cazul urgenţelor
medico-chirurgicale şi al bolilor cu potenţial endemo-epidemic şi cele
prevăzute în Programul naţional de imunizări, monitorizarea evoluţiei sarcinii
şi a lăuzei, servicii de planificare familială în condiţiile art. 223, în
cadrul unui pachet minimal de servicii medicale, stabilit prin
contractul-cadru.
Art. 221. - Tarifele serviciilor hoteliere pentru
persoana care însoţeşte copilul internat în vârstă de până la 3 ani, precum şi
pentru însoţitorul persoanei cu handicap grav internate se suportă de către
casele de asigurări, dacă medicul consideră necesară prezenţa lor pentru o
perioadă determinată.
Art. 222. - Fiecare asigurat are dreptul de a fi
informat cel puţin o dată pe an, prin casele de asigurări, asupra serviciilor
de care beneficiază, a nivelului de contribuţie personală şi a modalităţii de
plată, precum şi asupra drepturilor şi obligaţiilor sale.
CAPITOLUL III
Servicii medicale suportate din Fondul naţional unic
de asigurări sociale de sănătate
SECŢIUNEA 1
Servicii medicale profilactice
Art. 223. - (1) In scopul prevenirii îmbolnăvirilor, al
depistării precoce a bolii şi al păstrării sănătăţii, asiguraţii, direct sau
prin intermediul medicilor cu care casele de asigurări se află în relaţii
contractuale, vor fi informaţi permanent de către casele de asigurări asupra
mijloacelor de păstrare a sănătăţii, de reducere şi de evitare a cauzelor de
îmbolnăvire şi asupra pericolelor la care se expun în cazul consumului de droguri,
alcool şi tutun.
(2) Serviciile medicale profilactice suportate din fond
sunt următoarele:
a) monitorizarea evoluţiei sarcinii şi a lăuzei,
indiferent de statutul de asigurat al femeii;
b) urmărirea dezvoltării fizice şi psihomotorii a
sugarului şi a copilului;
c) controalele periodice pentru depistarea bolilor
care pot avea consecinţe majore în morbiditate şi mortalitate;
d) servicii medicale din cadrul Programului naţional
de imunizări;
e) servicii de planificare familială, indiferent de
statutul de asigurat al femeii.
(3) Detalierea serviciilor prevăzute la alin. (2) şi
modalităţile de acordare se stabilesc în contractul-cadru.
Art. 224. - Serviciile medicale stomatologice
preventive se suportă din fond, astfel:
a) trimestrial, pentru copiii până la vârsta de 18
ani, individual sau prin formarea de grupe de profilaxie, fie la grădiniţă, fie
la instituţiile de învăţământ preuniversitar;
b) de două ori pe an, pentru tinerii în vârstă de la
18 ani până la 26 de ani, dacă sunt elevi, ucenici sau studenţi şi dacă nu
realizează venituri din muncă.
Art. 225. - Asiguraţii în vârstă de peste 18 ani au
dreptul la control medical pentru prevenirea bolilor cu consecinţe majore în
morbiditate şi mortalitate, în condiţiile stabilite prin contractul-cadru.
SECŢIUNEA a 2-a
Servicii medicale curative
Art. 226. - (1) Asiguraţii au dreptul la servicii
medicale pentru vindecarea bolii, pentru prevenirea complicaţiilor ei, pentru
recuperarea sau cel puţin pentru ameliorarea suferinţei, după caz.
(2) Tratamentul medical se
aplică de către medici sau asistenţi medicali şi de alt personal sanitar, la
indicaţia şi sub supravegherea medicului.
Art. 227. - (1) Serviciile medicale curative ale căror
costuri sunt suportate din fond sunt:
a) serviciile medicale de urgenţă;
b) serviciile medicale
acordate persoanei bolnave până la diagnosticarea afecţiunii: anamneză, examen
clinic, examene de investigaţii paraclinice;
c) tratamentul medical, chirurgical şi unele proceduri
de recuperare;
d) prescrierea tratamentului necesar vindecării, inclusiv indicaţiile privind regimul de viaţă şi muncă,
precum şi cel igieno-dietetic.
(2) Asiguraţii beneficiază de activităţi de suport,
în condiţiile legii.
(3) Detalierea serviciilor prevăzute la alin. (1) şi
(2) şi modalităţile de acordare se stabilesc prin
contractul-cadru.
Art. 228. - (1) Asiguraţii au dreptul la asistenţă
medicală primară şi de specialitate ambulatorie la indicaţia medicului de
familie, în condiţiile contractului-cadru.
(2) Asiguraţii primesc asistenţă medicală de
specialitate în spitale autorizate şi evaluate.
(3) Serviciile spitaliceşti se acordă prin
spitalizare şi cuprind: consultaţii, investigaţii, stabilirea diagnosticului,
tratament medical şi/sau tratament chirurgical, îngrijire, recuperare,
medicamente şi materiale sanitare, dispozitive medicale, cazare şi masă.
(4) Asistenţa medicală de recuperare se acordă pentru
o perioadă de timp şi după un ritm stabilite de medicul curant în unităţi
sanitare autorizate şi evaluate.
(5) Servicii şi îngrijiri medicale la domiciliu se
acordă de furnizori evaluaţi şi autorizaţi în acest sens.
Art. 229. - Serviciile medicale stomatologice se acordă
de către medicul de medicină dentară în cabinete medicale autorizate şi
evaluate conform legii.
Art. 230. - Asiguraţii beneficiază de tratamente
stomatologice care se suportă din fond în condiţiile stabilite prin
contractul-cadru.
SECŢIUNEA a 3-a
Medicamente, materiale sanitare, dispozitive
medicale şi alte mijloace terapeutice
Art. 231. - Asiguraţii beneficiază de medicamente cu
sau fără contribuţie personală, pe bază de prescripţie medicală pentru
medicamentele cuprinse în lista de medicamente prevăzută la art. 232.
Modalităţile de prescriere şi eliberare a medicamentelor se prevăd în contractul-cadru.
Art. 232. - (1) Lista cu medicamente
de care beneficiază asiguraţii cu sau fără contribuţie personală se elaborează
de către Ministerul Sănătăţii Publice şi CNAS, cu consultarea CFR, şi se aprobă
prin hotărâre a Guvernului.
(2) In listă se pot include numai medicamente prevăzute
în Nomenclatorul de produse.
Art. 233. - (1) Contravaloarea medicamentelor prescrise
pentru tratamentul afecţiunilor categoriilor de persoane prevăzute la art. 213
alin. (1) lit. a) şi pentru femeile gravide şi lăuze se suportă din fond, la
nivelul preţului de referinţă sau al preţului de decontare.
(2) Valoarea medicamentelor prevăzute la art. 232
alin. (1), prescrise pentru tratamentul afecţiunilor persoanelor prevăzute în
actele normative de la art. 213 alin. (1) lit. c) şi d), se suportă din fond,
la nivelul preţului de referinţă, în condiţiile contractului-cadru.
(3) Asiguraţii au dreptul la materiale sanitare şi
dispozitive medicale pentru corectarea văzului, auzului, pentru protezarea
membrelor şi la alte materiale de specialitate, în scopul protezării unor
deficienţe organice sau fiziologice, pentru o perioadă determinată sau
nedeterminată, pe baza prescripţiilor medicale, cu sau fără contribuţie
personală, în condiţiile prevăzute în contractul-cadru.
(4) Asiguraţii beneficiază de proceduri
fizioterapeutice, pe baza recomandărilor medicale, cu sau fără contribuţie
personală, în condiţiile prevăzute în contractul-cadru.
(5) Asiguraţii beneficiază de medicamente, materiale
sanitare, dispozitive medicale şi de alte mijloace terapeutice prevăzute în normele metodologice de aplicare a contractului-cadru.
SECŢIUNEA a 4-a
Servicii medicale de îngrijiri la domiciliu şi
alte servicii speciale
Art. 234. - (1) Asiguraţii au dreptul să primească
unele servicii de îngrijiri medicale la domiciliu, acordate de un furnizor
autorizat şi evaluat în condiţiile legii.
(2) Condiţiile acordării serviciilor de îngrijiri
medicale la domiciliu se stabilesc prin contractul-cadru.
Art. 235. - Serviciile de transport sanitar, necesare
pentru realizarea unui serviciu medical pentru
asigurat, se suportă din fond. Asiguraţii au dreptul la transport sanitar în
următoarele situaţii:
a) urgenţe medico-chirurgicale;
b) cazurile prevăzute în contractul-cadru.
SECŢIUNEA a 5-a
Servicii medicale acordate asiguraţilor pe
teritoriul altor state
Art. 236. - (1) Persoanele
asigurate în sistemul de asigurări sociale de sănătate din România, aflate pe
teritoriul statelor cu care România a încheiat documente internaţionale cu
prevederi în domeniul sănătăţii, beneficiază de servicii medicale pe teritoriul
acestor state, în condiţiile prevăzute de respectivele documente
internaţionale.
(2) Rambursarea cheltuielilor ocazionate de acordarea
serviciilor medicale în baza documentelor internaţionale cu prevederi în
domeniul sănătăţii la care România este parte este efectuată de casele de asigurări de sănătate prin intermediul
CNAS.
(3) Pentru efectuarea operaţiunilor prevăzute la alin.
(2) CNAS poate deschide conturi la o instituţie bancară în care casele de
asigurări vor vira sumele reprezentând cheltuielile ocazionate de acordarea
serviciilor medicale şi a altor prestaţii persoanelor menţionate la alin. (1),
în condiţiile documentelor internaţionale cu prevederi în domeniul sănătăţii la
care România este parte. Metodologia de efectuare a acestor plăţi se stabileşte
prin ordin al preşedintelui CNAS cu avizul Ministerului Finanţelor Publice.
SECŢIUNEA a 6-a
Servicii medicale care nu sunt suportate din Fondul
naţional unic de asigurări sociale de sănătate
Art. 237. - (1) Serviciile care nu sunt decontate din fond, contravaloarea acestora fiind suportată de asigurat,
de unităţile care le solicită sau alte surse, după caz, sunt:
a) serviciile medicale acordate în caz de boli
profesionale, accidente de muncă şi sportive, asistenţă medicală la locul de
muncă, asistenţă medicală a sportivilor;
b) unele servicii medicale de înaltă performanţă;
c) unele servicii de asistenţă stomatologică;
d) serviciile hoteliere cu grad înalt de confort;
e) corecţiile estetice efectuate persoanelor cu vârsta
de peste 18 ani;
f) unele medicamente, materiale sanitare şi tipuri de
transport;
g) eliberarea actelor medicale solicitate de
autorităţile care prin activitatea lor au dreptul să cunoască starea de
sănătate a asiguraţilor;
h) fertilizarea in vitro;
i) transplantul de organe şi
ţesuturi, cu excepţia cazurilor prevăzute în Programul Naţional, aprobat de
Agenţia Naţională de Transplant şi CNAS;
j) asistenţa medicală la cerere;
k) contravaloarea unor materiale necesare corectării
văzului şi auzului: baterii pentru aparatele auditive,
ochelari de vedere;
l) contribuţia personală din
preţul medicamentelor, a unor servicii medicale şi a dispozitivelor medicale;
m) serviciile medicale solicitate de asigurat;
n) unele proceduri de recuperare şi de fizioterapie;
o) serviciile nemedicale
efectuate în unităţi medico-sociale;
p) serviciile acordate în cadrul secţiilor/clinicilor
de boli profesionale şi al cabinetelor de medicină a muncii;
q) serviciile hoteliere solicitate de pacienţii ale
căror afecţiuni se tratează în spitalizare de zi.
(2) Serviciile prevăzute la alin. (1) lit. b), c), f),
i) şi n) şi contribuţia personală prevăzută la alin. (1) lit. l) se stabilesc prin contractul-cadru.
SECŢIUNEA a 7-a
Asigurarea calităţii
Art. 238. - Asigurarea calităţii serviciilor din
pachetul de bază pentru asiguraţi revine CNAS prin respectarea următoarelor
măsuri:
a) acceptarea încheierii de contracte numai cu
furnizori autorizaţi şi evaluaţi conform legii;
b) existenţa unui sistem informaţional corespunzător
asigurării unei evidenţe primare privind diagnosticul şi terapia aplicată;
c) respectarea de către furnizori a criteriilor de
calitate a asistenţei medicale şi stomatologice, elaborate de către Ministerul
Sănătăţii Publice şi CNAS;
d) utilizarea pentru tratamentul afecţiunilor numai a medicamentelor din Nomenclatorul de produse
medicamentoase de uz uman;
e) utilizarea materialelor sanitare şi a
dispozitivelor medicale autorizate, conform legii.
Art. 239. - (1) Criteriile privind calitatea asistenţei
medicale acordate asiguraţilor se elaborează de Ministerul Sănătăţii Publice şi
CNAS şi se referă la diagnostic şi tratamentul medico-chirurgical şi
stomatologic.
(2) Criteriile sunt obligatorii pentru toţi furnizorii
de servicii medicale care au încheiat contracte cu casele de asigurări.
Art. 240. - In vederea respectării calităţii
serviciilor medicale furnizate asiguraţilor CNAS şi casele de asigurări
organizează controlul activităţii medicale pe baza criteriilor prevăzute la
art. 238 şi 239.
SECŢIUNEA a 8-a
Acţiuni comune pentru sănătate
Art. 241. - Ministerul Sănătăţii Publice proiectează,
implementează şi coordonează programe naţionale de sănătate, în scopul realizării
obiectivelor politicii de sănătate publică, cu participarea instituţiilor cu
răspundere în domeniul realizării politicii sanitare a statului.
Art. 242. - (1) Ministerul Sănătăţii Publice
organizează împreună cu CNAS licitaţii la nivel naţional şi alte proceduri de
achiziţii publice pentru achiziţionarea medicamentelor şi materialelor
specifice pentru consumul în spitale şi în ambulatoriu, în vederea realizării
programelor naţionale curative de sănătate, cu respectarea dispoziţiilor legale
în vigoare privind achiziţiile publice, inclusiv a celor referitoare la
aplicarea procedurii de licitaţie electronică.
(2) Medicamentele ce se
acordă în ambulatoriu în cadrul programelor naţionale curative de sănătate se
asigură prin farmaciile aparţinând unităţilor sanitare prin care acestea se
derulează sau alte farmacii, după caz.
(3) CNAS poate achiziţiona servicii medicale,
medicamente, materiale sanitare şi dispozitive medicale, aferente programelor
naţionale curative de sănătate şi tratamentelor ambulatorii.
Art. 243. - CNAS poate elabora, pentru furnizorii
aflaţi în relaţii contractuale cu casele de asigurări de sănătate, protocoale
de practică, ca bază de decontare pentru servicii medicale, medicamente si
dispozitive medicale, cu consultarea CMR, CFR, CMDR şi OAMMR.
SECŢIUNEA a 9-a
Evaluarea furnizorilor de servicii medicale, de
dispozitive medicale, de medicamente şi
materiale sanitare
Art. 244. - (1) Pot intra în relaţie contractuală cu
casele de asigurări numai furnizorii de servicii medicale, de dispozitive
medicale şi de medicamente, care îndeplinesc criteriile de evaluare stabilite
de CNAS şi Ministerul Sănătăţii Publice.
(2) Procesul de evaluare cuprinde cabinetele
medicale, ambulatoriile de specialitate, spitalele, farmaciile, furnizorii de
îngrijiri la domiciliu, furnizorii de dispozitive medicale, furnizorii de
servicii medicale de urgenţă prespitalicească şi transport sanitar, precum şi
alte persoane fizice sau juridice autorizate în acest sens de Ministerul
Sănătăţii Publice.
(3) Evaluarea furnizorilor de servicii medicale, de
dispozitive medicale şi de medicamente, prevăzuţi la alin. (2), se face la
nivel naţional sau judeţean.
(4) Comisiile de evaluare la nivel naţional sunt
formate din reprezentanţi ai Ministerului Sănătăţii Publice, CNAS, iar la nivel
judeţean comisiile de evaluare sunt formate din reprezentanţi ai direcţiilor de
sănătate publică judeţene şi a municipiului Bucureşti şi reprezentanţi ai
caselor de asigurări şi, după
caz, ai ministerelor şi instituţiilor cu reţele sanitare proprii.
(5) Regulamentul de funcţionare a comisiilor de
evaluare a furnizorilor de servicii medicale, de dispozitive medicale şi de
medicamente, prevăzuţi la alin. (2), se elaborează de comisiile naţionale şi se
aprobă prin ordin al ministrului sănătăţii publice şi al preşedintelui CNAS.
Standardele de evaluare elaborate de comisiile naţionale de evaluare se aprobă
prin ordin al ministrului sănătăţii publice şi al preşedintelui CNAS.
(6) Metodologia şi nivelul de evaluare a furnizorilor
de servicii medicale, de dispozitive medicale şi de medicamente, prevăzuţi la
alin. (2), se elaborează şi se stabilesc de către comisiile organizate la nivel
naţional şi se aprobă prin ordin al ministrului sănătăţii publice şi al
preşedintelui CNAS.
(7) Finanţarea activităţii desfăşurate în vederea
evaluării se suportă proporţional de către instituţiile şi asociaţiile care
desemnează persoane în comisiile prevăzute la alin. (4).
CAPITOLUL IV
Relaţiile caselor de asigurări sociale de sănătate cu furnizorii de servicii medicale, de dispozitive medicale şi de medicamente
Art. 245. - Furnizorii de servicii medicale, de dispozitive medicale şi de medicamente, care sunt în relaţii
contractuale cu casele de asigurări, sunt:
a) unităţile sanitare publice sau private, organizate
conform prevederilor legale în vigoare, autorizate şi evaluate în condiţiile
legii;
b) farmaciile, distribuitorii
şi producătorii de medicamente şi materiale sanitare;
c) alte persoane fizice şi juridice care furnizează
servicii medicale, medicamente şi dispozitive medicale.
Art. 246. - (1) Relaţiile dintre furnizorii de servicii
medicale, medicamente şi dispozitive medicale şi casele de asigurări sunt de
natură civilă, se stabilesc şi se desfăşoară pe bază de contract care se
încheie anual. In situaţia în care este necesară modificarea sau completarea
clauzelor, acestea sunt negociate şi stipulate în acte adiţionale.
(2) Furnizorii de servicii medicale, medicamente şi
dispozitive medicale sunt obligaţi să prezinte, la încheierea contractului cu
casa de asigurări, asigurări de răspundere civilă în domeniul medical în
concordanţă cu tipul de furnizor, atât pentru furnizor, cât şi pentru
personalul medico-sanitar angajat. Nivelul limitelor de asigurare pe categorii
de furnizori care intră în relaţii contractuale cu casele de asigurări se
stabileşte de CNAS cu avizul CMR, CFR, CMDR, OAMMR şi OBBC, după caz.
Societăţile de asigurări care oferă asigurări de răspundere civilă în domeniul
medical trebuie să fie autorizate de Comisia de Supraveghere a Asigurărilor.
(3) CNAS poate stabili relaţii contractuale directe
cu furnizorii de servicii medicale de dializă. Durata acestor contracte este de
un an şi poate fi prelungită prin acte adiţionale pentru anii următori, în
limita creditelor aprobate prin buget pentru anul respectiv, cu respectarea
dispoziţiilor legale în vigoare.
(4) Furnizorii de servicii medicale, medicamente şi dispozitive medicale au obligaţia de a pune la
dispoziţia organelor de control ale caselor de asigurări documentele
justificative şi actele de evidenţă financiar-contabila privind sumele
decontate din fond.
Art. 247. - Furnizorii de servicii
medicale încheie cu casele de asigurări contracte anuale pe baza modelelor de
contracte prevăzute în normele metodologice de aplicare a contractului-cadru, în cuprinsul cărora
pot fi prevăzute şi alte clauze suplimentare, negociate, în limita prevederilor legale în vigoare.
Art. 248. - Refuzul caselor de asigurări de a încheia
contracte cu furnizorii pentru serviciile medicale din pachetele de servicii,
denunţarea unilaterală a contractului, precum şi răspunsurile la cererile şi la
sesizările furnizorilor se vor face în scris şi motivat, cu indicarea temeiului
legal, în termen de 30 de zile.
Art. 249. - (1) Casele de asigurări încheie cu
furnizorii de servicii medicale, medicamente şi dispozitive medicale contracte
anuale pentru furnizarea de servicii şi pentru plata acestora, urmărind
realizarea echilibrului financiar.
(2) La încheierea contractelor părţile vor avea în
vedere interesul asiguraţilor şi vor ţine seama de economicitatea, eficienţa şi
calitatea serviciilor oferite pe baza criteriilor elaborate de CNAS şi
Ministerul Sănătăţii Publice.
(3) Lista de servicii medicale acordate la nivel
regional, precum şi modalitatea de încheiere a contractelor de furnizare de
servicii cu mai multe case de asigurări dintr-o anumită regiune se stabilesc
prin contractul-cadru.
Art. 250. - (1) Contractele de furnizare de servicii
medicale, medicamente şi dispozitive medicale cuprind şi obligaţiile părţilor
legate de derularea în condiţii optime a clauzelor contractuale, precum şi
clauze care să reglementeze condiţiile de plată a serviciilor furnizate până la
definitivarea unui nou contract între părţi, pentru perioada următoare celei
acoperite prin contract.
(2) Decontarea serviciilor medicale şi a dispozitivelor
medicale aferente lunii decembrie a anului în curs se face în luna ianuarie a
anului următor.
Art. 251. - Casele de asigurări controlează modul în
care furnizorii de servicii medicale respectă clauzele contractuale privind
serviciile furnizate, furnizorii având obligaţia să permită accesul la
evidenţele referitoare la derularea contractului.
Art. 252. - (1) Plata furnizorilor de servicii medicale
poate fi:
a) în asistenţa medicală primară şi de specialitate
ambulatorie, prin tarif pe persoana asigurată, tarif pe serviciu medical;
b) în asistenţa medicală din spitale şi alte unităţi
sanitare publice sau private, în afara celor ambulatorii, prin tarif pe caz
rezolvat, tarif pe zi de spitalizare, tarif pe serviciu medical;
c) prin tarife pentru anumite servicii, stabilite prin
contractul-cadru;
d) prin preţ de referinţă
prevăzut în lista medicamentelor cu sau fără contribuţie personală;
e) prin preţ de decontare, pentru medicamentele la
care nu se stabileşte preţ de referinţă, din lista aprobată prin ordin al
ministrului sănătăţii publice;
f) prin preţ de referinţă pentru unele servicii
medicale sau prin preţ de referinţă prevăzut în lista de materiale sanitare şi
de dispozitive medicale sau, după caz, prin sumă de închiriere pentru cele
acordate pentru o perioadă determinată.
(2) Modalitatea de decontare a
serviciilor medicale, medicamentelor, materialelor sanitare şi dispozitivelor
medicale se stabileşte prin contractul-cadru.
Art. 253. - Decontarea serviciilor medicale, a
medicamentelor şi dispozitivelor medicale se face în baza contractelor
încheiate între casele de asigurări şi furnizorii de servicii medicale,
indiferent de casa de asigurări unde este luat în evidenţă asiguratul, pe baza
documentelor justificative stabilite prin contractul-cadru.
Art. 254. - Asistenţa medicală şi îngrijirile medicale
la domiciliul asiguratului se contractează de casele de asigurări cu furnizori
autorizaţi şi evaluaţi în condiţiile legii.
Art. 255. - Asistenţa medicală de urgenţă
prespitalicească şi serviciile de transport medical se acordă prin unităţi
medicale specializate autorizate şi evaluate.
CAPITOLUL V
Finanţarea serviciilor medicale, a medicamentelor şi
dispozitivelor medicale
SECŢIUNEA 1
Constituirea Fondului naţional unic de asigurări
sociale de sănătate
Art. 256. - (1) Fondul naţional unic de asigurări
sociale de sănătate se formează din:
a) contribuţii ale persoanelor fizice şi juridice;
b) subvenţii de la bugetul de stat;
c) dobânzi, donaţii, sponsorizări, venituri obţinute
din exploatarea patrimoniului CNAS şi caselor de asigurări, precum şi alte
venituri, în condiţiile legii.
(2) Colectarea contribuţiilor persoanelor juridice şi
fizice care au calitatea de angajator se face de către Ministerul Finanţelor
Publice, prin ANAF, în contul unic deschis pe seama CNAS în condiţiile legii,
iar colectarea contribuţiilor persoanelor fizice, altele decât cele pentru care
colectarea veniturilor se face de către ANAF, se efectuează de către casele de
asigurări.
(3) Sumele colectate în contul Fondului naţional unic
de asigurări sociale de sănătate în condiţiile prevăzute la alin. (2) sunt în
permanenţă la dispoziţia CNAS şi se repartizează de ordonatorul principal de
credite proporţional cu sumele stabilite prin legile bugetare anuale, pe
fiecare domeniu de asistenţă medicală.
(4) In mod excepţional, în situaţii motivate, pentru
acoperirea deficitului bugetului Fondului naţional unic de asigurări sociale de
sănătate, după epuizarea fondului de rezervă veniturile bugetului fondului se
completează cu sume care se alocă de la bugetul de stat.
(5) Cota de contribuţie pentru concedii şi
indemnizaţii de asigurări sociale de sănătate, destinată exclusiv finanţării cheltuielilor
cu plata acestor drepturi, este de 0,75%, aplicată la fondul de salarii sau,
după caz, la drepturile reprezentând indemnizaţie de şomaj ori asupra
veniturilor supuse impozitului pe venit, şi se achită la bugetul Fondului
naţional unic de asigurări sociale de sănătate, în condiţiile legii.
Art. 257. - (1) Persoana asigurată are obligaţia plăţii
unei contribuţii băneşti lunare pentru asigurările de sănătate, cu excepţia
persoanelor prevăzute la art. 213 alin. (1).
(2) Contribuţia lunară a persoanei asigurate se
stabileşte sub forma unei cote de 6,5%, care se aplică asupra:
a) veniturilor din salarii sau asimilate salariilor
care se supun impozitului pe venit;
b) veniturilor impozabile realizate de persoane care
desfăşoară activităţi independente care se supun impozitului pe venit; dacă
acest venit este singurul asupra căruia se calculează contribuţia, aceasta nu
poate fi mai mică decât cea calculată la un salariu de bază minim brut pe ţară,
lunar;
c) veniturilor din agricultură supuse impozitului pe
venit şi veniturilor din silvicultură, pentru persoanele fizice care nu au
calitatea de angajator şi nu se încadrează la lit. b);
d) indemnizaţiilor de şomaj;
e) veniturilor din cedarea folosinţei bunurilor,
veniturilor din dividende şi dobânzi, veniturilor din drepturi de proprietate
intelectuală realizate în mod individual şi/sau într-o formă de asociere şi altor venituri care se supun
impozitului pe venit numai în cazul în care nu realizează venituri de natura
celor prevăzute la lit. a)-d), dar nu mai puţin de un salariu de bază minim
brut pe ţară, lunar; f) veniturilor realizate din pensii.
(3) In cazul persoanelor care realizează în acelaşi
timp venituri de natura celor prevăzute la alin. (2) lit. a)-d), contribuţia se
calculează asupra tuturor acestor venituri.
(4) In cazul persoanelor care realizează venituri de
natura celor prevăzute la alin. (2) lit. c) sub nivelul salariului de bază
minim brut pe ţară şi care nu fac parte din familiile beneficiare de ajutor
social, contribuţia lunară de 6,5% datorată se calculează asupra sumei
reprezentând o treime din salariul de bază minim brut pe ţară.
(5) Contribuţiile prevăzute la alin. (2) şi (4) se
plătesc după cum urmează:
a) lunar, pentru cele prevăzute la alin. (2) lit. a),
d) şi f);
b) trimestrial, pentru cele prevăzute la alin. (2)
lit. b) şi la alin. (4);
c) anual, pentru cele prevăzute la alin. (2) lit. c)
şi e).
(6) Contribuţia de asigurări sociale de sănătate nu
se datorează asupra sumelor acordate în momentul disponibilizării, venitului
lunar de completare sau plăţilor compensatorii, potrivit actelor normative care
reglementează aceste domenii, precum şi asupra indemnizaţiilor reglementate de
Ordonanţa de urgenţă a Guvernului nr. 158/2005 privind concediile şi
indemnizaţiile de asigurări sociale de sănătate, cu modificările ulterioare.
(7) Obligaţia virării contribuţiei de asigurări
sociale de sănătate revine persoanei juridice sau fizice care plăteşte
asiguraţilor veniturile prevăzute la alin. (2) lit. a), d) şi f), respectiv
asiguraţilor pentru veniturile prevăzute la alin. (2) lit. b), c) şi e).
(8) Termenul de prescripţie a plăţii contribuţiei de
asigurări sociale de sănătate se stabileşte în acelaşi mod cu cel prevăzut
pentru obligaţiile fiscale.
Art. 258. - (1) Persoanele juridice sau fizice la care
îşi desfăşoară activitatea asiguraţii au obligaţia să calculeze şi să vireze la
fond o contribuţie de 7% asupra fondului de salarii, datorată pentru asigurarea
sănătăţii personalului din unitatea respectivă.
(2) Prin fond de salarii realizat, în sensul prezentei legi, se înţelege totalitatea sumelor utilizate
de o persoană fizică şi juridică pentru plata drepturilor salariale sau asimilate salariilor.
(3) Nerespectarea prevederilor art. 257 alin. (1) duce
la diminuarea pachetului de servicii de bază, potrivit prevederilor art. 220.
Diminuarea pachetului de servicii de bază are loc după 3 luni de la ultima
plată a contribuţiei.
(4) Pentru perioada în care
angajatorii suportă indemnizaţia pentru incapacitate temporară de muncă,
aceştia au obligaţia de a plăti contribuţia de 7% raportată la fondul de
salarii, pentru salariaţii aflaţi în această situaţie.
Art. 259. - (1) Pentru beneficiarii indemnizaţiei de şomaj contribuţia se calculează şi se virează
odată cu plata drepturilor băneşti asupra cărora se calculează de către cei
care efectuează plata acestor drepturi.
(2) Pentru pensionari contribuţia datorată de aceştia
se aplică numai la veniturile din pensiile care depăşesc limita supusă
impozitului pe venit, se calculează pentru diferenţa între cuantumul pensiei şi
această limită şi se virează odată cu plata drepturilor băneşti asupra cărora
se calculează de către cei care efectuează plata
acestor drepturi.
(3) Incepând cu 1 ianuarie 2007 contribuţia pentru
veniturile din pensii se datorează şi se calculează potrivit alin. (2), precum
şi asupra sumei neimpozabile din pensii prevăzute de Legea nr. 571/2003 privind
Codul fiscal, cu modificările şi completările ulterioare. Contribuţia calculată
asupra sumei neimpozabile din pensii se suportă de bugetul de stat.
(4) Persoanele care nu sunt salariate, dar au
obligaţia să îşi asigure sănătatea potrivit prevederilor prezentei legi, sunt
obligate să comunice direct casei de asigurări alese veniturile, pe baza
contractului de asigurare, în vederea stabilirii şi achitării contribuţiei de
6,5%.
(5) Pentru lucrătorii migranţi care îşi păstrează
domiciliul sau reşedinţa în România, contribuţia lunară la fond se calculează
prin aplicarea cotei de 6,5% la veniturile obţinute din contractele încheiate
cu un angajator străin.
(6) Pentru persoanele care se asigură facultativ în
condiţiile art. 214 alin. (2), contribuţia lunară la fond se calculează prin
aplicarea cotei de 13,5% la valoarea a două salarii de bază minime brute pe
ţară, pentru un pachet de servicii stabilit prin contractul-cadru.
(7) Persoanele care au obligaţia de a se asigura şi
nu pot dovedi plata contribuţiei sunt obligate, pentru a obţine calitatea de
asigurat, să achite contribuţia legală lunară pe ultimii 5 ani, începând cu
data primei solicitări de acordare a serviciilor medicale, calculată la
salariul de bază minim brut pe ţară în vigoare la data plăţii, sau de la data
ultimei plăţi a contribuţiei, respectiv de la data când plata contribuţiei era
obligatorie dacă perioada scursă este mai mică de 5 ani, calculându-se majorări
de întârziere.
(8) In situaţia în care persoanele prevăzute la alin.
(7) au realizat venituri impozabile, contribuţia, precum şi majorările de
întârziere aferente se vor calcula asupra acestor venituri pe perioada în care
acestea au fost realizate, cu respectarea termenelor de prescripţie privind
obligaţiile fiscale.
(9) Persoanele care au obligaţia să se asigure,
altele decât cele prevăzute la alin. (7) şi art. 257 şi care nu se încadrează
în categoriile de persoane care beneficiază de asigurarea de sănătate fără
plata contribuţiei, plătesc contribuţia lunară de asigurări sociale de sănătate
calculată prin aplicarea cotei de 6,5% la salariul de bază minim brut pe ţară.
(10) Străinii cărora li s-a acordat una dintre formele
de protecţie prevăzute la art. 1 lit. a), b) şi c) din Ordonanţa Guvernului nr.
102/2000 privind statutul şi regimul refugiaţilor în România, republicată, sunt
obligaţi, pentru a obţine calitatea de asigurat, să plătească contribuţia
legală începând cu data obţinerii respectivei forme de protecţie.
(11) Străinii cărora li s-a acordat, anterior
intrării în vigoare a legislaţiei privind integrarea socială a străinilor care
au dobândit o formă de protecţie în România, una dintre formele de protecţie
prevăzute la art. 1 lit. a), b) şi c) din Ordonanţa Guvernului nr. 102/2000,
republicată, sunt obligaţi, pentru a obţine calitatea de asigurat, să plătească
contribuţia legală începând cu data intrării în vigoare a legislaţiei privind
integrarea socială a străinilor care au dobândit o formă de protecţie în
România.
Art. 260. - (1) Contribuţia datorată pentru persoanele
prevăzute la art. 213 se suportă după cum urmează:
a) de către bugetul de stat, pentru persoanele
prevăzute la art. 213 alin. (2) lit. a), c), d), f) şi i), iar pentru
persoanele prevăzute la art. 213 alin. (2) lit. h) începând cu 1 ianuarie 2007;
b) de către bugetul asigurărilor sociale de stat,
pentru persoanele prevăzute la art. 213 alin. (2) lit. b);
c) de către bugetul asigurărilor de şomaj, pentru
persoanele prevăzute la art. 213 alin. (2) lit. e);
d) de către bugetele locale, pentru persoanele
prevăzute la art. 213 alin. (2) lit. g).
(2) Contribuţiile pentru persoanele prevăzute la art.
213 alin. (2) lit. a), c), d), f) şi i) se stabilesc prin aplicarea cotei de
6,5% asupra sumei reprezentând valoarea a două salarii de bază minime brute pe
ţară.
(3) Contribuţiile pentru persoanele prevăzute la art.
213 alin. (2) lit. b) şi e) se stabilesc prin aplicarea cotei de 6,5% asupra indemnizaţiei pentru
incapacitate de muncă datorată unui accident de muncă sau unei boli
profesionale, respectiv asupra indemnizaţiei de şomaj.
(4) Contribuţiile pentru
persoanele prevăzute la art. 213 alin. (2) lit. g) se stabilesc prin aplicarea
cotei de 6,5% asupra ajutorului social acordat, în condiţiile legii, pentru
asigurarea venitului minim garantat.
Art. 261. - (1) Angajatorii şi asiguraţii care au
obligaţia plăţii contribuţiei în condiţiile prezentei legi şi care nu o
respectă datorează pentru perioada de întârziere majorări de întârziere în
condiţiile Codului de procedură fiscală.
(2) CNAS aprobă norme privind desfăşurarea
activităţii de executare silită a creanţelor datorate fondului de către
persoanele fizice, altele decât cele pentru care colectarea veniturilor se face
de ANAF.
(3) Angajatorii, indiferent de forma de proprietate,
vor depune la bancă sau la trezorerie, după caz, odată cu documentaţia pentru
plata salariilor şi a altor venituri pentru salariaţi, documentele pentru plata
contribuţiilor datorate fondului, plăţile efectuându-se simultan sub control
bancar, respectiv trezorerie.
(4) In cazul neachitării în termen a contribuţiilor
datorate fondului, aplicarea măsurilor de executare silită pentru încasarea
sumelor datorate şi a majorărilor de întârziere se realizează potrivit
procedurilor instituite de Legea nr. 571/2003, cu modificările şi completările
ulterioare, şi Ordonanţa Guvernului nr. 92/2003, republicată, cu modificările
şi completările ulterioare, şi normelor aprobate prin ordin al preşedintelui
CNAS, cu avizul consiliului de administraţie.
(5) Persoanele prevăzute la art. 257 şi 258 au
obligaţia de a pune la dispoziţia organelor de control ale ANAF sau ale caselor
de asigurări, după caz, documentele justificative şi actele de evidenţă
necesare în vederea stabilirii obligaţiilor la fond.
SECŢIUNEA a 2-a
Utilizarea şi administrarea Fondului naţional
unic de asigurări sociale de sănătate
Art. 262. - (1) Veniturile fondului se utilizează
pentru:
a) plata serviciilor medicale, medicamentelor,
materialelor sanitare şi dispozitivelor medicale, inclusiv a celor acordate în
baza documentelor internaţionale cu prevederi în domeniul sănătăţii la care
România este parte, în condiţiile stabilite prin contractul-cadru; în valoarea
serviciilor medicale se poate include şi amortizarea bunurilor achiziţionate de
unităţile sanitare publice supuse amortizării potrivit legii, conform normelor
elaborate de Ministerul Sănătăţii Publice şi Ministerul Finanţelor Publice;
b) cheltuieli de administrare, funcţionare şi de
capital în limita a maximum 3% din sumele colectate;
c) fondul de rezervă în cotă de 1% din sumele
constituite anual la nivelul CNAS.
(2) Veniturile fondului se utilizează şi pentru plata
indemnizaţiilor de asigurări sociale de sănătate în condiţiile legii.
Art. 263. - (1) Veniturile fondului nu pot fi utilizate
pentru:
a) investiţii pentru construirea şi consolidarea de
unităţi sanitare;
b) achiziţionarea aparaturii medicale de la nivelul
şi condiţiile stabilite prin hotărâre a Guvernului;
c) măsuri profilactice şi tratamente instituite
obligatoriu prin norme legale, altele decât cele prevăzute de prezenta lege.
(2) Cheltuielile prevăzute la
alin. (1) se suportă de la bugetul de stat.
Art. 264. - (1) Bugetul fondului se aprobă de
Parlament, la propunerea Guvernului, ca anexă la legea bugetului de stat.
(2) Bugetele de venituri şi cheltuieli ale caselor de
asigurări se aprobă de ordonatorul principal de credite, în condiţiile legii.
Art. 265. - (1) Sumele rămase neutilizate la nivelul
caselor de asigurări la sfârşitul fiecărui an se virează în contul CNAS.
(2) Sumele rămase la nivelul CNAS la sfârşitul anului
se reportează în anul următor si se utilizează potrivit art. 262 alin. (1) lit.
a) şi b).
(3) Fondul de rezervă rămas neutilizat la finele
anului se reportează în anul următor cu aceeaşi destinaţie.
(4) Utilizarea fondului de rezervă se stabileşte prin
legile bugetare anuale.
(5) Disponibilităţile temporare ale fondului, precum
şi disponibilităţile fondului de rezervă se păstrează la trezoreria statului şi
sunt purtătoare de dobândă.
(6) Din disponibilităţile fondului de rezervă şi din
excedentele înregistrate de fond din anii precedenţi pot fi constituite
depozite la termen la trezoreria statului, în condiţiile stabilite prin
convenţie încheiată între CNAS şi Ministerul Finanţelor Publice.
CAPITOLUL VI
Organizarea caselor de asigurări de sănătate
SECŢIUNEA 1
Constituirea caselor de asigurări de sănătate şi
organizarea administrativă
Art. 266. - (1) CNAS este instituţie publică, autonomă,
de interes naţional, cu personalitate juridică, care administrează şi
gestionează sistemul de asigurări sociale de sănătate în vederea aplicării
politicilor şi programelor Guvernului în domeniul sanitar şi are sediul în
municipiul Bucureşti, Calea Călăraşilor nr. 248, sectorul 3.
(2) CNAS are ca principal obiect de activitate
asigurarea funcţionării unitare şi coordonate a sistemului de asigurări sociale
de sănătate din România şi are în subordine casele de asigurări de sănătate
judeţene şi Casa de Asigurări de Sănătate a Municipiului Bucureşti.
(3) CNAS funcţionează pe baza statutului propriu,
avizat de consiliul de administraţie şi aprobat prin hotărâre a Guvernului.
Casele de asigurări funcţionează pe baza statutului propriu, care respectă
prevederile statutului-cadru, aprobat de Consiliul de administraţie al CNAS.
(4) Statutele prevăzute la alin. (3) trebuie să
conţină prevederi referitoare la:
a) denumirea şi sediul casei de asigurări respective;
b) relaţiile CNAS cu alte case de asigurări şi cu
oficiile teritoriale, precum şi cu asiguraţii;
c) structura, drepturile şi obligaţiile organelor de
conducere;
d) modul de adoptare a
hotărârilor în consiliul de administraţie şi relaţia dintre acesta şi
conducerea executivă a casei de asigurări;
e) alte prevederi.
Art. 267. - (1) Casele de asigurări sunt instituţii
publice, cu personalitate juridică, cu bugete proprii,
în subordinea CNAS.
(2) Casele de asigurări colectează contribuţiile
persoanelor fizice, altele decât cele pentru care colectarea veniturilor se
face de către ANAF, şi gestionează bugetul fondului aprobat, cu respectarea
prevederilor prezentei legi, asigurând funcţionarea sistemului de asigurări
sociale de sănătate la nivel local, şi pot derula şi dezvolta şi activităţi
pentru valorizarea fondurilor gestionate.
Art. 268. - Pe lângă CNAS funcţionează experţi pentru
implementarea programelor naţionale de sănătate curative, finanţate din fond,
precum şi alte activităţi stabilite prin ordin al preşedintelui CNAS.
Art. 269. - Casele de asigurări pot înfiinţa oficii de
asigurări de sănătate fără personalitate juridică, la nivelul oraşelor, al
municipiilor, respectiv al sectoarelor municipiului Bucureşti, în baza
criteriilor stabilite prin ordin al preşedintelui CNAS.
SECŢIUNEA a 2-a
Atribuţiile caselor de asigurări de sănătate
Art. 270. - (1) Atribuţiile CNAS sunt următoarele:
a) gestionează fondul prin preşedintele CNAS, împreună
cu casele de asigurări;
b) elaborează, implementează şi gestionează
procedurile şi formularele unitare, avizate de Ministerul Sănătăţii Publice,
pentru administrarea sistemului de asigurări sociale de sănătate;
c) elaborează şi actualizează Registrul unic de
evidenţă a asiguraţilor;
d) elaborează şi publică raportul anual şi planul de
activitate pentru anul următor;
e) îndrumă metodologic şi controlează modul de
aplicare a dispoziţiilor legale de către casele de asigurări;
f) răspunde pentru activităţile proprii sistemului de
asigurări sociale de sănătate în faţa Guvernului şi faţă de asiguraţi;
g) elaborează proiectul contractului-cadru, care se
prezintă de către Ministerul Sănătăţii Publice spre aprobare Guvernului;
h) elaborează condiţiile
privind acordarea asistenţei medicale din cadrul sistemului de asigurări
sociale de sănătate, cu consultarea CMR şi CMDR;
i) participă anual la elaborarea listei de medicamente
eliberate cu sau fără contribuţie personală, pe baza prescripţiilor medicale, pentru persoanele asigurate;
j) administrează şi întreţine bunurile imobile şi baza
materială din patrimoniu, în condiţiile legii;
k) asigură organizarea sistemului informatic şi
informaţional unic integrat pentru înregistrarea asiguraţilor şi pentru
gestionarea şi administrarea fondului. Indicatorii folosiţi în raportarea
datelor în sistemul de asigurări de sănătate sunt unitari şi se stabilesc de
către Ministerul Sănătăţii Publice, la propunerea CNAS, CMR şi CMDR;
l) negociază şi contractează cu
instituţii abilitate de lege colectarea şi prelucrarea datelor privind unele
servicii medicale furnizate asiguraţilor, în vederea contractării şi decontării
acestora de către casele de asigurări;
m) acordă gratuit informaţii, consultanţă şi asistenţă
în domeniul asigurărilor sociale de sănătate persoanelor asigurate,
angajatorilor şi furnizorilor de servicii medicale;
n) participă ia licitaţii naţionale organizate de
Ministerul Sănătăţii Publice pentru achiziţia de medicamente şi materiale
specifice pentru realizarea programelor de sănătate;
o) încheie şi derulează contracte de achiziţii publice
pentru medicamente şi materiale sanitare pentru derularea programelor de
sănătate, precum şi contracte de furnizare de servicii medicale de dializă;
p) asigură logistica şi baza materială necesare
activităţii de pregătire şi formare profesională a personalului, din
cheltuielile de administrare a fondului;
r) iniţiază, negociază şi încheie cu instituţii
similare documente de cooperare internaţională în domeniul său de activitate;
s) îndeplineşte funcţia de organism de legătură, care
asigură comunicarea cu organismele similare din statele care au încheiat cu
România documente internaţionale cu prevederi în domeniul sănătăţii;
t) prezintă un raport anual Guvernului privind starea
sistemului de asigurări sociale de sănătate;
u) prezintă rapoarte Parlamentului, la solicitarea
acestuia;
v) alte atribuţii prevăzute de acte normative în
domeniul sănătăţii.
(2) Realizarea atribuţiilor care revin CNAS, potrivit
prezentei legi, este supusă controlului organelor competente potrivit
dispoziţiilor legale în vigoare.
Art. 271. - Atribuţiile caselor de asigurări sunt
următoarele:
a) să colecteze contribuţiile la fond pentru
persoanele fizice, altele decât cele pentru care colectarea veniturilor se face
de către ANAF;
b) să administreze bugetele proprii;
c) să înregistreze, să actualizeze datele referitoare
la asiguraţi şi să le comunice CNAS;
d) să elaboreze şi să publice raportul anual şi planul
de activitate pentru anul următor;
e) să utilizeze toate demersurile legale pentru a
optimiza colectarea contribuţiilor şi recuperarea creanţelor restante la
contribuţii pentru fond;
f) să furnizeze gratuit informaţii, consultanţă,
asistenţă în problemele asigurărilor sociale de sănătate şi ale serviciilor
medicale persoanelor asigurate, angajatorilor şi furnizorilor de servicii
medicale;
g) să administreze bunurile casei de asigurări,
conform prevederilor legale;
h) să negocieze, să contracteze şi să deconteze
serviciile medicale contractate cu furnizorii de servicii medicale în
condiţiile contractului-cadru;
i) să monitorizeze numărul serviciilor medicale
furnizate şi nivelul tarifelor acestora;
j) pot să organizeze licitaţii în vederea contractării
unor servicii din pachetul de servicii, pe baza
prevederilor contractului-cadru;
k) să asigure, în calitate de instituţii competente,
activităţile de aplicare a documentelor internaţionale cu prevederi în domeniul
sănătăţii încheiate de România cu alte state, inclusiv cele privind rambursarea
cheltuielilor ocazionate de acordarea serviciilor medicale şi a altor
prestaţii, în condiţiile respectivelor documente internaţionale;
l) alte atribuţii prevăzute de
acte normative în domeniul sănătăţii.
SECŢIUNEA a 3-a
Organele de conducere
Art. 272. - (1) CNAS are
următoarele organe de conducere:
a) adunarea reprezentanţilor;
b) consiliul de administraţie;
c) preşedintele;
d) comitetul director;
e) 2 vicepreşedinţi;
f) directorul general.
(2) Persoanele care fac parte din organele de conducere ale CNAS şi ale caselor de asigurări trebuie să
îndeplinească următoarele condiţii:
a) să fie cetăţeni români şi să aibă domiciliul pe
teritoriul României;
b) să aibă calitatea de asigurat;
c) să nu aibă cazier judiciar sau fiscal;
d) să aibă studii superioare.
(3) Membrii consiliului de administraţie au obligaţia
de a depune declaraţie de avere şi o declaraţie de interese cu privire la
incompatibilitătile prevăzute de prezenta lege, în termen de 15 zile de la
numirea în Consiliul de administraţie al CNAS. Declaraţia de interese va fi
actualizată ori de câte ori intervin modificări. Actualizarea se face în termen
de 30 de zile de la data modificării respective. Declaraţiile se vor afişa pe
site-ul CNAS.
Modelul declaraţiei de interese se aprobă prin ordin al
preşedintelui CNAS.
Art. 273. - (1) Adunarea reprezentanţilor se constituie
pe o perioadă de 4 ani şi cuprinde:
a) reprezentanţi ai asiguraţilor delegaţi de
consiliile judeţene şi de Consiliul General al Municipiului Bucureşti, în număr
de unu pentru fiecare judeţ şi doi pentru municipiul Bucureşti. Desemnarea
acestor reprezentanţi se face în termen de 15 zile de la data intrării în
vigoare a prezentei legi;
b) 31 de membri numiţi astfel: 2 de către Preşedintele
României, 3 de către primul-ministru, la propunerea ministrului sănătăţii
publice, 3 de către Senat, la propunerea comisiei de specialitate, 3 de către
Camera Deputaţilor, la propunerea comisiei de specialitate, un reprezentant al
Ministerului Muncii, Solidarităţii Sociale şi Familiei, un reprezentant al
Casei Naţionale de Pensii şi Alte Drepturi de Asigurări Sociale, 5 de către
asociaţiile patronale reprezentative la nivel naţional, 5 de către
organizaţiile sindicale reprezentative la nivel naţional, 7 reprezentanţi ai
ministerelor şi instituţiilor centrale cu reţele sanitare proprii, respectiv
câte un reprezentant al Ministerului Administraţiei şi Internelor, Ministerului
Apărării Naţionale, Ministerului Justiţiei, Ministerului Transporturilor,
Construcţiilor şi Turismului, Serviciului Român de Informaţii, Serviciului de
Informaţii Externe şi Serviciului de Telecomunicaţii Speciale, şi un
reprezentant al Consiliului Naţional al Persoanelor Vârstnice.
(2) Sunt reprezentative la nivel naţional asociaţiile
patronale şi organizaţiile sindicale care îndeplinesc condiţiile prevăzute de
Legea nr. 130/1996 privind contractul colectiv de muncă, republicată, cu
modificările şi completările ulterioare.
(3) Pe locurile devenite vacante ca urmare a
demisiei, revocării din cauze prevăzute de lege sau a decesului se numesc noi
membri, aleşi în aceleaşi condiţii, până la expirarea mandatului în curs.
Art. 274. - (1) Adunarea reprezentanţilor se întruneşte
în şedinţă o dată pe an, la convocarea consiliului de administraţie, sau în
şedinţe extraordinare, la convocarea preşedintelui CNAS, a consiliului de
administraţie sau a unui număr de cel puţin 30 de membri ai adunării
reprezentanţilor.
(2) Adunarea reprezentanţilor poate adopta hotărâri
dacă sunt prezente două treimi din numărul membrilor. Pentru adoptarea
hotărârilor este necesar votul favorabil al majorităţii membrilor prezenţi.
Art. 275. - Adunarea reprezentanţilor are următoarele
atribuţii:
a) propune modificarea Statutului CNAS;
b) analizează repartizarea bugetului aprobat de către
cei în drept şi recomandă ordonatorului principal de credite luarea măsurilor
necesare pentru modificarea acestuia, în condiţiile legii;
c) analizează modul de utilizare a fondului, costurile
din cadrul sistemului de asigurări sociale de sănătate, serviciile medicale
acordate şi tarifele practicate la contractarea pachetului de servicii de bază
şi recomandă măsurile legale pentru folosirea cu eficienţă a fondurilor şi de
respectare a drepturilor asiguraţilor.
Art. 276. - (1) Consiliul de administraţie al CNAS se
constituie din 17 membri, cu un mandat pe 4 ani, după cum urmează:
a) 5 reprezentanţi ai statului, dintre care unul este
numit de Preşedintele României şi 4 de primul-ministru, la propunerea
ministrului sănătăţii publice, a ministrului muncii, solidarităţii sociale şi
familiei, a ministrului finanţelor publice şi a ministrului justiţiei;
b) 5 membri numiţi prin consens de către
confederaţiile patronale reprezentative la nivel naţional;
c) 5 membri numiţi prin consens de către
confederaţiile sindicale reprezentative la nivel naţional;
d) 2 membri numiţi de primul-ministru, cu consultarea
Consiliului Naţional al Persoanelor Vârstnice.
(2) Prevederile art. 273 alin. (3) se aplică şi în
cazul consiliului de administraţie.
Art. 277. - (1) Preşedintele consiliului de
administraţie este preşedintele CNAS şi are rang de secretar de stat.
Preşedintele CNAS are dreptul la organizarea cabinetului demnitarului în
structura CNAS şi în limita numărului de posturi prevăzut de lege pentru
funcţia de secretar de stat. Preşedintele CNAS este numit de primul-ministru
dintre membrii consiliului de administraţie, la propunerea ministrului
sănătăţii.
(2) Consiliul de administraţie are 2 vicepreşedinţi
aleşi de consiliul de administraţie prin vot secret, unul din partea confederaţiilor
patronale reprezentative la nivel naţional şi celălalt din partea
confederaţiilor sindicale reprezentative la nivel naţional, stabilite potrivit
legii. Vicepreşedinţii consiliului de administraţie sunt şi vicepreşedinţii
CNAS.
(3) Preşedintele, vicepreşedinţii şi directorul
general al CNAS se suspendă de drept din funcţiile deţinute anterior, pe
perioada executării mandatului, cu excepţia celor prevăzute la art. 282 alin.
(1).
Art. 278. - (1) Consiliul de administraţie funcţionează
în mod legal în prezenţa a cel puţin 13 membri.
(2) Hotărârile consiliului de administraţie se adoptă
cu votul a cel puţin două treimi din numărul membrilor prezenţi.
(3) In condiţiile în care la prima convocare a unei
şedinţe a consiliului de administraţie nu se îndeplineşte cvorumul prevăzut la
alin. (1), preşedintele CNAS, în calitate de preşedinte al consiliului de
administraţie, are dreptul să convoace o nouă şedinţă în termen de maximum 7
zile, în cadrul căreia hotărârile sunt luate cu votul a cel puţin două treimi
din numărul membrilor prezenţi.
(4) Principalul rol al consiliului de administraţie
este de a elabora şi a realiza strategia naţională în domeniul asigurărilor
sociale de sănătate.
(5) La şedinţele consiliului de administraţie
preşedintele CNAS poate invita persoane care au legătură cu subiectele supuse
dezbaterii.
Art. 279. - (1) Consiliul de administraţie al CNAS are
următoarele atribuţii:
a) aprobă planul anual de activitate pentru
îndeplinirea prevederilor programului de asigurări sociale de sănătate;
b) aprobă regulamentul de organizare şi funcţionare a
comisiilor de evaluare şi standardele de evaluare a furnizorilor de servicii
medicale;
c) aprobă criteriile de recrutare şi modalităţile de
formare a personalului din sistemul de asigurări sociale de sănătate;
d) aprobă programul de investiţii;
e) aprobă încheierea de convenţii de cooperare şi
finanţare de programe cu organisme internaţionale;
f) aprobă atribuţiile vicepreşedinţilor, la
propunerea preşedintelui;
g) avizează statutul propriu al CNAS, care se aprobă
prin hotărâre a Guvernului, şi aprobă statutul-cadru al caselor de asigurări la
propunerea Comitetului director;
h) aprobă propriul regulament de organizare şi
funcţionare;
i) aprobă strategia sistemului de asigurări sociale de
sănătate cu privire la colectarea şi utilizarea fondului;
j) aprobă proiectul bugetului fondului şi îl supune
aprobării ordonatorului principal de credite, în condiţiile legii;
k) avizează, în condiţiile legii, repartizarea pe case
de asigurări a bugetului fondului;
l) avizează utilizarea fondului
de rezervă;
m) analizează semestrial stadiul derulării contractelor
şi împrumuturilor;
n) avizează rapoartele de gestiune anuale, prezentate
de preşedintele CNAS, contul de încheiere a exerciţiului bugetar, precum şi
raportul anual de activitate;
o) aprobă, în baza raportului Curţii de Conturi,
bilanţul contabil şi descărcarea gestiunii anului precedent pentru CNAS şi
pentru casele de asigurări;
p) avizează proiectul contractului-cadru şi al normelor
metodologice de aplicare a acestuia;
r) avizează lista medicamentelor de care beneficiază
asiguraţii cu sau fără contribuţie personală;
s) aprobă criteriile privind calitatea asistenţei
medicale acordate asiguraţilor;
t) analizează structura şi modul de funcţionare ale
caselor de asigurări;
u) avizează organigrama CNAS şi organigramele caselor
de asigurări teritoriale, la propunerea Comitetului director; organigramele
care se aprobă prin ordin al preşedintelui CNAS;
v) alte atribuţii acordate prin acte normative în vigoare.
(2) Consiliul de administraţie se întruneşte lunar,
la convocarea preşedintelui CNAS. Consiliul de administraţie se poate întruni
şi în şedinţe extraordinare, la cererea preşedintelui sau a cel puţin unei
treimi din numărul membrilor săi.
(3) In exercitarea
atribuţiilor ce îi revin Consiliul de administraţie al CNAS adoptă hotărâri, în
condiţiile prevăzute la art. 278.
(4) Modul de rezolvare a divergenţelor dintre
preşedintele CNAS şi consiliul de administraţie, în îndeplinirea atribuţiilor
stabilite în prezenta lege, se reglementează prin statutul CNAS.
Art. 280. - (1) Preşedintele CNAS este ordonator
principal de credite pentru administrarea şi gestionarea fondului şi reprezintă
CNAS în relaţiile cu terţii şi pe asiguraţi în raporturile cu alte persoane
fizice sau juridice, componente ale sistemului asigurărilor sociale de
sănătate.
(2) Preşedintelui CNAS îi sunt aplicabile prevederile
legii responsabilităţii ministeriale.
Art. 281. - (1) Atribuţiile principale ale
preşedintelui CNAS sunt următoarele:
a) exercită atribuţiile prevăzute de lege, în
calitate de ordonator principal de credite, pentru administrarea şi gestionarea
fondului;
b) organizează şi coordonează activitatea de audit şi
control în sistemul de asigurări sociale de sănătate, potrivit atribuţiilor
specifice ale CNAS şi ale caselor de asigurări; activitatea de audit se poate
desfăşura la nivel regional, în condiţiile stabilite prin ordin al
preşedintelui CNAS, cu avizul Consiliului de administraţie al CNAS;
c) participă ca invitat la şedinţele Guvernului în
care sunt dezbătute aspecte referitoare la sănătatea populaţiei;
d) numeşte, sancţionează şi eliberează din funcţie
personalul CNAS;
e) prezidează şedinţele adunării reprezentanţilor;
f) alte atribuţii stabilite prin Statutul CNAS.
(2) In exercitarea atribuţiilor ce îi revin, precum şi
pentru punerea în aplicare a hotărârilor consiliului de administraţie,
preşedintele CNAS emite ordine care devin executorii după ce sunt aduse la
cunoştinţă persoanelor interesate. Ordinele cu caracter normativ, emise în
aplicarea prezentei legi, se publică în Monitorul Oficial al României, Partea I.
Art. 282. - (1) Pe timpul executării mandatului
preşedintele şi vicepreşedinţii sunt numiţi pe o perioadă de 4 ani. Aceştia nu
pot exercita pe durata mandatului nici o altă funcţie sau demnitate publică, cu excepţia funcţiilor
didactice din învăţământul superior.
(2) Membrii Consiliului de administraţie al CNAS, pe
perioada exercitării mandatului, nu sunt salariaţi ai CNAS, cu excepţia
preşedintelui şi a vicepreşedinţilor, şi nu pot ocupa funcţii în structurile
executive ale caselor de asigurări. Aceştia nu pot exercita activităţi la
societăţi comerciale sau la alte unităţi care se află în relaţii contractuale
cu casele de asigurări.
(3) Salarizarea preşedintelui
şi a vicepreşedinţilor CNAS se stabileşte după cum urmează:
a) pentru preşedinte, la nivelul indemnizaţiei
prevăzute de lege pentru funcţia de secretar de stat;
b) pentru vicepreşedinţi, la nivelul indemnizaţiei
prevăzute de lege pentru funcţia de subsecretar de stat.
(4) Salariul şi celelalte drepturi de personal ale
directorului general al CNAS se stabilesc la nivelul corespunzător prevăzut de
lege pentru funcţia de secretar general din minister.
(5) Membrii Consiliului de administraţie
al CNAS, cu excepţia preşedintelui şi vicepreşedinţilor, beneficiază de o
indemnizaţie lunară de până la 20% din indemnizaţia preşedintelui CNAS, în
condiţiile prezenţei efective la şedinţele consiliului de administraţie.
Art. 283. - (1) Conducerea
executivă a CNAS este asigurată de către directorul general.
(2) Ocuparea postului de director general se face
prin concurs, pe o perioadă de 4 ani, şi se numeşte prin ordin al preşedintelui
CNAS.
(3) Organizarea concursului şi criteriile de selecţie
sunt stabilite de preşedintele CNAS, cu avizul consiliului de administraţie.
Art. 284. - Conducerea operativă a CNAS este asigurată
de un Comitet director alcătuit din: preşedinte, vicepreşedinţi, director
general şi directorii generali adjuncţi. Atribuţiile Comitetului director de
conducere al CNAS se aprobă prin ordin al preşedintelui CNAS, cu avizul
consiliului de administraţie.
Art. 285. - (1) Personalul CNAS şi al caselor de
asigurări este constituit din funcţionari publici şi personal contractual, în
condiţiile legii, şi nu pot desfăşura activităţi la furnizorii de servicii
medicale.
(2) Salariul şi celelalte drepturi ale personalului
prevăzut la alin. (1) sunt cele stabilite de actele normative în vigoare
aplicabile instituţiilor publice.
(3) Personalului CNAS şi al
caselor de asigurări îi pot fi acordate stimulente din fondul constituit cu
această destinaţie, în cotă de 5% din sumele încasate la bugetul fondului prin
executare silită desfăşurată de către casele de asigurări şi 2,5% din sumele
încasate la bugetul fondului prin executare silită de către ANAF. Modalitatea
de constituire şi utilizare a acestui fond se aprobă prin ordin al
preşedintelui CNAS.
Art. 286. - Organele de conducere ale caselor de
asigurări sunt consiliul de administraţie şi preşedintele-director general.
Art. 287. - (1) Consiliul de administraţie al caselor
de asigurări de sănătate judeţene şi a municipiului Bucureşti este alcătuit din
11 membri, desemnaţi după cum urmează:
a) unul de consiliul judeţean, respectiv de Consiliul
General al Municipiului Bucureşti;
b) unul de prefect, la propunerea autorităţii de
sănătate publică judeţene, respectiv a municipiului Bucureşti;
c) 3 de confederaţiile patronale reprezentative la
nivel naţional, desemnaţi prin consens;
d) 3 de confederaţiile
sindicale reprezentative la nivel naţional, desemnaţi prin consens;
e) 2 de consiliile judeţene ale persoanelor
vârstnice, respectiv al municipiului Bucureşti;
f) preşedintele, care este directorul general al casei
de asigurări.
(2) Mandatul membrilor
consiliilor de administraţie ale caselor de asigurări este de 4 ani. Membrii
consiliilor de administraţie ale caselor de asigurări beneficiază de o
indemnizaţie lunară de până la 20% din salariul funcţiei de director general al
casei de asigurări respective, în condiţiile prezenţei efective la şedinţele
consiliului de administraţie.
(3) Pe perioada mandatului membrii consiliului de
administraţie pot fi revocaţi din funcţii de către cei care i-au numit, iar pe
funcţiile rămase vacante sunt numiţi noi membri, până la expirarea mandatului
în curs.
(4) Consiliile de administraţie ale caselor de
asigurări au următoarele atribuţii generale:
a) aprobă proiectul statutului propriu;
b) avizează proiectul bugetului de venituri şi cheltuieli
anuale aferente Fondului naţional unic de asigurări sociale de sănătate;
c) aprobă rapoartele de gestiune semestriale şi
anuale, prezentate de preşedintele-director general;
d) avizează politica de contractare propusă de
preşedintele-director general, cu respectarea
contractului-cadru;
e) avizează programele de acţiuni de îmbunătăţire a
disciplinei financiare, inclusiv măsurile de executare silită potrivit
prevederilor legale în vigoare;
f) alte atribuţii date prin lege sau prin statut.
(5) Consiliul de administraţie
ia hotărâri prin vot, în prezenţa a cel puţin două treimi din numărul
membrilor.
(6) Şedinţele consiliului de administraţie sunt
publice, cu excepţia cazurilor în care membrii consiliului decid prin vot ca
acestea să se desfăşoare cu uşile închise. Problemele legate de buget se vor
discuta întotdeauna în şedinţe publice.
Art. 288. - (1) Directorii generali ai caselor de
asigurări sunt numiţi pe bază de concurs, prin ordin al preşedintelui CNAS.
Directorul general devine membru de drept al consiliului de administraţie al
casei de asigurări şi preşedintele acestuia. Intre CNAS şi directorul general
al casei de asigurări - manager al sistemului la nivel local se încheie un
contract de management.
(2) Directorul general al casei de asigurări este
ordonator de credite, în condiţiile legii.
(3) Directorul general se numeşte pentru un mandat de
4 ani, după validarea concursului, şi se suspendă de drept din funcţiile
deţinute anterior, cu excepţia funcţiilor didactice din învăţământul superior.
Directorul general are obligaţia de a depune declaraţie de interese şi
declaraţie de avere. Modelul declaraţiei de interese se aprobă prin ordin al
preşedintelui CNAS.
(4) Salarizarea şi celelalte drepturi ale
directorului general se stabilesc prin contractul de
management.
(5) Atribuţiile principale ale directorului general
sunt următoarele:
a) aplică normele de gestiune, regulamentele de
organizare şi de funcţionare şi procedurile administrative unitare;
b) organizează şi coordonează activitatea de control
al execuţiei contractelor de furnizare de servicii medicale;
c) organizează şi coordonează activitatea de urmărire
şi control al colectării contribuţiilor la fond;
d) propune programe de acţiuni de îmbunătăţire a
disciplinei financiare, inclusiv executarea silită, potrivit legii;
e) stabileşte modalitatea de contractare, cu
respectarea contractului-cadru;
f) organizează împreună cu alte structuri abilitate
controale privind respectarea drepturilor asiguraţilor şi propune măsuri în caz
de nerespectare a acestora;
g) supraveghează şi controlează organizarea şi
funcţionarea sistemului de asigurări de sănătate la nivel teritorial şi
prezintă anual rapoarte, pe care le dă publicităţii;
h) numeşte, sancţionează şi eliberează din funcţie
personalul casei de asigurări.
SECŢIUNEA a 4-a
Serviciul medical
Art. 289. - (1) In cadrul CNAS funcţionează serviciul
medical, care este condus de un medic-şef.
(2) La nivelul caselor de asigurări funcţionează un
serviciu medical, dimensionat în raport cu numărul asiguraţilor, care este
condus de un medic-şef.
(3) Funcţia de medic-şef al CNAS şi al caselor de
asigurări se ocupă prin concurs organizat de CNAS, în condiţiile legii.
(4) Funcţia de medic-şef al CNAS este echivalentă cu
cea de director general adjunct şi este salarizată potrivit legii.
Art. 290. - (1) Serviciul medical al CNAS urmăreşte
interesele asiguraţilor cu privire la calitatea serviciilor acordate de către
furnizorii de servicii medicale, medicamente şi dispozitive medicale aflaţi în
relaţii contractuale cu casele de asigurări.
(2) Atribuţiile serviciului medical sunt stabilite prin
statut.
SECŢIUNEA a 5-a
Obligaţiile caselor de asigurări
Art. 291. - Obligaţiile CNAS sunt următoarele:
a) să asigure logistica funcţionării unitare şi
coordonate a sistemului asigurărilor sociale de sănătate;
b) să urmărească colectarea şi folosirea cu eficienţă
a fondului;
c) să folosească mijloace adecvate de mediatizare
pentru reprezentarea, informarea şi susţinerea intereselor asiguraţilor pe care
îi reprezintă;
d) să acopere potrivit principiilor prezentei legi
nevoile de servicii de sănătate ale persoanelor, în limita fondurilor
disponibile.
Art. 292. - Obligaţiile caselor de asigurări sunt
următoarele:
a) să verifice acordarea serviciilor medicale, conform contractelor încheiate cu furnizorii de servicii medicale;
b) să deconteze furnizorilor contravaloarea
serviciilor medicale contractate şi prestate asiguraţilor, la termenele
prevăzute în contractul-cadru, în caz contrar urmând să suporte penalităţile
prevăzute în contract;
c) să acorde furnizorilor de servicii medicale sume
care să ţină seama şi de condiţiile de desfăşurare a activităţii în zone
izolate, în condiţii grele şi foarte grele, pentru care sunt stabilite drepturi
suplimentare, potrivit legislaţiei;
d) să informeze furnizorii de servicii medicale
asupra condiţiilor de contractare şi a negocierii clauzelor contractuale;
e) să informeze furnizorii de servicii medicale
asupra condiţiilor de furnizare a serviciilor medicale şi despre orice
schimbare în modul de funcţionare şi de acordare a acestora;
f) să asigure confidenţialitatea datelor în
condiţiile prezentei legi;
g) să verifice prescrierea şi eliberarea
medicamentelor în conformitate cu reglementările în vigoare;
h) să raporteze CNAS, la termenele stabilite, datele
solicitate privind serviciile medicale furnizate, precum şi evidenţa
asiguraţilor şi a documentelor justificative utilizate;
i) să furnizeze, la solicitarea Ministerului Sănătăţii
Publice, datele de identificare a persoanelor asigurate, numai pentru bolile cu
declarare nominală obligatorie, conform legislaţiei în vigoare.
CAPITOLUL VII
Controlul
SECŢIUNEA 1
Controlul de gestiune
Art. 293. - Controlul de gestiune al CNAS şi al caselor
de asigurări se face anual de către Curtea de Conturi.
Art. 294. - Auditul intern se exercită conform legii şi
poate fi organizat la nivel regional, în condiţiile stabilite prin ordin al
preşedintelui CNAS, cu avizul consiliului de administraţie al CNAS.
SECŢIUNEA a 2-a
Controlul furnizării
serviciilor
Art. 295. - (1) CNAS şi casele de asigurări organizează
şi efectuează controlul serviciilor medicale care se acordă asiguraţilor pe
baza contractelor de furnizare de servicii încheiate, potrivit prezentei legi.
(2) In cadrul controalelor
efectuate potrivit alin. (1) pot participa şi reprezentanţi ai CMR, CMDR, CFR
şi OAMMR.
Art. 296. - Salarizarea persoanelor din structurile
menţionate la art. 295 alin. (1) este similară cu cea prevăzută de lege pentru
compartimentele de audit.
SECŢIUNEA a 3-a
Art. 297. - CNAS prezintă anual Guvernului un raport de
activitate, precum şi planul de activitate pentru anul următor.
SECŢIUNEA a 4-a
Arbitrajul
Art. 298. - (1) Litigiile dintre furnizorii de servicii
medicale sau farmaceutice şi casele de asigurări de sănătate pot fi
soluţionate, la solicitarea uneia dintre părţi, pe calea arbitrajului în
condiţiile şi procedurile dreptului comun.
(2) Comisia de arbitraj este formată din câte un arbitru
desemnat de fiecare parte şi unul desemnat de Consiliul
de conducere al Comisiei de arbitraj.
(3) In vederea asigurării activităţii de arbitraj, pe
lângă CNAS se înfiinţează şi funcţionează Comisia de arbitraj. Comisia nu are
personalitate juridică.
(4) Organizarea şi funcţionarea Comisiei de arbitraj
se stabilesc prin ordin comun al ministrului sănătăţii publice, ministrului
justiţiei şi CNAS. Comisia este condusă de un consiliu de conducere format din
reprezentanţi ai Ministerului Sănătăţii Publice, CNAS, CMR, CFR şi CMDR.
Art. 299. - (1) Arbitrii sunt desemnaţi
de către părţi, respectiv de către Consiliul de conducere al Comisiei de
arbitraj, dintr-o listă de arbitri atestaţi de Ministerul Justiţiei, pe baza
unui examen desfăşurat în condiţiile şi potrivit procedurilor stabilite
printr-un regulament aprobat prin ordinul ministrului justiţiei şi înregistrat
la Comisia de arbitraj.
(2) Pot fi arbitri persoanele care au studii
medicale, economice ori studii juridice, îndeplinesc şi celelalte condiţii
legale privind dobândirea calităţii de arbitru şi nu sunt angajaţi ai niciuneia
dintre părţile aflate în litigiu ori ai instituţiilor care au desemnat
reprezentanţi în Consiliul de conducere al Comisiei de arbitraj.
(3) Pentru activităţile desfăşurate în cadrul
Comisiei de arbitraj, arbitrii beneficiază de o indemnizaţie de şedinţă.
Indemnizaţia de şedinţă pentru arbitri este de 15%, iar pentru membrii secretariatului tehnic
este de 10% din indemnizaţia preşedintelui CNAS.
(4) Cheltuielile reprezentând indemnizaţiile de
şedinţă pentru arbitri, precum şi pentru membrii secretariatului tehnic se
suportă din sumele alocate pentru administrarea fondului.
(5) Celelalte cheltuieli rezultate din activitatea
Comisiei centrale de arbitraj se suportă de către părţile aflate în litigiu, în
condiţiile art. 298 alin. (4).
Art. 300. - (1) Regulamentul de soluţionare a cauzelor
arbitrale, aprobat prin ordin al ministrului justiţiei, se completează cu
prevederile Codului de procedură civilă.
(2) Comisia de arbitraj se va organiza în termen de
maximum 90 de zile de la data intrării în vigoare a
prezentului titlu.
CAPITOLUL VIII
Răspunderi şi sancţiuni
Art. 301. - Incălcarea prevederilor prezentei legi
atrage răspunderea materială, civilă, contravenţională sau penală, după caz.
SECŢIUNEA 1
Sancţiuni
Art. 302. - Sancţiunile pentru nerespectarea
obligaţiilor contractuale de către furnizorii de servicii medicale, medicamente
şi dispozitive medicale, cuprinse în contractele încheiate cu casele de
asigurări de sănătate, se stabilesc prin contractul-cadru.
SECŢIUNEA a 2-a
Infracţiuni
Art. 303. - Fapta persoanei care dispune utilizarea în
alte scopuri sau nevirarea la fond a contribuţiei reţinute de la asiguraţi
constituie infracţiunea de deturnare de fonduri şi se pedepseşte conform
prevederilor din Codul penal.
Art. 304. - Completarea
declaraţiei prevăzute la art. 215 alin. (2) cu date nereale, având ca efect
denaturarea evidenţelor privind asiguraţii, stadiul de cotizare sau
contribuţiile faţă de fond, constituie infracţiunea de fals intelectual şi se
pedepseşte conform prevederilor din Codul penal.
SECŢIUNEA a 3-a
Contravenţii
Art. 305. - Constituie contravenţii următoarele fapte:
a) nedepunerea la termen a declaraţiei prevăzute la
art. 215 alin. (2);
b) nevirarea contribuţiei datorate conform art. 258
alin. (1) de către persoanele fizice şi juridice angajatoare;
c) refuzul de a pune la dispoziţia organelor de
control ale ANAF şi ale caselor de asigurări a documentelor justificative şi a
actelor de evidenţă necesare în vederea stabilirii obligaţiilor la fond;
d) refuzul de a pune la
dispoziţie organelor de control ale caselor de asigurări documentele
justificative şi actele de evidenţă financiar-contabilă privind sumele
decontate din fond.
Art. 306. - Contravenţiile prevăzute la art. 305 se
sancţionează după cum urmează:
a) cele prevăzute la lit. a) si c), cu amendă de la
500 lei (RON) la 1.000 lei (RON);
b) cele prevăzute la lit. b si d), cu amendă de la
3.000 lei (RON) la 5.000 lei (RON).
Art. 307. - (1) Constatarea contravenţiilor şi
aplicarea sancţiunilor se fac de către organele de control ale ANAF şi ale
caselor de asigurări.
(2) Amenzile contravenţionale aplicate conform
prezentei legi constituie venituri la bugetul de stat.
Art. 308. - Prevederile art. 305 se completează cu
dispoziţiile Ordonanţei Guvernului nr. 2/2001 privind regimul juridic al
contravenţiilor, aprobată cu modificări şi completări prin Legea nr. 180/2002,
cu modificările şi completările ulterioare.
Art. 309. - (1) Contravenientul poate achita, pe loc sau
în termen de cel mult 48 de ore de la data încheierii
procesului-verbal ori, după caz, de la data comunicării acestuia, jumătate din
minimul amenzii prevăzute la art. 306, agentul constatator făcând menţiune
despre această posibilitate în procesul-verbal.
(2) Dispoziţiile prezentei legi referitoare la
obligaţiile faţă de fond se completează cu prevederile Legii nr. 241/2005
pentru prevenirea şi combaterea evaziunii fiscale.
CAPITOLUL IX
Dispoziţii finale
Art. 310. - (1) Membrii Consiliului de administraţie al
CNAS şi ai consiliilor de administraţie ale caselor de asigurări, precum şi
personalul angajat al acestor case de asigurări, indiferent de nivel, nu pot
deţine funcţii de conducere în cadrul Ministerului Sănătăţii Publice,
autorităţilor de sănătate publică, furnizorilor de servicii medicale din
sistemul de asigurări sociale de sănătate ale căror servicii se decontează din
fond, unităţilor sanitare, cabinetelor medicale, funcţii alese sau numite în
cadrul CMR, colegiilor judeţene ale medicilor, respectiv al municipiului
Bucureşti, în cadrul CMDR, colegiilor judeţene ale medicilor dentişti,
respectiv al municipiului Bucureşti, în cadrul CFR, colegiilor judeţene ale
farmaciştilor, respectiv al municipiului Bucureşti, organizaţiilor centrale şi
locale ale OAMMR, organizaţiilor centrale şi locale ale OBBC sau funcţii în
cadrul societăţilor comerciale cu profil de asigurări, farmaceutic sau de
aparatură medicală. Personalului din cadrul CNAS şi caselor de asigurări, cu statut
de funcţionar public, îi sunt aplicabile şi dispoziţiile Legii nr. 161/2003
privind unele măsuri pentru asigurarea transparenţei în exercitarea
demnităţilor publice, a funcţiilor publice şi în mediul de afaceri, prevenirea
şi sancţionarea corupţiei, cu modificările şi completările ulterioare.
(2) Constituie conflict de interese
deţinerea de către membrii Consiliului de administraţie al CNAS şi ai
consiliilor de administraţie ale caselor de asigurări, precum şi de către
personalul angajat al acestor case de asigurări de părţi sociale, acţiuni sau
interese la furnizori care stabilesc relaţii contractuale cu casele de
asigurări de sănătate. Această dispoziţie se aplică şi în cazul în care astfel
de părţi sociale, acţiuni sau interese sunt deţinute de către soţ, soţie,
rudele sau afinii până la gradul al IV-lea inclusiv ai persoanei în cauză.
(3) Membrii Consiliului de administraţie al CNAS şi
ai consiliilor de administraţie ale caselor de asigurări care, fie personal,
fie prin soţ, soţie, afini sau rude până la gradul al IV-lea inclusiv, au un
interes patrimonial în problema supusă dezbaterii consiliului de administraţie
nu pot participa la dezbaterile consiliului de administraţie şi nici la
adoptarea hotărârilor.
(4) Persoanele care la data intrării în vigoare a
prezentei legi se află în una dintre incompatibilităţile prevăzute la alin. (1)
vor opta pentru una dintre funcţiile ocupate în termen de 30 de zile.
Art. 311. - (1) CNAS gestionează şi administrează
bunurile mobile şi imobile dobândite, în condiţiile legii, din activităţi
proprii, subvenţii, donaţii sau din alte surse.
(2) Autorităţile publice centrale sau locale pot
transmite, în condiţiile prevăzute de lege, bunuri mobile şi imobile în
administrarea CNAS şi a caselor de asigurări.
(3) Recuperarea debitelor din contribuţii şi majorări
se poate face şi prin compensarea cu active din patrimoniul debitorilor,
evaluate de instituţii autorizate în condiţiile legii, cu condiţia ca acestea
să fie necesare funcţionării CNAS sau caselor de asigurări de sănătate.
Art. 312. - In teritoriile neacoperite cu medici sau cu
personal sanitar, ori cu unităţi farmaceutice, pentru
asigurarea serviciilor medicale şi farmaceutice, consiliile locale pot acorda
stimulente în natură şi în bani.
Art. 313. - (1) Persoanele care prin faptele lor aduc
prejudicii sau daune sănătăţii altei persoane răspund potrivit legii şi sunt
obligate să suporte cheltuielile efective ocazionate de asistenţa medicală
acordată. Sumele reprezentând cheltuielile efective vor fi recuperate de către
casele de asigurări şi constituie venituri ale fondului.
(2) Furnizorii de servicii care
acordă asistenţa medicală prevăzută la alin. (1) realizează o evidenţă
distinctă a acestor cazuri şi au obligaţia să comunice lunar casei de asigurări
cu care se află în relaţie contractuală documentele justificative care atestă
cheltuielile efective realizate.
Art. 314. - CNAS poate organiza activităţi finanţate
din venituri proprii, în condiţiile legii.
Art. 315. - Datele necesare pentru stabilirea calităţii
de asigurat vor fi transmise în mod gratuit caselor de asigurări de sănătate de
către autorităţile, instituţiile publice şi alte instituţii, pe bază de
protocol.
Art. 316. - Până la organizarea Comisiei de arbitraj
prevăzute la art. 298 şi 299, litigiile dintre furnizorii de servicii medicale,
medicamente şi dispozitive medicale şi casele de asigurări vor fi judecate de
Comisia centrală de arbitraj organizată conform Ordonanţei de urgenţă a
Guvernului nr. 150/2002 privind organizarea şi funcţionarea sistemului de
asigurări sociale de sănătate, cu modificările şi completările ulterioare.
Art. 317. - (1) In termen de 12 luni de la data
intrării în vigoare a prezentului titlu, Casa Asigurărilor de Sănătate a
Apărării, Ordinii Publice, Siguranţei Naţionale şi Autorităţii Judecătoreşti şi
Casa Asigurărilor de Sănătate a Ministerului Transporturilor, Construcţiilor şi
Turismului vor intra în proces de reorganizare în vederea privatizării.
(2) Până la data reorganizării Casa Asigurărilor de
Sănătate a Apărării, Ordinii Publice, Siguranţei Naţionale şi Autorităţii
Judecătoreşti şi Casa Asigurărilor de Sănătate a Ministerului Transporturilor,
Construcţiilor şi Turismului îşi vor desfăşura activitatea potrivit
prevederilor legale de organizare şi funcţionare a acestora, pe principiul de
funcţionare al caselor de asigurări judeţene din cadrul sistemului de asigurări
sociale de sănătate.
(3) Pe data intrării în vigoare a prezentului titlu,
se abrogă Ordonanţa de urgenţă a Guvernului nr. 150/2002 privind organizarea şi
funcţionarea sistemului de asigurări sociale de sănătate, publicată în Monitorul Oficial al României, Partea I, nr.
838 din 20 noiembrie 2002, cu modificările şi completările ulterioare, şi
Ordonanţa de urgenţă a Guvernului nr. 119/1999 privind atragerea unor sume
suplimentare la bugetul Fondului de asigurări sociale de sănătate, publicată în
Monitorul Oficial al României, Partea I, nr. 312 din 30 iunie 1999, aprobată cu modificări prin Legea nr.
593/2001, cu modificările ulterioare.
(4) Dispoziţiile cu privire la colectarea
contribuţiilor de către casele de asigurări de sănătate pentru persoanele
fizice, altele decât cele care au calitatea de asigurat, se aplică până la 1
ianuarie 2007, potrivit Ordonanţei Guvernului nr. 94/2004 privind reglementarea
unor măsuri financiare,
aprobată cu modificări şi completări prin Legea nr. 507/2004, cu modificările
ulterioare.
TITLUL IX
Cardul european şi cardul naţional de asigurări
sociale de sănătate
CAPITOLUL I
Dispoziţii generale
Art. 318. - Prezentul titlu stabileşte principiile,
cadrul general şi procedurile privind elaborarea, implementarea şi distribuirea
în România a cardului european şi a cardului naţional de asigurări sociale de
sănătate, precum şi responsabilităţile instituţiilor publice implicate în acest
proces.
Art. 319. - In înţelesul prezentului titlu, termenii şi
noţiunile folosite au următoarea semnificaţie:
a) card european de
asigurări sociale de sănătate, denumit în
continuare card european - documentul care
conferă titularului asigurat dreptul la prestaţii medicale necesare în cadrul
unei şederi temporare într-un stat membru al Uniunii
Europene;
b) card naţional de
asigurări sociale de sănătate, denumit în
continuare card naţional - documentul care dovedeşte că titularul acestuia este asigurat în
sistemul de asigurări sociale de sănătate din România;
c) case de asigurări
de sănătate - casele de asigurări de sănătate
judeţene şi a municipiului Bucureşti;
d) asigurat - persoana
asigurată conform legislaţiei în vigoare în cadrul sistemului de asigurări
sociale de sănătate din România;
e) şedere temporară - deplasarea unei persoane în unul dintre
statele membre ale Uniunii Europene pentru motive turistice, profesionale,
familiale sau pentru studii, pentru o perioadă de timp necesară deplasării, dar
nu mai mult de 6 luni.
CAPITOLUL II
Cardul european de asigurări sociale de sănătate
Art. 320. - Cardul european conţine următorul set
obligatoriu de informaţii vizibile:
a) numele şi prenumele asiguratului;
b) codul numeric personal al asiguratului;
c) data naşterii asiguratului;
d) data expirării cardului;
e) codul Organizaţiei
Internaţionale pentru Standardizare pentru statul membru emitent al cardului;
f) numărul de identificare şi acronimul casei de
asigurări de sănătate care emite cardul;
g) numărul cardului.
Art. 321. - (1) Cardul european se eliberează pe
cheltuiala asiguratului, de către casa de asigurări de sănătate la care acesta
este asigurat.
(2) Emiterea cardului european nu poate fi refuzată
de casa de asigurări de sănătate decât în situaţia în care asiguratul nu face
dovada plăţii la zi a contribuţiei de asigurări sociale de sănătate.
(3) Emiterea cardului european se face numai prin
intermediul sistemului informatic unic naţional care gestionează aplicarea
regulamentelor Uniunii Europene privind drepturile asiguraţilor aflaţi în
şedere temporară într-un stat membru al Uniunii
Europene.
(4) Asiguratul care solicită înlocuirea cardului
european în interiorul perioadei de valabilitate stabilite prin reglementările
Uniunii Europene va putea beneficia, contra cost, de un alt card a cărui perioadă de valabilitate nu va putea
depăşi perioada de valabilitate a cardului iniţial.
(5) Datele solicitate de casele de asigurări de
sănătate emitente ale cardului european, precum şi de alte instituţii care
manipulează aceste informaţii se supun legislaţiei referitoare
la prelucrarea datelor cu caracter personal.
(6) In cazul în care circumstanţe excepţionale
împiedică eliberarea cardului european, casa de asigurări de sănătate va
elibera un certificat înlocuitor provizoriu cu o perioadă de valabilitate
stabilită conform art. 323. Modelul certificatului provizoriu se aprobă prin
ordin al preşedintelui Casei Naţionale de Asigurări de Sănătate.
Art. 322. - Cardul european se eliberează numai în
situaţia deplasării asiguratului pentru şedere temporară într-un stat membru al Uniunii Europene.
Art. 323. - Perioada de valabilitate a cardului
european este stabilită astfel încât să acopere perioada de timp necesară
şederii temporare, dar nu poate depăşi 6 luni de la data emiterii.
Art. 324. - (1) Cardul european poate fi utilizat de către asiguraţii din sistemul de asigurări sociale de
sănătate din România numai pe teritoriul statelor membre ale Uniunii Europene.
(2) Pentru persoanele prevăzute la alin. (1) cardul
european nu produce efecte pe teritoriul României şi nu creează nici o
obligaţie pentru furnizorii de servicii medicale din România.
Art. 325. - (1) Furnizorii de servicii medicale aflaţi
în relaţii contractuale cu casele de asigurări de sănătate au obligaţia de a
acorda asistenţa medicală necesară titularilor cardului european emis de unul
dintre statele membre ale Uniunii Europene, în perioada de valabilitate a
cardului şi în aceleaşi condiţii ca pentru persoanele asigurate în cadrul
sistemului de asigurări sociale de sănătate din România, urmând a evidenţia şi
raporta distinct caselor de asigurări sociale de sănătate serviciile medicale
acordate pentru această categorie de persoane.
(2) Casele de asigurări de sănătate au obligaţia de a
recunoaşte cardurile emise de statele membre ale Uniunii Europene.
Art. 326. - (1) Cardul european
conferă dreptul pentru asigurat de a beneficia de asistenţa medicală necesară
în cursul unei şederi temporare într-un stat membru al Uniunii Europene.
(2) Cheltuielile ocazionate de asistenţa medicală
prevăzută la alin. (1) vor fi rambursate de casa de asigurări de sănătate
emitentă a cardului, prin Casa Naţională de Asigurări de Sănătate.
(3) Asistenţa medicală prevăzută la alin. (1) nu
trebuie să depăşească ceea ce este necesar din punct de vedere medical în
timpul şederii temporare.
(4) Persoanele asigurate în unul dintre statele
membre ale Uniunii Europene, posesoare ale unui card european, vor fi tratate în
România în acelaşi mod cu asiguraţii români.
(5) In bugetul Casei Naţionale de Asigurări de
Sănătate vor fi alocate sume distincte pentru operaţiunile de rambursare
prevăzute la alin. (2).
Art. 327. - Cardul european se emite individual pentru
fiecare asigurat care îl solicită.
Art. 328. - Cardul european nu acoperă situaţia în care
asiguratul se deplasează într-un stat membru al Uniunii
Europene în vederea beneficierii de tratament medical.
Art. 329. - Caracteristicile tehnice ale cardului
european, precum şi modalităţile de elaborare şi implementare ale acestuia se
aprobă prin ordin al preşedintelui Casei Naţionale de Asigurări de Sănătate.
CAPITOLUL III
Cardul naţional de asigurări sociale de sănătate
Art. 330. - Cardul naţional de asigurări sociale de
sănătate este un card electronic, distinct de cardul european de asigurări
sociale de sănătate.
Art. 331. - Informaţiile minime care vor putea fi
accesate de pe cardul naţional sunt următoarele:
a) datele de identitate şi codul numeric personal;
b) dovada achitării contribuţiei pentru asigurările
sociale de sănătate;
c) înregistrarea numărului de solicitări de servicii medicale, prin codul furnizorului;
d) diagnostice medicale cu risc vital;
e) grupa sanguină şi Rh;
f) data expirării cardului;
g) numărul de identificare şi acronimul casei de
asigurări de sănătate care emite cardul;
h) numărul cardului.
Art. 332. - (1) Cardul naţional
se eliberează de casa de asigurări de sănătate unde figurează ca asigurat
titularul cardului.
(2) Cheltuielile necesare pentru eliberarea cardului
naţional sunt suportate de casa de asigurări de sănătate emitentă.
Art. 333. - Cardul naţional se eliberează numai prin
sistemul informatic unic integrat al asigurărilor sociale de sănătate.
Art. 334. - Cardul naţional poate fi utilizat numai pe
teritoriul României.
Art. 335. - Furnizorii de servicii medicale,
medicamente şi dispozitive medicale aflaţi în relaţii contractuale cu casele de
asigurări de sănătate au obligaţia de a acorda asistenţa medicală titularilor
de card naţional în condiţiile prevăzute de contractul-cadru şi de normele
metodologice de aplicare a acestuia.
Art. 336. - Cardul naţional se
emite individual pentru fiecare asigurat.
Art. 337. - Caracteristicile tehnice ale cardului
naţional, precum şi modalităţile de elaborare şi implementare ale acestuia se
aprobă prin ordin al preşedintelui Casei Naţionale de Asigurări de Sănătate.
Art. 338. - In bugetul Fondului naţional unic de
asigurări sociale de sănătate vor fi alocate sume pentru cardul naţional, astfel
încât acesta să poată fi implementat până la sfârşitul anului 2007.
TITLUL X
Asigurările voluntare de sănătate
CAPITOLUL I
Dispoziţii generale
Art. 339. - In înţelesul prezentului titlu, termenii şi
noţiunile folosite au următoarea semnificaţie:
a) asigurat - persoana
care are un contract de asigurare încheiat cu asigurătorul şi faţă de care
asigurătorul are obligaţia ca la producerea riscului asigurat să acorde
indemnizaţia sau suma asigurată conform prevederilor contractului de asigurare
voluntară de sănătate;
b) asigurător - persoana juridică sau filiala autorizată în condiţiile Legii nr.
32/2000 privind activitatea de asigurare şi supravegherea asigurărilor, cu
modificările şi completările ulterioare, să exercite activităţi de asigurare,
să practice clasele de asigurări de sănătate din categoria asigurărilor de
viaţă şi/sau generale şi care îşi asumă răspunderea de a
acoperi cheltuielile cu serviciile medicale prevăzute
în contractul de asigurare voluntară de sănătate, precum şi sucursala unei
societăţi de asigurare sau a unei societăţi mutuale, dintr-un stat membru al
Uniunii Europene sau aparţinând Spaţiului Economic European, care a primit o
autorizaţie de la autoritatea competentă a statului membru de origine în acest
sens;
c) copiată pentru
asigurări voluntare de sănătate de tip complementar - suma reprezentând diferenţa dintre preţul de referinţă utilizat în
sistemul de asigurări sociale de sănătate şi suma acceptată la plată de casele
de asigurări din Fondul naţional unic de asigurări sociale de sănătate pentru
serviciul acoperit parţial din pachetul de servicii medicale de bază;
d) furnizor de servicii medicale - persoana fizică sau juridică autorizată de Ministerul Sănătăţii
Publice să acorde servicii medicale în condiţiile legii;
e) listă a furnizorilor
agreaţi - totalitatea furnizorilor aflaţi în
relaţii contractuale cu asigurători care practică asigurări voluntare de
sănătate de tip suplimentar;
f) pachet de servicii
medicale de bază - serviciile şi produsele
destinate prevenirii, diagnosticării, tratamentului, corectării şi recuperării
diferitelor afecţiuni, la care asiguraţii au acces în totalitate, parţial sau
cu anumite limitări în volum ori în suma acoperită, în temeiul asigurărilor
sociale de sănătate, conform prevederilor legale în vigoare;
g) persoane dependente - persoanele fizice aflate în întreţinerea asiguratului şi cărora li
se furnizează servicii medicale dacă acest lucru este stipulat în contractul de
asigurare voluntară de sănătate;
h) preţ de referinţă - preţul utilizat în sistemul de asigurări sociale de sănătate pentru
plata unor servicii şi produse din pachetul de servicii medicale de bază;
i) servicii medicale
furnizate sub formă de abonament - servicii
medicale preplătite pe care furnizorii le oferă în mod direct abonaţilor şi nu
prin intermediul asigurătorilor, în afara serviciilor din pachetul de servicii
medicale de bază din sistemul de asigurări sociale de sănătate.
Art. 340. - (1) Asigurările
voluntare de sănătate reprezintă un sistem
facultativ prin care un asigurător constituie, pe principiul mutualităţii, un
fond de asigurare, prin contribuţia unui număr de asiguraţi expuşi la
producerea riscului de îmbolnăvire, şi îi indemnizează, în conformitate cu
clauzele stipulate în contractul de asigurare, pe cei care suferă un
prejudiciu, din fondul alcătuit din primele încasate, precum şi din celelalte
venituri rezultate ca urmare a activităţii desfăşurate de asigurător şi fac
parte din gama asigurărilor facultative conform Legii nr. 136/1995 privind
asigurările şi reasigurările în România, cu modificările şi completările
ulterioare.
(2) Asiguraţii pot primi indemnizaţii atât pentru
acea parte a cheltuielilor cu serviciile medicale care excedează pachetului de
servicii medicale de bază acoperite de sistemul de asigurări sociale de
sănătate, cât şi pentru coplaţi, dacă acest lucru este prevăzut în contractul
de asigurare voluntară de sănătate.
(3) Nu fac obiectul prezentei legi asigurările pentru
boli profesionale şi accidente de muncă şi serviciile medicale furnizate sub
formă de abonament.
Art. 341. - (1) Asigurările voluntare de sănătate pot
fi, în sensul prezentei legi, asigurări de tip complementar şi suplimentar.
(2) Asigurările voluntare de sănătate de tip
complementar suportă total sau parţial plata serviciilor neacoperite parţial
din pachetul de servicii medicale de bază, coplaţi.
(3) Asigurările voluntare de sănătate de tip
suplimentar suportă total sau parţial plata pentru orice tip de servicii
necuprinse în pachetul de servicii medicale de bază,
opţiunea pentru un anumit personal medical, solicitarea
unei a doua opinii medicale, condiţii hoteliere superioare, alte servicii
medicale specificate în poliţa de asigurare.
Art. 342. - Sunt eligibile pentru serviciile oferite de
sistemul de asigurări voluntare de sănătate orice persoane, cetăţeni români,
cetăţeni străini sau apatrizi care au dreptul la pachetul de servicii medicale
de bază în temeiul asigurărilor sociale de sănătate, conform prevederilor
legale.
Art. 343. - (1) Angajatorii, persoane fizice sau
juridice, pot să încheie contracte de asigurare voluntară de sănătate pentru
angajaţii lor, individual sau în grup, acordate ca beneficii adiţionale la
drepturile salariale ale acestora, în scopul atragerii şi stabilizării
personalului angajat.
(2) In cadrul asigurărilor voluntare de sănătate
raporturile dintre asigurat şi asigurător, precum şi drepturile şi obligaţiile
acestora se stabilesc prin voinţa părţilor, sub forma pachetelor de servicii,
şi sunt menţionate în contractul de asigurare voluntară de sănătate.
Art. 344. - Infiinţarea, autorizarea şi funcţionarea
asigurătorilor care practică asigurări voluntare de sănătate se desfăşoară în
conformitate cu prevederile legislaţiei care reglementează activitatea de
asigurări.
CAPITOLUL II
Contractul de asigurare voluntară de sănătate
Art. 345. - Contractul de asigurare voluntară de
sănătate trebuie să cuprindă, pe lângă elementele obligatorii, şi următoarele
elemente:
a) lista şi volumul de acoperire ale coplaţilor
pentru asigurări voluntare de sănătate de tip complementar, în conformitate cu
preţul de referinţă stabilit de Casa Naţională de Asigurări de Sănătate;
b) lista serviciilor din
asigurarea voluntară suplimentară;
c) lista furnizorilor agreaţi;
d) modalitatea de contactare a acestora, direct sau
prin intermediul unui departament de asistenţă a asiguraţilor;
e) drepturile şi obligaţiile părţilor, cu
evidenţierea clară a riscului de îmbolnăvire individual;
f) modalităţile de decontare a serviciilor medicale;
g) modalităţile de încetare a valabilităţii
contractului; h) modalităţile de soluţionare a eventualelor litigii.
Art. 346. - Asigurătorii sunt obligaţi ca la încheierea
contractului de asigurare voluntară de sănătate să ofere asiguratului toate
informaţiile necesare privind drepturile şi obligaţiile rezultând din contract,
în vederea protejării intereselor asiguraţilor.
Art. 347. - (1) Asigurătorul poate solicita, la
iniţierea contractului de asigurare, pe cheltuiala proprie şi cu consimţământul
pacientului, informaţii privind starea de sănătate a asiguratului, precum şi
efectuarea unui examen medical pentru evaluarea stării de sănătate a
solicitantului de către un furnizor de servicii medicale desemnat de acesta.
(2) Informaţiile cuprinse în contractul de asigurare
voluntară, precum şi informaţiile privind starea de sănătate a asiguratului au
caracter confidenţial şi nu pot fi divulgate unor terţi de către asigurătorii
care practică asigurări voluntare de sănătate sau persoanele fizice/juridice
care, prin natura relaţiilor de serviciu, cum ar fi controlor, auditor şi alte
asemenea funcţii, intră în posesia informaţiilor în cauză, cu excepţia
cazurilor prevăzute de lege.
(3) Prin contract, asigurătorul care practică
asigurări voluntare de sănătate de tip suplimentar poate restricţiona pentru
acest tip de asigurare accesul asiguratului, parţial sau în totalitate, la
anumiţi furnizori de servicii şi poate condiţiona utilizarea unor servicii în
caz de îmbolnăvire de efectuarea
prealabilă a unor controale periodice profilactice sau de utilizarea unor
anumiţi furnizori agreaţi.
(4) Asigurătorii care comercializează asigurări
voluntare de sănătate complementare sunt obligaţi să achite copiata conform
contractului cu asiguratul oricărui furnizor de servicii aflat în relaţie contractuală
cu casele de asigurări şi nu pot restricţiona pentru acestea accesul
asiguraţilor.
CAPITOLUL III
Relaţia furnizorilor de servicii medicale cu
societăţile de asigurări voluntare de sănătate
Art. 348. - (1) Toţi furnizorii care prestează servicii
medicale pentru asigurările voluntare de sănătate trebuie să fie autorizaţi de
Ministerul Sănătăţii Publice, în baza reglementărilor în vigoare. Pentru
prestarea serviciilor care intră sub incidenţa asigurărilor de sănătate de tip
complementar, furnizorii de servicii medicale trebuie să fie în relaţie
contractuală cu casele de asigurări.
(2) Furnizorii de servicii medicale care sunt în
relaţie contractuală cu casele de asigurări au obligaţia de a accepta copiata
de la asigurătorii autorizaţi de a presta asigurări voluntare de sănătate de
tip complementar sau, prin excepţie, de la asiguraţi, în conformitate cu lista
coplaţilor şi valoarea ce poate fi acoperită prin sistemul asigurărilor
voluntare de sănătate.
(3) Furnizorii de servicii medicale care sunt în
relaţie contractuală cu casele de asigurări au dreptul de a încheia contracte
şi cu asigurătorii autorizaţi de a presta asigurări voluntare de sănătate de
tip suplimentar.
Art. 349. - (1) Furnizorii de servicii medicale sunt
obligaţi să elibereze documente justificative de decontare (factură, chitanţă)
pentru serviciile medicale prestate acoperite prin asigurările voluntare de
sănătate.
(2) In cazul în care nu există
un contract încheiat între asigurător şi furnizorii de servicii medicale,
decontarea cheltuielilor se va face pe baza documentelor justificative emise de
furnizorul de servicii medicale.
(3) Unităţile sanitare publice au obligaţia de a
respecta, în relaţia cu asigurătorii, tarifele maximale privind asigurările
suplimentare de sănătate, aprobate prin ordin al ministrului sănătăţii publice.
(4) Furnizorii privaţi pot stabili, prin negociere,
alte tarife decât cele menţionate la alin. (3).
Art. 350. - (1) Comisia de Supraveghere a Asigurărilor
supraveghează activitatea asigurătorilor autorizaţi să practice asigurări
voluntare de sănătate în conformitate cu prevederile legale.
(2) Fiecare asigurător autorizat să practice
asigurările voluntare de sănătate are obligaţia, în vederea încheierii
contractelor de asigurare de acest tip, să obţină avizarea de către direcţia de
specialitate din cadrul Ministerului Sănătăţii Publice a listei furnizorilor de
servicii medicale agreaţi, alţii decât cei aflaţi deja în relaţie contractuală
cu casele de asigurări de sănătate, şi să reactualizeze această listă înaintea
contractării unui nou furnizor.
(3) Lista coplaţilor şi preţul de referinţă pentru
serviciile din pachetul de servicii medicale de bază acoperite parţial se
stabilesc anual de Casa Naţională de Asigurări de Sănătate cu avizul
Ministerului Sănătăţii Publice.
Art. 351. - (1) In baza contractului încheiat cu
furnizorii de servicii, asigurătorii au dreptul de a verifica, prin experţi
autorizaţi de Ministerul Sănătăţii Publice şi organizaţiile profesionale,
direct sau prin interpuşi, calitatea serviciilor prestate asiguraţilor.
(2) Intreaga responsabilitate a actului medical rămâne
în seama furnizorilor de servicii medicale şi farmaceutice.
Art. 352. - Diferendele survenite între asigurător şi
furnizorii de servicii medicale se soluţionează pe cale amiabilă. In cazul
imposibilităţii rezolvării pe cale amiabilă, litigiile se aduc la cunoştinţa
direcţiei de specialitate din cadrul Ministerului Sănătăţii Publice şi a
Comisiei de Supraveghere a Asigurărilor, care vor încerca medierea
diferendului. In caz de eşec al medierii, diferendele sunt deduse instanţelor
judecătoreşti legal competente.
Art. 353. - Plângerile privind calitatea serviciilor medicale formulate direct de către asiguraţi sau prin intermediul
asigurătorilor autorizaţi să practice asigurări voluntare de sănătate se
adresează Ministerului Sănătăţii Publice şi sunt notificate Comisiei de
Supraveghere a Asigurărilor.
CAPTIOLUL IV
Dispoziţii finale şi
sancţiuni
Art. 354. - Asigurătorii care în prezent practică
asigurări de sănătate facultative sunt obligaţi să se conformeze prevederilor
art. 350 alin. (2) în termen de 90 de zile de la data publicării prezentei legi
în Monitorul Oficial al României, Partea I.
Art. 355. - (1) Divulgarea cu intenţie a informaţiilor
privind starea de sănătate a asiguraţilor de către un salariat al
asigurătorului, fără consimţământul asiguratului, constituie infracţiune şi se
pedepseşte cu închisoare de la 3 luni la 2 ani sau cu amendă de la 25.000 lei
(RON) la 50.000 lei (RON).
(2) Dacă fapta prevăzută la alin. (1) a fost săvârşită
din culpă, pedeapsa este închisoarea de la o lună la un an sau amendă de la
25.000 lei (RON) la 50.000 lei (RON).
Art. 356. - (1) Incălcarea
prevederilor art. 350 alin. (2) şi ale art. 354 de către asigurătorii
autorizaţi să practice asigurări voluntare de sănătate constituie contravenţie
şi se sancţionează cu amendă de la 25.000 lei (RON) la 50.000 lei (RON).
(2) Constatarea contravenţiilor
şi aplicarea sancţiunilor contravenţionale se fac de către personalul
împuternicit al Comisiei de Supraveghere a Asigurărilor.
Art. 357. - Dispoziţiile art. 356 se completează cu
prevederile Ordonanţei Guvernului nr. 2/2001 privind regimul juridic al
contravenţiilor, aprobată cu modificări şi completări prin Legea nr. 180/2002,
cu modificările şi completările ulterioare.
Art. 358. - Ministerul Sănătăţii Publice şi Comisia de
Supraveghere a Asigurărilor vor elabora împreună sau separat, după caz, norme
metodologice de aplicare a prezentului titlu în termen de 90 de zile de la data
intrării în vigoare a acestuia.
Art. 359. - Lista coplaţilor şi preţul de referinţă
pentru serviciile din pachetul de servicii medicale de bază acoperite parţial,
menţionate la alin. (3) al art. 350, se stabilesc anual de Casa Naţională de
Asigurări de Sănătate, cu avizul Ministerului Sănătăţii Publice, şi vor fi
aprobate prin ordin al preşedintelui Casei Naţionale de Asigurări de Sănătate,
în termen de 90 de zile de la data intrării în vigoare a prezentului titlu.
Art. 360. - La data intrării în vigoare a prezentului
titlu se abrogă Legea asigurărilor private de sănătate nr. 212/2004, publicată
în Monitorul Oficial al României, Partea I, nr. 505 din
4 iunie 2004, cu modificările ulterioare.
TITLUL XI
Finanţarea unor cheltuieli de sănătate
Art. 361. - In scopul combaterii consumului excesiv de
produse din tutun şi băuturi alcoolice, altele decât vinul şi berea, prevăzute în prezenta lege, precum
şi pentru finanţarea cheltuielilor de sănătate, se instituie unele contribuţii
ce se constituie ca venituri proprii ale Ministerului Sănătăţii Publice.
Art. 362. - Veniturile prevăzute la art. 361 vor fi
folosite pentru investiţii în infrastructura sistemului sanitar public,
finanţarea programelor naţionale de sănătate şi pentru rezerva Ministerului
Sănătăţii Publice pentru situaţii speciale.
Art. 363. - (1) In aplicarea prevederilor art. 361 şi
362 se stabilesc următoarele măsuri:
a) persoanele juridice care produc sau importă produse din tutun contribuie astfel:
1. pentru ţigarete cu suma de 10 euro/1.000 de
ţigarete;
2. pentru ţigări şi ţigări de foi cu suma de 10 euro/
1.000 de bucăţi;
3. pentru tutun destinat fumatului cu suma de 13
euro/kg;
b) persoanele juridice care produc
sau importă băuturi alcoolice, altele decât bere, vinuri, băuturi fermentate,
altele decât bere şi vinuri, produse intermediare, aşa cum sunt definite prin
Legea nr. 571/2003 privind Codul fiscal, cu modificările şi completările
ulterioare, contribuie cu suma de 200 euro/hectolitru
alcool pur sau 2 euro/fiecare litru alcool pur;
c) persoanele juridice care realizează încasări din
activităţi publicitare la produse din tutun şi băuturi alcoolice contribuie cu
o cotă de 12% din valoarea acestor încasări, după deducerea taxei pe valoarea
adăugată.
(2) Valoarea în lei a contribuţiilor prevăzute la alin.
(1), stabilită potrivit legii în echivalent euro/unitate de măsură, se
determină prin transformarea sumelor exprimate în echivalent euro la cursul de
schimb valutar utilizat pentru calculul accizelor, la data plăţii acestor
contribuţii.
Art. 364. - Contribuţiile prevăzute la art. 363 alin.
(1) lit. c) se constituie ca venituri proprii ale Ministerului Sănătăţii
Publice începând cu data de 1 ianuarie 2007.
Art. 365. - (1) Contribuţiile prevăzute la art. 363 se
virează lunar până la data de 25 a lunii următoare celei în care a avut loc
livrarea produselor pe piaţa internă, într-un cont special, deschis la
Trezoreria Statului pe numele Ministerului Sănătăţii Publice.
(2) Pentru neplata la scadenţă a contribuţiilor se
calculează şi se datorează accesorii în condiţiile Ordonanţei Guvernului nr.
92/2003 privind Codul de procedură fiscală, republicată, cu modificările şi
completările ulterioare.
Art. 366. - (1) Veniturilor şi
cheltuielilor prevăzute la art. 361 şi 362 li se aplică prevederile referitoare
la bugetele de venituri şi cheltuieli ale unor activităţi, instituite prin
Legea nr. 500/2002 privind finanţele publice, cu modificările ulterioare.
(2) Se autorizează Ministerul
Finanţelor Publice, la propunerea ordonatorului principal de credite, să
introducă modificările ce decurg din aplicarea prevederilor prezentului titlu
în anexele aprobate pe anul 2006 Ministerului Sănătăţii Publice.
Art. 367. - Contribuţiile pentru finanţarea
cheltuielilor de sănătate rămase la sfârşitul anului se reportează în anul următor
şi se utilizează cu aceeaşi destinaţie.
Art. 368. - In termen de 30 de zile de la data intrării
în vigoare a prezentului titlu, Ministerul Sănătăţii Publice şi Ministerul
Finanţelor Publice vor elabora norme de aplicare a prezentului titlu.
Art. 369. - La data intrării în vigoare a prezentului
titlu, Ordonanţa Guvernului nr. 22/1992 privind finanţarea ocrotirii sănătăţii,
publicată în Monitorul Oficial al României, Partea I, nr. 213 din 28 august 1992, aprobată prin Legea nr. 114/1992, cu
modificările şi completările ulterioare, se abrogă, cu excepţia prevederilor
privind cota de 12% din încasări
din activităţi publicitare la produse de tutun, ţigări şi băuturi alcoolice
care se abrogă la data de 1 ianuarie 2007.
TITLUL XII
Exercitarea profesiei de medic. Organizarea şi funcţionarea Colegiului Medicilor
din România
CAPITOLUL I
Exercitarea profesiei de medic
SECŢIUNEA 1
Dispoziţii generale
Art. 370. - Profesia de medic
se exercită, pe teritoriul României, în condiţiile prezentei legi, de către
persoanele fizice posesoare ale unui titlu oficial de calificare în medicină.
Acestea pot fi:
a) cetăţeni ai statului român;
b) cetăţeni ai unui stat membru al Uniunii Europene,
ai unui stat aparţinând Spaţiului Economic European sau ai Confederaţiei
Elveţiene;
c) soţul unui cetăţean român, precum şi descendenţii
şi ascendenţii în linie directă, aflaţi în întreţinerea unui cetăţean român,
indiferent de cetăţenia acestora;
d) membrii de familie ai unui cetăţean al unuia
dintre statele prevăzute la lit. b), aşa cum sunt definiţi la art. 2 alin. (1)
pct. 3 din Ordonanţa de urgenţă a Guvernului nr. 102/2005 privind libera
circulaţie pe teritoriul României a cetăţenilor statelor membre ale Uniunii
Europene şi Spaţiului Economic European, aprobată cu modificări şi completări
prin Legea nr. 260/2005;
e) cetăţenii statelor terţe beneficiari ai statutului
de rezident permanent în România;
f) beneficiari ai statutului de
rezident pe termen lung acordat de către unul dintre statele prevăzute la lit.
b).
Art. 371. - (1) In înţelesul prezentului titlu,
termenul medici cetăţeni ai unui stat membru al Uniunii Europene, ai unui
stat aparţinând Spaţiului Economic European sau ai Confederaţiei Elveţiene desemnează,
prin asimilare, şi medicii aflaţi în situaţiile prevăzute la art. 370 lit. d)
şi f).
(2) In mod exclusiv, prin termenul stat membru de origine sau de provenienţă, stat membru de stabilire
sau, după caz, stat membru gazdă se înţelege un
stat membru al Uniunii Europene, un stat aparţinând Spaţiului Economic European
sau Confederaţia Elveţiană.
(3) Prin titlu oficial de
calificare în medicină se înţelege:
a) diplomă de medic, eliberată de o instituţie de
învăţământ superior medico-farmaceutic acreditată din România;
b) certificatul de medic specialist, eliberat de
Ministerul Sănătăţii Publice;
c) diplomă, certificatul sau un alt titlu în
medicină, eliberate conform normelor Uniunii Europene de statele membre ale
Uniunii Europene, statele aparţinând Spaţiului Economic European sau de
Confederaţia Elveţiană;
d) diplomă, certificatul sau un alt titlu în
medicină, dobândite într-un stat terţ şi recunoscute de unul dintre statele
membre prevăzute la lit. c) ori echivalate în România.
Art. 372. - Titlurile oficiale de calificare în
medicină obţinute în afara României, a statelor membre ale Uniunii Europene, a
statelor aparţinând Spaţiului Economic European sau a Confederaţiei Elveţiene
se echivalează potrivit legii. Excepţie de la aceste prevederi fac titlurile
oficiale de calificare în medicină care au fost recunoscute de unul dintre
aceste state.
Art. 373. - Monitorizarea şi controlul exercitării
profesiei de medic se realizează de către Colegiul Medicilor din România şi
Ministerul Sănătăţii Publice, denumite în continuare autorităţi competente
române.
Art. 374. - (1) Profesia de medic are ca principal scop
asigurarea stării de sănătate prin prevenirea îmbolnăvirilor, promovarea,
menţinerea şi recuperarea sănătăţii individului şi a colectivităţii.
(2) In vederea realizării acestui scop, pe tot timpul
exercitării profesiei, medicul trebuie să dovedească disponibilitate,
corectitudine, devotament, loialitate şi respect faţă de fiinţa umană.
(3) Deciziile şi hotărârile cu caracter medical vor fi
luate avându-se în vedere interesul şi drepturile pacientului, principiile
medicale general acceptate, nediscriminarea între pacienţi, respectarea
demnităţii umane, principiile eticii şi deontologiei medicale, grija faţă de
sănătatea pacientului şi sănătatea publică.
Art. 375. - (1) In scopul asigurării în orice
împrejurare a intereselor pacientului, profesia de medic are la baza
exercitării sale independenţa şi libertatea profesională a medicului, precum şi
dreptul de decizie asupra hotărârilor cu caracter medical.
(2) Având în vedere natura profesiei de medic şi
obligaţiile fundamentale ale medicului faţă de pacientul său, medicul nu este
funcţionar public.
(3) In legătură cu exercitarea profesiei şi în limita
competenţelor profesionale, medicului nu îi pot fi impuse îngrădiri privind
prescripţia şi recomandările cu caracter medical, avându-se în vedere
caracterul umanitar al profesiei de medic, obligaţia medicului de deosebit
respect faţă de fiinţa umană şi de loialitate faţă de pacientul său, precum şi
dreptul medicului de a prescrie şi de a recomanda tot ceea ce este necesar din
punct de vedere medical pacientului.
Art. 376. - (1) Cu excepţia cazurilor de forţă majoră,
de urgenţă ori când pacientul sau reprezentanţii legali ori numiţi ai acestuia
sunt în imposibilitate de a-şi exprima voinţa sau consimţământul, medicul acţionează
respectând voinţa pacientului şi dreptul acestuia de a refuza ori de a opri o
intervenţie medicală.
(2) Responsabilitatea medicală încetează în situaţia în
care pacientul nu respectă prescripţia sau recomandarea medicală.
Art. 377. - (1) Medicii care îndeplinesc condiţia de
cetăţenie prevăzută la art. 370 şi sunt membri ai Colegiului Medicilor din
România exercită profesia de medic, în regim salarial şi/sau independent.
(2) Pentru accesul la una dintre activităţile de medic
sau exerciţiul acesteia, medicii cetăţeni ai unui stat membru al Uniunii
Europene, ai un stat aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene, stabiliţi în unul dintre aceste state, sunt exceptaţi,
în caz de prestare temporară sau ocazională de servicii medicale pe teritoriul
României, de la obligativitatea înscrierii în Colegiul Medicilor din România.
Art. 378. - (1) La primirea în rândurile Colegiului
Medicilor din România, medicul va depune jurământul
lui Hipocrate în formularea modernă adoptată de Asociaţia Medicală Mondială în
cadrul Declaraţiei de la Geneva din anul 1975:
„Odată admis printre membrii profesiunii de medic:
Mă angajez solemn să-mi consacru viaţa în slujba
umanităţii;
Voi păstra profesorilor mei respectul şi recunoştinţa
care le sunt datorate;
Voi exercita profesiunea cu conştiinţă şi demnitate;
Sănătatea pacienţilor va fi pentru mine obligaţia
sacră;
Voi păstra secretele încredinţate de pacienţi, chiar şi
după decesul acestora;
Voi menţine, prin toate mijloacele, onoarea şi nobila
tradiţie a profesiunii de medic;
Colegii mei vor fi fraţii mei;
Nu voi îngădui să se interpună între datoria mea şi
pacient consideraţii de naţionalitate, rasă, religie, partid sau stare socială;
Voi păstra respectul deplin pentru viaţa umană de la
începuturile sale chiar sub ameninţare şi nu voi utiliza cunoştinţele mele
medicale contrar legilor umanităţii.
Fac acest jurământ în mod solemn, liber, pe
onoare!"
(2) Prevederile alin. (1) se
aplică şi:
a) medicilor cetăţeni români stabiliţi în străinătate
şi care doresc să exercite profesia în România;
b) medicilor cetăţeni ai unui stat membru al Uniunii
Europene, ai unui stat aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene, stabiliţi în România;
c) medicilor cetăţeni ai unui stat membru al Uniunii
Europene, ai unui stat aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene, stabiliţi în unul dintre aceste state şi care solicită
intrarea în profesie în România;
d) medicilor care întrunesc condiţiile prevăzute la
art. 370 lit. c) şi e).
(3) Medicii prevăzuţi la alin. (2) lit. b) şi c) pot
depune jurământul în limba română sau în una dintre limbile de circulaţie din
Uniunea Europeană.
Art. 379. - (1) Profesia de medic se exercită pe
teritoriul României de către persoanele prevăzute la art. 370 care îndeplinesc
următoarele condiţii:
a) deţin un titlu oficial de calificare în medicină;
b) nu se găsesc în vreunul dintre cazurile de
nedemnitate sau incompatibilitate prevăzute de prezenta lege;
c) sunt apţi din punct de vedere medical pentru
exercitarea profesiei de medic;
d) sunt membri ai Colegiului Medicilor din România;
e) prin excepţie de la lit. d), în caz de prestare
temporară sau ocazională de servicii, medicii care întrunesc condiţiile prevăzute
la art. 370 lit. b), d) sau f) trebuie să înştiinţeze Ministerul Sănătăţii
Publice cu privire la prestarea temporară sau ocazională de servicii medicale
pe teritoriul României şi să fie înregistraţi pe această perioadă la Colegiul
Medicilor din România.
(2) Medicii cetăţeni ai unui stat membru al Uniunii
Europene, ai unui stat aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene, stabiliţi pe teritoriul României, precum şi medicii
care întrunesc condiţiile prevăzute la art. 370 lit. c) şi e), exercită
profesia de medic cu aceleaşi drepturi şi obligaţii ca şi medicii cetăţeni
români membri ai Colegiului Medicilor din România.
Art. 380. - (1) Profesia de medic se exercită în
România cu titlul profesional corespunzător calificării profesionale însuşite,
după cum urmează:
a) medic de medicină generală pentru absolvenţii
facultăţilor de medicină licenţiaţi anterior promoţiei 2005 şi care au dobândit
drept de liberă practică în baza normelor precedente
prezentei legi;
b) medic specialist în una dintre specialităţile
clinice sau paraclinice prevăzute de Nomenclatorul specialităţilor medicale,
medico-dentare şi farmaceutice pentru reţeaua de asistenţă medicală.
(2) Prevederile alin. (1) se
aplică şi cetăţenilor unui stat membru al Uniunii Europene, ai unui stat
aparţinând Spaţiului Economic European sau ai Confederaţiei Elveţiene, care
deţin un titlu oficial de calificare în medicină şi care exercită profesia în
România.
(3) Medicii care au obţinut
certificatul de membru al Colegiului Medicilor din România pot desfăşura
activităţi medicale potrivit
pregătirii profesionale în sistemul public de sănătate sau/şi în sistemul
privat, fie ca angajaţi, fie ca persoană fizică independentă pe bază de
contract. Calitatea de persoană fizică independentă se dobândeşte în baza
certificatului de membru al Colegiului Medicilor din România şi a înregistrării
la administraţia financiară în a cărei rază domiciliază medicul. In condiţiile
legii, medicii pot înfiinţa şi cabinete de practică medicală.
Art. 381. - (1) Certificatele eliberate de autorităţile
competente ale unui stat membru al Uniunii Europene, ale unui stat aparţinând
Spaţiului Economic European sau ale Confederaţiei Elveţiene, care atestă că
medicul posesor, cetăţean al acestora, este titular de drept câştigat, sunt
recunoscute de autorităţile competente române, permiţând exercitarea
activităţilor de medic şi, respectiv, cele de medicină de familie, inclusiv în
cadrul sistemului naţional de asigurări sociale de sănătate, cu respectarea
prezentei legi.
(2) Prin drept câştigat se înţelege dreptul cetăţenilor statelor membre ale Uniunii
Europene, ai statelor aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene de a exercita activităţile de medic, precum şi pe cele
de medic cu formarea specifică în medicină generală prevăzută de normele
Uniunii Europene, inclusiv în cadrul sistemului de protecţie socială al
statului membru de origine sau de provenienţă, în cazul în care aceştia
beneficiau de drept de liberă practică a profesiei şi erau stabiliţi în statul
membru respectiv anterior implementării Directivei Consiliului Uniunii Europene
nr. 93/16/CEE.
SECŢIUNEA a 2-a
Nedemnităţi şi
incompatibilităţi
Art. 382. - Este nedemn de a exercita profesia de medic:
a) medicul care a fost condamnat definitiv pentru
săvârşirea cu intenţie a unei infracţiuni contra umanităţii sau vieţii în
împrejurări legate de exercitarea profesiei de medic şi pentru care nu a
intervenit reabilitarea;
b) medicul căruia i s-a aplicat pedeapsa interdicţiei
de a exercita profesia, pe durata stabilită, prin hotărâre judecătorească sau
disciplinară.
Art. 383. - (1) Exercitarea profesiei de medic este
incompatibilă cu:
a) calitatea de angajat sau colaborator al unităţilor de producţie ori de distribuţie de produse
farmaceutice sau materiale sanitare;
b) starea de sănătate fizică sau psihică
necorespunzătoare pentru exercitarea profesiei medicale.
(2) Pe timpul stării de incompatibilitate se suspendă
dreptul de exercitare a profesiei.
(3) In termen de 10 zile de la apariţia siutaţiei de
incompatibilitate, medicul este obligat să anunţe colegiul al cărui membru
este.
(4) La solicitarea medicului, la sesizarea oricărei
persoane, instituţii sau autorităţi interesate, preşedintele colegiului din
care face parte medicul poate constitui o comisie specială, pentru fiecare caz
în parte, alcătuită din 3 medici primari, pentru a confirma sau a infirma
situaţia de incompatibilitate.
SECŢIUNEA a 3-a
Autorizarea exercitării profesiei de medic
Art. 384. - (1) Medicii care întrunesc condiţiile
prevăzute la art. 370 exercită profesia pe baza certificatului de membru al
Colegiului Medicilor din România, avizat anual pe baza asigurării de răspundere
civilă, pentru greşeli în activitatea profesională, valabilă pentru anul
respectiv.
(2) In caz de prestare temporară sau ocazională de
servicii pe teritoriul României, medicii cetăţeni ai unui stat membru al
Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene, stabiliţi în unul dintre aceste state, sunt exceptaţi
de la obligativitatea înscrierii în Colegiul Medicilor din România. Accesul la
activităţile de medic pe durata prestării serviciilor se face conform
prevederilor art. 396.
(3) Certificatul de membru se acordă pe baza
următoarelor acte:
a) documentele care atestă formarea în profesie;
b) certificatul de sănătate;
c) declaraţie pe propria răspundere privind
îndeplinirea condiţiilor prevăzute la art. 382 şi 383;
d) certificatul de cazier judiciar.
(4) Certificatul de membru devine operativ numai după
încheierea asigurării de răspundere civilă.
Art. 385. - (1) Medicii se pensionează la vârsta
prevăzută de lege.
(2) In unităţile sanitare publice, medicii membri
titulari şi corespondenţi ai Academiei Române, profesori universitari şi
cercetători ştiinţifici gradul I, doctori în ştiinţe medicale, care desfăşoară activităţi medicale,
pot continua, la cerere, activitatea medicală până la împlinirea vârstei de 70
de ani.
(3) Medicii care au depăşit limita de vârstă prevăzută
la alin. (1) pot profesa în continuare în unităţi sanitare private.
Desfăşurarea activităţii se face în baza certificatului de membru şi a avizului
anual al Colegiului Medicilor din România eliberat pe baza certificatului de
sănătate şi a asigurării de răspundere civilă, pentru greşeli în activitatea
profesională, încheiată pentru anul respectiv.
(4) In cazul unităţilor sanitare publice care
înregistrează deficit de personal medical, precum şi al unităţilor sanitare
publice aflate în zone defavorizate, medicii îşi pot continua activitatea peste
vârsta de pensionare prevăzută de lege. Criteriile de menţinere în activitate
în aceste situaţii se stabilesc prin norme aprobate prin hotărâre a Guvernului.
(5) Medicii deţinuţi sau internaţi din motive
politice, aflaţi în situaţiile prevăzute la art. 1 alin. (1) şi (2) din
Decretul-lege nr. 118/1990 privind acordarea unor drepturi persoanelor
persecutate din motive politice de dictatura instaurată cu începere de la 6
martie 1945, precum şi celor deportate în străinătate ori constituite în
prizonieri, republicat, cu modificările şi completările ulterioare, pot fi
menţinuţi, la cerere, în activitatea profesională, pe baza certificatului anual
de sănătate. Aceste prevederi se aplică şi medicilor care, din motive politice,
au fost obligaţi să îşi întrerupă studiile o anumită perioadă, obţinându-şi
licenţa cu întârziere, ori celor care au fost împiedicaţi să îşi reia
activitatea profesională.
(6) Medicii care au împlinit
vârsta de pensionare prevăzută de lege nu pot deţine funcţii de conducere în
cadrul Ministerului Sănătăţii Publice, al ministerelor şi instituţiilor
centrale cu reţea sanitară proprie, al autorităţilor de sănătate publică, al
Casei Naţionale de Asigurări de Sănătate, al caselor judeţene de asigurări de
sănătate şi a municipiului Bucureşti, precum şi în cadrul spitalelor publice şi
al oricărei alte unităţi sanitare publice.
Art. 386. - (1) In cazul în care un medic îşi întrerupe
activitatea profesională sau se află într-o situaţie de incompatibilitate pe o
perioadă mai mare de 5 ani, Colegiul Medicilor din România atestă competenţa
profesională a acestuia, în vederea reluării activităţii medicale.
(2) Procedura privind modalităţile şi condiţiile de
verificare şi atestare a nivelului profesional se stabileşte de către Consiliul
Naţional al Colegiului Medicilor din România.
(3) Prevederile alin. (1) se aplică şi medicilor
cetăţeni ai unui stat membru al Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European sau ai Confederaţiei Elveţiene, stabiliţi
în România.
Art. 387. - (1) Practicarea profesiei de medic de către
o persoană care nu are această calitate constituie infracţiune şi se pedepseşte
conform Codului penal.
(2) Colegiul Medicilor din
România, prin preşedintele colegiului teritorial, este în drept să exercite
acţiunea civilă sau să sesizeze, după caz, organele de urmărire penală ori
autorităţile competente, pentru urmărirea şi trimiterea în judecată a
persoanelor care îşi atribuie sau care întrebuinţează fără drept titlul ori
calitatea de medic sau care practică în mod nelegal medicina.
(3) Acţiunea penală împotriva unui membru al
Colegiului Medicilor din România cu privire la fapte ce au legătură cu
exercitarea profesiei de medic se pune în mişcare cu înştiinţarea prealabilă a
colegiului al cărui membru este medicul respectiv.
(4) Instanţele de judecată civile sau penale, din
oficiu, vor comunica Colegiului Medicilor din România hotărârile judecătoreşti
rămase definitive, prin care s-au pronunţat cu privire la fapte exercitate în
timpul şi în legătură cu profesia de către medici pe teritoriul României.
CAPITOLUL II
Dispoziţii privind exercitarea profesiei de medic pe teritoriul României de către
medicii cetăţeni ai unui stat membru al Uniunii
Europene, ai unui stat aparţinând Spaţiului
Economic European sau ai Confederaţiei Elveţiene
SECŢIUNEA 1
Dispoziţii privind facilitarea dreptului de
stabilire
Art. 388. - (1) In caz de stabilire pe teritoriul
României, solicitările medicilor cetăţeni ai unui stat membru al Uniunii
Europene, ai unui stat aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene cu privire la accesul la una dintre activităţile de
medic se soluţionează de Ministerul Sănătăţii Publice, în colaborare cu
Colegiul Medicilor din România, în termen de 3 luni de la depunerea dosarului
complet de către cel interesat. Aceştia primesc certificatul de membru al
Colegiului Medicilor din România în urma aplicării procedurii de recunoaştere a
calificării profesionale.
(2) Dosarul prevăzut la alin. (1) va cuprinde:
a) copia documentului de cetăţenie;
b) copia documentelor care atestă formarea în
profesie;
c) certificatul emis de autorităţile competente ale
statului membru de origine sau de provenienţă, prin care se atestă că titlurile
oficiale de calificare sunt cele prevăzute de Directiva 2005/36/CE;
d) certificatul de sănătate fizică şi psihică emis de
statul membru de origine sau de provenienţă;
e) dovada emisă de statul membru de origine sau de
provenienţă, prin care se atestă onorabilitatea şi moralitatea posesorului;
f) dovada de asigurare privind răspunderea civilă
pentru greşeli în activitatea profesională, emisă de instituţiile abilitate din
unul dintre statele membre prevăzute la alin. (1).
(3) Documentele prevăzute la
alin. (2) lit. d)-f) sunt valabile 3 luni de la data emiterii.
Art. 389. - (1) In situaţia în care pentru accesul şi
exerciţiul activităţii prevăzute la alin. (1) statul membru de origine sau de
provenienţă nu impune o astfel de cerinţă şi, în consecinţă, nu emite
cetăţenilor săi documentul prevăzut la art. 388 alin. (2) lit. d), autorităţile
competente române acceptă din partea acestuia un atestat echivalent
certificatului de sănătate.
(2) In cazul în care statul membru de origine sau de provenienţă nu impune o astfel de cerinţă şi, în
consecinţă, nu emite cetăţenilor săi documentul prevăzut la art. 388 alin. (2)
lit. e), autorităţile competente române acceptă atestatul eliberat pe baza
declaraţiei sub jurământ ori a declaraţiei solemne a solicitantului, de către
autoritatea judiciară sau administrativă competentă ori, după caz, de notarul
sau organizaţia profesională abilitată în acest sens de acel stat.
Art. 390. - (1) In termen de 30 de zile de la primirea
dosarului, Ministerul Sănătăţii Publice informează
solicitantul asupra documentelor necesare completării acestuia.
(2) Deciziile autorităţilor competente române în aceste
cazuri pot fi atacate la instanţa de contencios administrativ.
Art. 391. - (1) Atunci când autorităţile competente
române au cunoştinţă de fapte grave şi precise care pot avea repercusiuni
asupra începerii activităţii profesionale sau asupra exercitării profesiei de
medic în România, comise de medicii cetăţeni ai unui stat membru al Uniunii Europene,
ai unui stat aparţinând Spaţiului Economic European ori ai Confederaţiei
Elveţiene, anterior stabilirii în România şi în afara teritoriului său, acestea
informează statul membru de origine sau de provenienţă al celor în cauză.
(2) Autorităţile competente române comunică statului
membru gazdă informaţiile solicitate cu privire la sancţiunile disciplinare de
natură profesională sau administrativă, precum şi cu privire la sancţiunile
penale interesând exerciţiul profesiei de medic, aplicate medicilor pe durata
exercitării profesiei în România.
(3) Autorităţile competente române analizează
informaţiile transmise de statul membru gazdă cu privire la faptele grave şi
precise comise de medicii cetăţeni români sau care provin din România, anterior
stabilirii în statul membru gazdă şi în afara teritoriului, ori fapte care pot
avea repercusiuni asupra începerii activităţii profesionale sau asupra
exercitării profesiei de medic în acel stat.
(4) Autorităţile competente române decid asupra
naturii şi amplorii investigaţiilor pe care le întreprind în situaţiile pentru
care au fost sesizate şi comunică statului membru gazdă consecinţele care
rezultă cu privire la atestatele şi documentele pe care le-au emis în cazurile
respective.
SECŢIUNEA a 2-a
Dispoziţii cu privire la libera prestare a serviciilor medicale
Art. 392. - (1) Prezentele dispoziţii se aplică
medicilor cetăţeni ai unui stat membru al Uniunii Europene, ai unui stat
aparţinând Spaţiului Economic European sau ai Confederaţiei Elveţiene care sunt
stabiliţi în vederea exercitării profesiei în unul dintre aceste state, atunci
când se deplasează pe teritoriul României pentru a exercita în regim temporar
ori ocazional activităţile de medic.
(2) Caracterul temporar sau ocazional al prestării
activităţilor de medic este stabilit, de la caz la caz, de Ministerul Sănătăţii
Publice în funcţie de durata, frecvenţa, periodicitatea şi continuitatea
acestora.
Art. 393. - (1) Medicii cetăţeni ai unui stat membru al
Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene, stabiliţi în unul dintre aceste state, sunt exceptaţi
de la obligaţia înscrierii în Colegiul Medicilor din România, precum şi de la
plata cotizaţiei de membru, atunci când solicită accesul la una dintre
activităţile de medic, în vederea prestării temporare sau ocazionale de
servicii medicale în România.
(2) Aceştia sunt înregistraţi automat la Colegiul
Medicilor din România pe durata prestării serviciilor respective, în baza
copiei documentelor prestatorului prevăzute la art. 396 şi transmise în acest
scop de Ministerul Sănătăţii Publice.
(3) Exerciţiul activităţilor de medic, în aceste
situaţii, se face în concordanţă cu celelalte drepturi şi obligaţii prevăzute
de lege pentru medicii cetăţeni români membri ai Colegiului Medicilor din România.
Art. 394. - Pe durata prestării cu caracter temporar
sau ocazional a serviciilor medicale pe teritoriul României, persoanele
prevăzute la art. 392 alin. (1) se supun dispoziţiilor cu caracter profesional,
regulamentar ori administrativ al calificărilor profesionale care definesc
profesia şi utilizarea titlurilor, dispoziţiilor cu privire la faptele
profesionale grave care afectează direct şi specific protecţia şi securitatea
consumatorilor, precum şi dispoziţiilor disciplinare prevăzute de lege pentru
medicii cetăţeni români membri ai Colegiului Medicilor din România.
Art. 395. - Prestarea cu caracter temporar sau
ocazional a serviciilor medicale pe teritoriul României de către persoanele
prevăzute la art. 392 alin. (1) se face cu titlul profesional prevăzut de lege
pentru calificarea profesională însuşită.
Art. 396. - (1) Solicitările medicilor cetăţeni ai unui
stat membru al Uniunii Europene, ai unui stat aparţinând Spaţiului Economic
European sau ai Confederaţiei Elveţiene stabiliţi în unul dintre aceste state,
cu privire la prestarea temporară ori ocazională de servicii medicale în
România, se soluţionează de către Ministerul Sănătăţii Publice în colaborare cu
Colegiul Medicilor din România.
(2) In cazul în care, în vederea prestării temporare
de servicii medicale, solicitantul se află la prima deplasare în România sau în
cazul în care în situaţia acestuia intervin schimbări materiale atestate de
documente, acesta va înainta Ministerului Sănătăţii Publice:
a) o declaraţie prealabilă scrisă, în care se
precizează durata de prestare, natura, locul de desfăşurare a acestor
activităţi, precum şi domeniul de asigurare sau alte mijloace de protecţie
personală ori colectivă privind responsabilitatea profesională de care solicitantul
beneficiază în statul membru de stabilire;
b) copia documentului de cetăţenie;
c) o dovadă prin care autorităţile competente ale
statului membru de stabilire atestă că la data eliberării acestui document
posesorul este stabilit legal pe teritoriul său în vederea exercitării
activităţilor de medic şi nu i-a fost interzisă exercitarea acestora, nici
chiar cu titlu temporar;
d) diplomele, certificatele sau alte titluri de medic
prevăzute de lege ori de normele Uniunii Europene pentru prestarea
activităţilor în cauză.
(3) Declaraţia prevăzută la alin. (2) lit. a) poate
fi înaintată prin toate mijloacele şi se reînnoieşte o dată pe an, dacă
prestatorul intenţionează să furnizeze, de manieră temporară sau ocazională, în
cursul anului respectiv, servicii medicale în România.
Art. 397. - (1) In caz de prestare temporară a
serviciilor medicale în România, medicii cetăţeni ai unui stat membru al
Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene, stabiliţi în unul dintre aceste state, sunt exceptaţi
de la procedura de acreditare prevăzută de legislaţia asigurărilor sociale de
sănătate.
(2) Persoanele prevăzute la alin. (1) au obligaţia de a
informa în prealabil CNAS asupra serviciilor pe care urmează să le presteze pe
teritoriul României, iar în caz de urgenţă, în termen de maximum 7 zile de la
prestarea acestora.
Art. 398. - Incepând cu data aderării la Uniunea
Europeană, autorităţile competente române vor retrage, după caz, temporar sau
definitiv, documentele prevăzute la art. 396 alin. (2) lit. c), eliberate
medicilor care întrunesc condiţiile prevăzute la art. 370 lit. a), c) şi e),
precum şi medicilor stabiliţi în România care întrunesc condiţiile
prevăzute la art. 370 lit b), d) şi f), în cazul în
care acestora li se aplică sancţiunile prevăzute de lege cu suspendarea sau
interdicţia exercitării profesiei.
Art. 399. - (1) Pentru fiecare prestare de servicii,
autorităţile competente române pot solicita autorităţilor competente omoloage
din statul membru de stabilire informaţii pertinente cu privire la legalitatea
condiţiei de stabilire, buna conduită profesională a solicitantului, precum şi
la absenţa, în cazul acestuia, a sancţiunilor disciplinare sau penale.
(2) La solicitarea statului membru gazdă,
autorităţile competente române transmit informaţiile solicitate cu respectarea
prevederilor art. 403.
(3) Autorităţile competente asigură schimbul necesar
de informaţii pentru ca plângerea beneficiarului împotriva prestatorului de
servicii medicale în regim temporar şi ocazional să fie corect soluţionată. In
această situaţie, beneficiarul este informat asupra cursului demersului său.
SECŢIUNEA a 3-a
Dispoziţii comune cu privire la dreptul de
stabilire şi libera prestare de servicii medicale
Art. 400. - Medicii cetăţeni ai unui stat membru al
Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene care, în timpul exercitării profesiei în România,
încalcă dispoziţiile, legile şi regulamentele profesiei răspund potrivit legii.
Art. 401. - (1) Medicii cetăţeni ai unui stat membru al
Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene, care exercită profesia de medic în România, au dreptul
de a ataşa la titlul profesional prevăzut la art. 380 titlul legal de formare
obţinut în statul membru de origine ori de provenienţă, în limba statului
emitent şi, eventual, abrevierea acestui titlu. Titlul de formare va fi însoţit
de numele şi locul instituţiei sau ale organismului emitent.
(2) Dacă titlul respectiv de
formare desemnează în România o pregătire complementară neînsuşită de
beneficiar, acesta va utiliza în exerciţiul profesiei forma corespunzătoare a
titlului, indicată de autorităţile competente române.
Art. 402. - (1) Medicii cetăţeni ai unui stat membru al
Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene, stabiliţi şi care exercită profesia de medic în
România, au obligaţia de a se informa la autorităţile competente cu privire la
legislaţia din domeniul sănătăţii, domeniul securităţii sociale, precum şi cu
privire la Codul de deontologie medicală.
(2) In vederea furnizării informaţiilor prevăzute la
alin. (1), autorităţile române competente vor organiza, la nivelul structurilor
teritoriale şi centrale, birouri de informare legislativă.
(3) Medicii cetăţeni ai unui stat membru al Uniunii
Europene, ai unui stat aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene, care exercită profesia ca urmare a recunoaşterii
calificării profesionale de către autorităţile competente române, trebuie să
posede cunoştinţele lingvistice necesare desfăşurării activităţilor
profesionale în România.
Art. 403. - (1) Autorităţile competente române
colaborează îndeaproape cu autorităţile competente omoloage ale statelor membre
ale Uniunii Europene, ale statelor aparţinând Spaţiului Economic European şi,
respectiv, ale Confederaţiei Elveţiene, asigurând confidenţialitatea
informaţiilor transmise.
(2) Schimbul de informaţii privind sancţiunile
disciplinare sau penale aplicate în caz de fapte grave şi precise, susceptibile
de a avea consecinţe asupra activităţilor de medic, se va face cu respectarea prevederilor Legii nr. 506/2004
privind prelucrarea datelor cu caracter personal şi protecţia vieţii private în
sectorul comunicaţiilor electronice şi a prevederilor Legii nr. 677/2001 pentru
protecţia persoanelor cu privire la prelucrarea datelor cu caracter personal şi
libera circulaţie a acestor date, cu modificările şi completările ulterioare.
CAPITOLUL III
Organizarea şi funcţionarea Colegiului Medicilor din
România
SECŢIUNEA 1
Dispoziţii generale
Art. 404. - (1) Colegiul Medicilor din România este
organism profesional, apolitic, fără scop patrimonial, de drept public, cu
responsabilităţi delegate de autoritatea de stat, în domeniul autorizării,
controlului şi supravegherii profesiei de medic ca profesie liberală, de
practică publică autorizată.
(2) Colegiul Medicilor din România are autonomie
instituţională în domeniul său de competenţă, normativ şi jurisdicţional
profesional şi îşi exercită atribuţiile fără posibilitatea vreunei imixtiuni.
(3) Ministerul Sănătăţii Publice urmăreşte modul de
respectare a prevederilor legale în activitatea Colegiului Medicilor din România.
(4) Colegiul Medicilor din
România cuprinde toţi medicii care întrunesc condiţiile prevăzute la art. 370
lit. a), c) şi e), precum şi medicii stabiliţi în România care întrunesc
condiţiile prevăzute la art. 370 lit. b), d) şi f) şi care exercită profesia de
medic în condiţiile prezentei legi.
Art. 405. - (1) Colegiul Medicilor din România se
organizează şi funcţioneză pe criterii teritoriale, la nivel naţional şi
judeţean, respectiv la nivelul municipiului Bucureşti.
(2) Intre Colegiul Medicilor din România şi colegiile
teritoriale există raporturi de autonomie funcţională, organizatorică şi
financiară.
(3) Sediul Colegiului Medicilor din România este în
municipiul Bucureşti.
SECŢIUNEA a 2-a
Atribuţiile Colegiului Medicilor din România
Art. 406. - (1) Colegiul Medicilor din România are următoarele atribuţii:
a) asigură aplicarea regulamentelor şi normelor care
organizează şi reglementează exercitarea profesiei de medic, indiferent de
forma de exercitare şi de unitatea sanitară în care se desfăşoară;
b) apără demnitatea şi promovează drepturile şi
interesele membrilor săi în toate sferele de activitate; apără onoarea,
libertatea şi independenţa profesională ale medicului, precum şi dreptul
acestuia de decizie în exercitarea actului medical;
c) atestă onorabilitatea şi moralitatea profesională
ale membrilor săi;
d) întocmeşte, actualizează permanent Registrul unic
al medicilor, administrează pagina de Internet pe care este publicat acesta şi
înaintează trimestrial Ministerului Sănătăţii Publice un raport privind
situaţia numerică a membrilor săi, precum şi a evenimentelor înregistrate în
domeniul autorizării, controlului şi supravegherii profesiei de medic;
e) asigură respectarea de către medici a obligaţiilor
ce le revin faţă de pacient şi de sănătatea publică;
f) elaborează şi adoptă
Statutul Colegiului Medicilor din România şi Codul de deontologie medicală;
g) elaborează ghiduri şi protocoale de practică
medicală, pe niveluri de competenţe ale unităţilor sanitare, şi le propune spre
aprobare Ministerului Sănătăţii Publice. Elaborarea ghidurilor şi protocoalelor
de practică medicală poate fi delegată asociaţiilor profesional-ştiinţifice ale
medicilor;
h) stabileşte şi reglementează regimul de publicitate a
activităţilor medicale;
i) controlează modul în care sunt respectate de către
angajatori independenţa profesională a medicilor şi dreptul acestora de decizie
în exercitarea actului medical;
j) promovează şi stabileşte relaţii pe plan extern cu
instituţii şi organizaţii similare;
k) organizează judecarea cazurilor de abateri de la
normele de etică profesională, de deontologie medicală şi de la regulile de
bună practică profesională, în calitate de organ de jurisdicţie profesională;
l) promovează interesele
membrilor săi în cadrul asigurărilor de răspundere civilă profesională;
m) sprijină instituţiile şi acţiunile de prevedere şi
asistenţă medico-socială pentru medici şi familiile lor;
n) organizează centre de pregătire lingvistică,
necesare pentru exercitarea activităţii profesionale de către medicii cetăţeni
ai statelor membre ale Uniunii Europene, ai statelor aparţinând Spaţiului
Economic European sau ai Confederaţiei Elveţiene;
o) participă, împreună cu Ministerul Educaţiei şi
Cercetării şi cu Ministerul Sănătăţii Publice, la stabilirea numărului anual de
locuri în unităţile de învăţământ superior de profil medical acreditate, precum
şi a numărului de locuri în rezidenţiat;
p) colaborează cu organizaţii de profil
profesional-ştiinţific, patronal, sindical din domeniul sanitar şi cu
organizaţii neguvernamentale în toate problemele ce privesc asigurarea
sănătăţii populaţiei;
q) colaborează cu Ministerul Sănătăţii Publice la
elaborarea reglementărilor din domeniul medical sau al asigurărilor sociale de
sănătate;
r) propune criterii şi standarde de dotare a
cabinetelor de practică medicală independentă, indiferent de regimul
proprietăţii, şi le supune spre aprobare Ministerului Sănătăţii Publice.
(2) Colegiul Medicilor din România, prin structurile
naţionale sau teritoriale, colaborează în domeniul său de competenţă cu
Ministerul Sănătăţii Publice, cu instituţii, autorităţi şi organizaţii la:
a) formarea, specializarea şi perfecţionarea
pregătirii profesionale a medicilor;
b) stabilirea şi creşterea standardelor de practică
profesională în vederea asigurării calităţii actului medical în unităţile
sanitare;
c) elaborarea metodologiei de acordare a gradului
profesional şi tematica de concurs;
d) iniţierea şi promovarea de forme de educaţie
medicală continuă în vederea ridicării gradului de competenţă profesională a
membrilor săi;
e) elaborarea criteriilor şi standardelor de dotare a
cabinetelor de practică medicală independentă, pe care le supune spre aprobare
Ministerului Sănătăţii Publice;
f) promovarea şi asigurarea cadrului necesar
desfăşurării unei concurenţe loiale bazate exclusiv pe criteriile competenţei
profesionale;
g) reprezentarea medicilor cu practică independentă
care desfăşoară activităţi medicale în cadrul sistemului de asigurări sociale
de sănătate;
h) consultările privind normele de acordare a
asistenţei medicale în domeniul asigurărilor sociale de sănătate.
(3) Colegiul Medicilor din România avizează
înfiinţarea cabinetelor medicale private, indiferent de forma lor juridică, şi participă, prin reprezentanţi anume
desemnaţi, la concursurile organizate pentru ocuparea posturilor din unităţile
sanitare publice.
Art. 407. - In exercitarea atribuţiilor prevăzute de
prezenta lege, Colegiul Medicilor din România, prin structurile naţionale sau teritoriale,
are dreptul de a formula acţiune în justiţie în nume propriu sau în numele
membrilor săi.
SECŢIUNEA a 3-a
Membrii Colegiului Medicilor din România
Art. 408. - (1) In vederea exercitării profesiei de
medic, medicii cetăţeni români şi medicii cetăţeni ai unui stat membru al
Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene, stabiliţi în România, precum şi medicii care întrunesc
condiţiile prevăzute la art. 370 lit. c) şi e) au obligaţia să se înscrie în
Colegiul Medicilor din România.
(2) Calitatea de membru este
dovedită prin certificatul de membru al Colegiului Medicilor din România, care
se eliberează la înscrierea în corpul profesional.
(3) Inscrierea în Colegiul Medicilor din România şi
eliberarea certificatului de membru se fac numai pentru medicii care
îndeplinesc condiţiile prevăzute la art. 379 alin. (1) lit. a), b) si c) si au
depus jurământul prevăzut la art. 378 alin. (1).
(4) Depunerea jurământului se va menţiona în certificatul
de membru al Colegiului Medicilor din România.
(5) Pot deveni, la cerere,
membri ai Colegiului Medicilor din România şi medicii cetăţeni ai unui stat
membru al Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European
sau ai Confederaţiei Elveţiene, stabiliţi în unul dintre aceste state şi care
prestează temporar servicii medicale în România, cu respectarea prevederilor
alin. (3).
(6) Calitatea de membru al Colegiului Medicilor din
România o pot păstra, la cerere, şi medicii pensionari care au practicat
profesia de medic.
(7) La data intrării în vigoare a prezentei legi, au
de drept calitatea de membru al Colegiului Medicilor din România toţi medicii
înscrişi până la această dată.
(8) Membrii Colegiului Medicilor din România sunt
înscrişi în Registrul unic al medicilor din România, care se publică pe pagina
de Internet a Colegiului Medicilor din România.
(9) Evidenţa şi identificarea membrilor Colegiului
Medicilor din România se vor putea face şi prin folosirea codului numeric
personal.
Art. 409. - (1) La cerere, membrii Colegiului Medicilor din România care, din motive obiective, întrerup pe o durată de
până la 5 ani exercitarea profesiei de medic pot solicita suspendarea calităţii
de membru pe acea durată.
(2) Pe durata suspendării la cerere a calităţii de
membru al Colegiului Medicilor din România se suspendă obligaţiile şi
drepturile ce decurg din prezenta lege.
(3) Intreruperea exercitării profesiei de medic pe o
durată mai mare de 5 ani atrage, de drept, pierderea calităţii de membru al
Colegiului Medicilor din România.
Art. 410. - (1) Medicii care
îndeplinesc condiţiile prevăzute de art. 370 se pot înscrie ca membri ai
Colegiului Medicilor din România la colegiul teritorial în a cărui rază se află
unitatea la care urmează să îşi desfăşoare activitatea sau la colegiul
teritorial în a cărui rază îşi au domiciliul sau reşedinţa.
(2) Medicii luaţi în evidenţa unui colegiu teritorial,
dacă exercită activităţi medicale şi pe raza altui colegiu teritorial, sunt
obligaţi să anunţe şi acest colegiu.
SECŢIUNEA a 4-a
Drepturile şi obligaţiile membrilor Colegiului Medicilor din România
Art. 411. - Membrii Colegiului Medicilor din România au
următoarele drepturi:
a) să aleagă şi să fie aleşi în organele de conducere
de la nivelul structurilor teritoriale sau naţionale ale Colegiului Medicilor din România;
b) să se adreseze organelor abilitate ale Colegiului
Medicilor din România şi să primească informaţiile solicitate;
c) să participe la orice acţiune a Colegiului
Medicilor din România şi să fie informaţi în timp util despre aceasta;
d) să folosească, împreună cu membrii lor de familie,
toate dotările sociale, profesionale, culturale şi sportive ale Colegiului
Medicilor din România şi ale colegiilor teritoriale;
e) să poarte însemnele Colegiului Medicilor din
România;
f) să conteste sancţiunile
primite;
g) să solicite ajutoare materiale pentru situaţii
deosebite, atât personal, cât şi prin membrii lor de familie.
Art. 412. - Obligaţiile membrilor Colegiului Medicilor
din România sunt următoarele:
a) să facă dovada cunoaşterii normelor de deontologie
profesională şi a celor care reglementează organizarea şi funcţionarea corpului
profesional; modalitatea de testare a cunoştinţelor de deontologie şi a
legislaţiei profesionale se stabileşte de Consiliul naţional al Colegiului
Medicilor din România;
b) să respecte dispoziţiile Statutului Colegiului
Medicilor din România, ale Codului de deontologie medicală, hotărârile
organelor de conducere ale Colegiului Medicilor din România şi regulamentele
profesiei;
c) să rezolve sarcinile ce le-au fost încredinţate în
calitate de membru sau de reprezentant al corpului profesional;
d) să participe la manifestările iniţiate de organele
de conducere, la activităţile profesionale sau de pregătire profesională
iniţiate ori organizate de către organele de conducere naţionale sau locale;
e) să participe la şedinţele ori adunările la care au
fost convocaţi;
f) să execute cu bună-credinţă sarcinile ce decurg din
hotărârile organelor de conducere ale Colegiului Medicilor din România;
g) să se abţină de la deliberările organelor de
conducere în care sunt aleşi, în cazul în care, în îndeplinirea unor atribuţii
ale acestor organe, au un interes propriu;
h) să păstreze secretul profesional;
i) să păstreze confidenţialitatea asupra dezbaterilor,
opiniilor şi voturilor exprimate în organele de
conducere;
j) să respecte normele, principiile şi îndatoririle
deontologiei medicale;
k) să aibă un comportament demn în exercitarea
profesiei ori a calităţii de membru al Colegiului Medicilor din România;
l) să achite, în termenul
stabilit, cotizaţia datorată în calitate de membru al Colegiului Medicilor din
România;
m) să rezolve litigiile cu alţi membri, în primul rând
prin mediere de către comisiile organizate în acest scop în cadrul Colegiului
Medicilor din România;
n) să execute cu bună-credinţă atribuţiile ce le revin
în calitate de reprezentant sau membru în organele de conducere ale Colegiului
Medicilor din România, în colegiile judeţene sau în Colegiul Medicilor
Municipiului Bucureşti.
Art. 413. - Obligaţiile membrilor Colegiului Medicilor
din România, ce decurg din calitatea lor specială de medici, sunt:
a) să respecte şi să aplice, în orice împrejurare,
normele de deontologie medicală;
b) să nu aducă prejudicii reputaţiei corpului medical
sau altor membri, respectând statutul de corp
profesional al Colegiului Medicilor din România;
c) să acorde, cu promptitudine şi necondiţionat,
îngrijirile medicale de urgenţă, ca o îndatorire fundamentală profesională şi
civică;
d) să acţioneze, pe toată durata exercitării
profesiei, în vederea creşterii gradului de pregătire profesională;
e) să aplice parafa, cuprinzând numele, prenumele,
gradul, specialitatea şi codul, pe toate actele medicale pe care le semnează;
f) să respecte drepturile pacienţilor.
Art. 414. - (1) In vederea
creşterii gradului de pregătire profesională şi asigurării unui nivel ridicat
al cunoştinţelor medicale, medicii sunt obligaţi să efectueze un număr de
cursuri de pregătire şi alte forme de educaţie medicală continuă şi informare
în domeniul ştiinţelor medicale, pentru cumularea numărului de credite
stabilite în acest sens de către Colegiul Medicilor din România. Sunt creditate
programele, precum şi celelalte forme de educaţie medicală continuă avizate de
Colegiul Medicilor din România.
(2) Medicii care nu realizează
pe parcursul a 5 ani numărul minim de credite de educaţie medicală continuă,
stabilit de Consiliul naţional al Colegiului Medicilor din România, sunt
suspendaţi din exerciţiul profesiei până la realizarea numărului de credite
respectiv.
SECŢIUNEA a 5-a
Organizare şi funcţionare
A. Organizarea la nivel teritorial
Art. 415. - (1) La nivelul fiecărui judeţ, respectiv la
nivelul municipiului Bucureşti, se organizează câte un colegiu al medicilor,
format din toţi medicii care exercită profesia în unitatea
administrativ-teritorială respectivă, denumit în continuare colegiul teritorial.
(2) Colegiile teritoriale ale medicilor au
personalitate juridică, patrimoniu şi buget proprii. Patrimoniul se constituie
din bunuri mobile şi imobile, dobândite în condiţiile legii.
(3) Sediul colegiului teritorial al medicilor este în
oraşul de reşedinţă a judeţului, respectiv în municipiul Bucureşti, pentru
Colegiul Medicilor Municipiului Bucureşti.
(4) Nici un colegiu teritorial nu poate funcţiona în
afara Colegiului Medicilor din România.
Art. 416. - Organele de conducere ale colegiului
teritorial sunt:
a) adunarea generală;
b) consiliul;
c) biroul consiliului;
d) preşedintele.
Art. 417. - (1) Adunarea generală este formată din
medicii înscrişi la colegiul teritorial respectiv.
(2) Adunarea generală se întruneşte anual, în primul
trimestru, la convocarea consiliului, şi adoptă hotărâri cu majoritate simplă
în prezenţa a două treimi din numărul membrilor săi. Dacă la prima convocare nu
s-a realizat majoritatea de două treimi, după 10 zile se organizează o nouă
şedinţă, cu aceeaşi ordine de zi, care va adopta hotărâri cu majoritate simplă,
indiferent de numărul membrilor prezenţi.
(3) Adunarea generală are următoarele atribuţii:
a) alege membrii consiliului
şi comisia de cenzori a colegiului teritorial;
b) alege reprezentanţii în Adunarea generală
naţională;
c) aprobă proiectul de buget al colegiului şi, în
baza raportului cenzorilor, descarcă de gestiune consiliul pentru anul fiscal
încheiat;
d) stabileşte indemnizaţia de
şedinţă a membrilor comisiei de disciplină.
(4) Modalitatea de exprimare a votului se stabileşte
prin regulamentul electoral.
Art. 418. - Membrii consiliului colegiului teritorial,
membrii comisiei de cenzori a colegiului teritorial şi
membrii în Adunarea generală naţională se aleg pe o perioadă de 4 ani de către
membrii colegiului teritorial respectiv, potrivit regulamentului electoral,
aprobat de Consiliul naţional al Colegiului Medicilor din România.
Art. 419. - (1) Consiliul are
un număr de membri proporţional cu numărul medicilor înscrişi în evidenţa
colegiului la data organizării alegerilor, după cum urmează:
a) 11 membri, pentru un număr de până la 500 de
medici înscrişi;
b) 13 membri, pentru un număr de la 501 până la 1.000
de medici înscrişi;
c) 19 membri, pentru un număr de la 1.001 până la
2.000 de medici înscrişi;
d) 21 de membri, pentru un număr de peste 2.000 de
medici înscrişi.
(2) Consiliul constituit la nivelul municipiului
Bucureşti este format din 23 de membri.
(3) Proporţional cu numărul de membri ai consiliului
se vor alege 3-9 membri supleanţi.
Art. 420. - Consiliul colegiului teritorial exercită
atribuţiile prevăzute de lege şi date în competenţa sa prin Statutul Colegiului
Medicilor din România sau prin hotărâre a Consiliului naţional.
Art. 421. - (1) Consiliul colegiului teritorial, în
prima şedinţă, organizată în termen de maximum 5 zile de la alegere, alege
biroul consiliului.
(2) Biroul consiliului colegiului teritorial este
format dintr-un preşedinte, 3 vicepreşedinţi şi un
secretar.
(3) Preşedintele biroului consiliului colegiului
teritorial este şi preşedintele colegiului teritorial.
B. Organizarea la nivel
naţional
Art. 422. - (1) Colegiul Medicilor din România este
format din toţi medicii înscrişi în colegiile teritoriale.
(2) Colegiul Medicilor din România are personalitate
juridică, patrimoniu şi buget proprii. In bugetul propriu sunt cuprinse şi
contribuţiile colegiilor teritoriale în cotă fixă de 20% din cuantumul
cotizaţiilor. Patrimoniul poate fi folosit şi în activităţi producătoare de
venituri, în condiţiile legii.
Art. 423. - Organele de conducere la nivel naţional ale
Colegiului Medicilor din România sunt:
a) Adunarea generală naţională;
b) Consiliul naţional;
c) Biroul executiv;
d) preşedintele.
Art. 424. - (1) Adunarea generală naţională este
alcătuită din membrii Consiliului naţional al Colegiului Medicilor din România
şi din reprezentanţii fiecărui colegiu teritorial, aleşi potrivit
regulamentului electoral prevăzut la art. 418.
(2) Norma de reprezentare în Adunarea generală
naţională este de 1/200 de membri.
(3) Reprezentanţii în Adunarea generală naţională sunt
aleşi pe o durată de 4 ani.
(4) Proporţional cu numărul de medici înscrişi în
evidenţa colegiului teritorial se va alege un număr de 3 - 11 membri supleanţi.
Art. 425. - Adunarea generală naţională are următoarele
atribuţii:
a) adoptă Statutul Colegiului Medicilor din România,
precum şi Codul de deontologie medicală;
b) aprobă modificarea acestora;
c) aprobă bugetul de venituri
şi cheltuieli şi execuţia celui pentru exerciţiul expirat;
d) alege, dintre membrii săi, comisia de cenzori;
e) adoptă puncte de vedere care să reflecte poziţia
Colegiului Medicilor din România cu privire la aspecte de interes general în
ceea ce priveşte profesia de medic ori statutul medicului în societate;
f) revocă din funcţie membrii aleşi pentru abateri de
la prevederile prezentei legi şi, respectiv, ale Regulamentului de organizare
şi funcţionare a Colegiului Medicilor din România, care aduc prejudicii
activităţii corpului profesional.
Art. 426. - (1) Adunarea generală naţională adoptă hotărâri
în prezenţa a cel puţin două treimi din numărul membrilor săi, cu majoritate
simplă de voturi.
(2) Dacă la prima convocare nu se realizează condiţia
de cvorum, după două săptămâni se va organiza o altă şedinţă, cu aceeaşi ordine
de zi, care va putea adopta hotărâri indiferent de numărul membrilor prezenţi,
cu excepţia situaţiilor prevăzute la art. 425 lit. a) şi b), pentru care este
necesară condiţia de cvorum prevăzută la alin. (1).
(3) Adunarea generală naţională se întruneşte în
şedinţă ordinară în trimestrul I al anului în curs.
Art. 427. - Adunarea generală naţională este condusă de
către preşedintele Colegiului Medicilor din România.
Art. 428. - Adunarea generală naţională poate fi
convocată de către:
a) preşedintele Colegiului Medicilor din România;
b) 3 dintre membrii Biroului executiv;
c) o treime din numărul membrilor Consiliului naţional
al Colegiului Medicilor din România.
Art. 429. - (1) Consiliul naţional al Colegiului
Medicilor din România este alcătuit din câte un reprezentant al fiecărui judeţ,
din 3 reprezentanţi ai municipiului Bucureşti şi câte un reprezentant al
medicilor din fiecare minister şi instituţie centrală cu reţea sanitară
proprie. In afară de aceştia, Consiliul naţional al Colegiului Medicilor din
România poate fi asistat, cu rol consultativ, de câte un reprezentant al
Ministerului Sănătăţii Publice, Academiei de Ştiinţe Medicale, Ministerului
Muncii, Solidarităţii Sociale şi Familiei şi Ministerului Justiţiei.
(2) Reprezentanţii colegiilor teritoriale în
Consiliul naţional al Colegiului Medicilor din România sunt aleşi pe o perioadă
de 4 ani de către membrii consiliilor şi reprezentanţii colegiilor teritoriale
în Adunarea generală naţională întruniţi într-o şedinţă comună.
(3) Cheltuielile cu deplasarea şi diurna
reprezentanţilor în Consiliul naţional al Colegiului Medicilor din România vor
fi suportate de colegiile teritoriale ai căror reprezentanţi sunt.
(4) Consiliul naţional al Colegiului Medicilor din
România se întruneşte legal în prezenţa a cel puţin două treimi din numărul
reprezentanţilor stabiliţi la alin. (1) şi ia decizii cu majoritate simplă de
voturi.
Art. 430. - Deciziile Consiliului naţional al Colegiului Medicilor din România sunt obligatorii
pentru colegiile teritoriale şi pentru toţi medicii care practică medicina în
România.
Art. 431. - Atribuţiile Consiliului naţional al
Colegiului Medicilor din România sunt următoarele:
a) elaborează Statutul
Colegiului Medicilor din România, precum şi proiectele de modificare a
acestuia;
b) elaborează Codul de deontologie medicală, precum şi
proiectele de modificare a acestuia;
c) colaborează cu Ministerul Sănătăţii Publice la
elaborarea de norme privind exercitarea profesiei de
medic pe teritoriul României;
d) colaborează cu Ministerul Sănătăţii Publice la
elaborarea Nomenclatorului de specialităţi medicale, medico-dentare şi
farmaceutice pentru reţeaua de asistenţă medicală;
e) colaborează cu Ministerul
Sănătăţii Publice la elaborarea tematicilor şi a metodologiilor concursurilor
şi examenelor pentru medici;
f) stabileşte sistemul de credite de educaţie
medicală continuă, pe baza căruia se evaluează activitatea de perfecţionare
profesională a medicilor;
g) colaborează cu Ministerul Sănătăţii Publice la
elaborarea criteriilor medicale de selecţie a pacienţilor în cazul unor tipuri
de tratamente disponibile în număr limitat;
h) înaintează spre aprobare Ministerului Sănătăţii
Publice ghidurile şi protocoalele de practică medicală elaborate în condiţiile
art. 406 alin. (1) lit. g);
i) fixează cotizaţia care trebuie plătită obligatoriu
de către fiecare medic colegiului teritorial;
j) gestionează bunurile Colegiului Medicilor din
România şi poate să iniţieze şi să subvenţioneze acţiuni interesând profesia
medicală, acţiuni de întrajutorare sau de sponsorizare;
k) soluţionează, prin comisiile de specialitate, în
termen de 30 de zile de la înregistrare, contestaţiile formulate împotriva
deciziilor date de consiliile judeţene, respectiv de Consiliul General al
Municipiului Bucureşti, în conformitate cu regulamentele proprii;
l) alege dintre membrii săi
Biroul executiv al Colegiului Medicilor din România;
m) propune Adunării generale naţionale proiectul
privind bugetul de venituri şi cheltuieli al Colegiului Medicilor din România;
n) alege dintre membrii Colegiului Medicilor din România
pe cei care vor forma comisiile de lucru;
o) stabileşte indemnizaţiile membrilor Biroului
executiv şi indemnizaţia de şedinţă a membrilor Comisiei superioare de
disciplină;
p) stabileşte condiţiile privind desfăşurarea de către
cabinetele şi unităţile medicale a publicităţii, iar prin comisia de
specialitate aprobă conţinutul materialului publicitar;
r) reprezintă, în condiţiile art. 406 alin. (2),
membrii săi la elaborarea contractului-cadru şi negocierea normelor de acordare
a asistenţei medicale în domeniul asigurărilor sociale de sănătate.
Art. 432. - Consiliul naţional al Colegiului Medicilor
din România aprobă exercitarea ocazională, cu caracter didactic, de instruire,
informare şi schimb de experienţă, a profesiei de medic de către medicii care
nu au calitatea de membru al Colegiului Medicilor din România.
Art. 433. - Consiliul naţional al Colegiului Medicilor
din România stabileşte, în domeniul său de competenţă, strategia şi planul
anual de control şi supraveghere a modului de exercitare a profesiei de medic.
Art. 434. - Biroul executiv al Colegiului Medicilor din
România este format dintr-un preşedinte, 3 vicepreşedinţi şi un secretar
general, aleşi în mod individual de către Consiliul naţional, dintre membrii
săi, pe o durată de 4 ani.
Art. 435. - (1) Biroul executiv al Colegiului Medicilor
din România lucrează legal în prezenţa a cel puţin 3 dintre membrii săi şi
aprobă deciziile cu votul a cel puţin 3 membri.
(2) Biroul executiv se întruneşte o dată pe săptămână
sau ori de câte ori este cazul, la cererea preşedintelui sau a cel puţin 2
dintre membrii săi. In condiţiile stabilite de Statutul Colegiului Medicilor
din România, votul poate fi exprimat şi prin corespondenţă sau în format electronic.
Art. 436. - Atribuţiile Biroului executiv al Colegiului
Medicilor din România sunt următoarele:
a) asigură activitatea permanentă a Colegiului
Medicilor din România între şedinţele Consiliului naţional;
b) aprobă angajarea de personal şi asigură execuţia
bugetului Colegiului Medicilor din România;
c) întocmeşte raportul anual de activitate şi
gestiune, pe care îl supune spre aprobare Consiliului naţional;
d) acceptă donaţiile,
legatele şi sponsorizările făcute Colegiului Medicilor din România;
e) execută hotărârile Adunării generale naţionale şi
ale Consiliului naţional;
f) elaborează şi supune spre avizare Consiliului
naţional proiectul bugetului de venituri şi cheltuieli,
pe baza bugetelor locale;
g) informează Consiliul naţional cu privire la
deciziile emise între şedinţele Consiliului;
h) îndeplineşte orice alte sarcini stabilite de către
Consiliul naţional.
Art. 437. - Biroul executiv al Colegiului Medicilor din România coordonează activitatea comisiilor de lucru ale
Consiliului naţional al Colegiului Medicilor din România.
Art. 438. - In exercitarea mandatului, membrii Biroului
executiv, precum şi membrii birourilor consiliilor colegiilor teritoriale vor
primi o indemnizaţie lunară, al cărei cuantum va fi aprobat, după caz, de
Consiliul naţional, respectiv de consiliile colegiilor teritoriale.
Art. 439. - Preşedintele Biroului executiv al
Consiliului naţional este preşedintele Colegiului Medicilor din România.
Art. 440. - Preşedintele Colegiului Medicilor din
România îndeplineşte următoarele atribuţii:
a) reprezintă Colegiul Medicilor din România în
relaţiile cu persoanele fizice şi juridice din ţară şi străinătate;
b) încheie contracte şi convenţii în numele Colegiului Medicilor din România, cu aprobarea Biroului executiv;
c) convoacă şi conduce şedinţele adunării generale şi
ale Consiliului naţional;
d) duce la îndeplinire deciziile Biroului executiv,
hotărârile Consiliului naţional date în sarcina sa şi rezolvă problemele şi
lucrările curente;
e) angajează personalul de specialitate şi
administrativ;
f) îndeplineşte orice alte sarcini stabilite de
Consiliul naţional ori de Biroul executiv, potrivit legii.
Art. 441. - (1) Nu pot primi sau exercita mandatul de membru al organelor de conducere ale Colegiului Medicilor
din România, atât la nivel naţional, cât şi teritorial, medicii care deţin
funcţii de conducere în cadrul Ministerului Sănătăţii Publice, respectiv al
ministerelor şi instituţiilor cu reţea sanitară proprie, al structurilor
deconcentrate ale acestuia ori în cadrul Casei Naţionale de Asigurări de
Sănătate, al caselor judeţene de asigurări de sănătate şi a municipiului
Bucureşti, al patronatelor şi sindicatelor profesionale, precum şi orice fel de
funcţii de demnitate publică.
(2) Medicii pentru care, în timpul mandatului de
membru al organelor de conducere, a survenit situaţia de incompatibilitate sunt
suspendaţi din funcţie. Suspendarea durează până la încetarea situaţiei de
incompatibilitate sau până la expirarea mandatului.
(3) Numărul de mandate în organele de conducere de la
nivel teritorial şi naţional este de maximum două, care pot fi şi consecutive.
(4) Dispoziţiile alin. (1) -(3) nu se aplică
persoanelor care la data intrării în vigoare a prezentei legi îndeplinesc, în
baza reglementărilor aflate în vigoare anterior, vreuna dintre funcţiile
menţionate până la expirarea mandatului pentru care au fost alese.
SECŢIUNEA a 6-a
Răspunderea disciplinară
Art. 442. - (1) Medicul răspunde disciplinar pentru
nerespectarea legilor şi regulamentelor profesiei medicale, a Codului de deontologie medicală şi a
regulilor de bună practică profesională, a Statutului Colegiului Medicilor din
România, pentru nerespectarea deciziilor obligatorii adoptate de organele de
conducere ale Colegiului Medicilor din România, precum şi pentru orice fapte
săvârşite în legătură cu profesia, care sunt de natură să prejudicieze onoarea
şi prestigiul profesiei sau ale Colegiului Medicilor
din România.
(2) Răspunderea disciplinară a membrilor Colegiului
Medicilor din România, potrivit prezentei legi, nu exclude răspunderea penală,
contravenţională sau civilă, conform prevederilor legale.
Art. 443. - (1) Plângerea împotriva unui medic se depune la colegiul al cărui membru este medicul. In cazul medicilor
cetăţeni ai unui stat membru al Uniunii Europene, ai unui stat aparţinând
Spaţiului Economic European sau ai Confederaţiei Elveţiene, plângerea se depune
la colegiul în a cărui rază medicul îşi desfăşoară activitatea.
(2) Biroul executiv al Consiliului naţional dispune
trimiterea dosarului disciplinar la comisia de disciplină.
(3) Impotriva deciziei de respingere a plângerii
persoana care a făcut plângerea poate depune contestaţie la colegiul a cărui
decizie se contestă. Aceasta se soluţionează de către Biroul executiv al Consiliului
naţional.
(4) Plângerile împotriva unui membru al organelor de
conducere de la nivel teritorial sau naţional se înaintează Comisiei superioare
de disciplină.
Art. 444. - (1) In cadrul fiecărui colegiu teritorial
se organizează şi funcţionează comisia de disciplină, independentă de
conducerea colegiului, care judecă în complete de 3 membri abaterile
disciplinare săvârşite de medicii înscrişi în acel colegiu.
(2) La nivelul Colegiului
Medicilor din România se organizează şi funcţionează Comisia superioară de
disciplină, independentă de conducerea colegiului, care judecă în complete de 5
membri contestaţiile formulate împotriva deciziilor comisiilor de disciplină
teritoriale.
(3) Unul dintre membrii comisiilor de disciplină este
desemnat de autorităţile de sănătate publică, la nivel teritorial, şi de
Ministerul Sănătăţii Publice, la nivelul Comisiei superioare de disciplină.
(4) Procedura judecării abaterilor este prevăzută în
Statutul Colegiului Medicilor din România.
Art. 445. - (1) Membrii comisiilor de disciplină de la
nivelul colegiului teritorial sunt aleşi de adunarea generală a colegiului, iar
membrii Comisiei superioare de disciplină vor fi aleşi de Adunarea generală
naţională.
(2) Membrii comisiilor de disciplină vor fi aleşi din
rândul medicilor primari cu o vechime în profesie de peste 7 ani şi care nu au
avut abateri disciplinare în ultimii 5 ani.
(3) Funcţia de membru al comisiei de disciplină este
incompatibilă cu orice altă funcţie în cadrul Colegiului Medicilor din România.
(4) Durata mandatului membrilor comisiilor de
disciplină este de 6 ani.
(5) Calitatea de membru al comisiilor de disciplină
încetează prin deces, demisie, pierderea calităţii de membru al Colegiului
Medicilor din România ori prin numirea unui alt reprezentant în cazul membrilor
desemnaţi de către Ministerul Sănătăţii Publice sau autoritatea de sănătate
publică.
Art. 446. - (1) Membrii comisiilor de disciplină se
aleg prin vot secret şi pe baza candidaturilor depuse.
(2) La nivel teritorial se va alege un număr de 5-9
membri, iar la nivel naţional, 13.
(3) Membrii comisiilor de disciplină îşi vor alege un
preşedinte care conduce activitatea administrativă a comisiilor de disciplină.
(4) Preşedintele comisiei de disciplină prezintă adunării
generale raportul anual al activităţii comisiei de disciplină. Art. 447. - (1)
Sancţiunile disciplinare sunt:
a) mustrare;
b) avertisment;
c) vot de blam;
d) amendă de la 100 lei (RON) la 1.500 lei (RON).
Plata amenzii se va face în termen de 30 de zile de la data rămânerii
definitive a hotărârii disciplinare. Neachitarea în acest termen atrage
suspendarea de drept din exerciţiul profesiei, până la achitarea sumei. Sumele
provenite din plata amenzilor se fac venit integral la
bugetul Colegiului Medicilor din România;
e) interdicţia de a exercita profesia ori anumite
activităţi medicale pe o perioadă de la o lună la un an;
f) retragerea calităţii de membru al Colegiului
Medicilor din România.
(2) Retragerea calităţii de membru al Colegiului Medicilor
din România operează de drept pe durata stabilită prin hotărâre definitivă de
instanţele judecătoreşti cu privire la interzicerea exercitării profesiei.
(3) La sancţiunile prevăzute la alin. (1) se poate
prevedea, după caz, obligarea celui sancţionat la efectuarea unor cursuri de
perfecţionare sau de educaţie medicală ori alte forme de pregătire
profesională.
Art. 448. - (1) Decizia pronunţată se comunică
medicului sancţionat şi Biroului executiv al Colegiului
Medicilor din România.
(2) Deciziile privind aplicarea sancţiunilor care se
soldează cu suspendarea sau interzicerea exercitării profesiei se comunică şi
Ministerului Sănătăţii Publice şi, respectiv, angajatorului.
(3) Persoana fizică sau
juridică care a făcut sesizarea va fi informată cu privire la soluţionarea
cauzei de către comisia de disciplină.
(4) In termen de 15 zile de la comunicare, medicul
sancţionat, persoana care a făcut sesizarea, Ministerul Sănătăţii Publice,
preşedintele colegiului teritorial sau preşedintele Colegiului Medicilor din
România poate contesta decizia pronunţată de comisia de disciplină a colegiului
teritorial.
Art. 449. - (1) Acţiunea disciplinară poate fi pornită
în termen de cel mult 6 luni de la data săvârşirii faptei sau de la data
cunoaşterii consecinţelor prejudiciabile.
(2) Sancţiunile prevăzute la art. 447 alin. (1) lit.
a)-d) se radiază în termen de 6 luni de la data executării lor, iar cea
prevăzută la lit. e), în termen de un an de la data expirării perioadei de
interdicţie.
(3) In cazul aplicării sancţiunii prevăzute la art.
447 alin. (1) lit. f), medicul poate face o nouă cerere de redobândire a
calităţii de membru al colegiului după expirarea perioadei stabilite prin
hotărâre judecătorească definitivă de interdicţie a exercitării profesiei sau după
2 ani de la data aplicării sancţiunii de către comisiile de disciplină.
Redobândirea calităţii de membru al Colegiului Medicilor din România se face în
condiţiile prezentei legi.
(4) In situaţia în care, prin
decizia comisiei de disciplină, au fost dispuse şi măsurile prevăzute la art.
447 alin. (3), radierea sancţiunii se va face numai după prezentarea dovezii
ducerii la îndeplinire a măsurii dispuse de comisia de disciplină.
(5) Repetarea unei abateri
disciplinare până la radierea sancţiunii aplicate constituie o circumstanţă
agravantă, care va fi avută în vedere la aplicarea noii sancţiuni.
Art. 450. - (1) Ancheta disciplinară se exercită prin
persoane desemnate în acest scop de către biroul consiliului colegiului
teritorial sau, după caz, de către Biroul executiv al Colegiului Medicilor din
România.
(2) Unităţile sanitare sau cele de medicină legală au
obligaţia de a pune la dispoziţie comisiilor de disciplină sau persoanelor
desemnate cu investigarea abaterilor disciplinare documentele medicale solicitate,
precum şi orice alte date şi informaţii necesare soluţionării cauzei.
Art. 451. - Impotriva deciziei de sancţionare a
Comisiei superioare de disciplină, în termen de 15 zile de la comunicare,
medicul sancţionat poate formula o acţiune în anulare la secţia de contencios
administrativ a tribunalului în a cărui rază îşi desfăşoară activitatea.
SECŢIUNEA a 7-a
Venituri şi cheltuieli
Art. 452. - Veniturile Colegiului Medicilor din România
se constituie din:
a) taxa de înscriere;
b) cotizaţiile lunare ale membrilor;
c) contravaloarea serviciilor prestate membrilor sau
persoanelor fizice şi juridice, inclusiv din organizarea de cursuri şi alte
forme de educaţie medicală continuă;
d) donaţii şi sponsorizări de la persoane fizice şi
juridice;
e) legate;
f) drepturi editoriale;
g) încasări din vânzarea publicaţiilor proprii;
h) fonduri rezultate din manifestările culturale şi
ştiinţifice;
i) alte surse.
Art. 453. - (1) Cotizaţiile datorate şi neplătite în
termenul fixat de consiliul colegiului teritorial de către membrii Colegiului
Medicilor din România determină plata unor majorări de întârziere în cuantumul
prevăzut de dispoziţiile legale aplicabile instituţiilor publice.
(2) Aceeaşi penalitate se va
aplica şi colegiilor teritoriale care nu varsă partea de cotizaţie datorată.
Art. 454. - (1) Neplata cotizaţiei datorate de membrii
Colegiului Medicilor din România pe o perioadă de 6 luni şi după atenţionarea
scrisă a consiliului colegiului teritorial se sancţionează cu suspendarea
calităţii de membru până la plata cotizaţiei datorate.
(2) Sancţiunea se aplică de către comisia de disciplină
a colegiului teritorial, la sesizarea comisiei administrative şi
financiar-contabile a colegiului teritorial.
Art. 455. - Pentru serviciile prestate persoanelor care
nu sunt membre ale Colegiului Medicilor din România, tarifele se stabilesc,
după caz, de Consiliul naţional, respectiv de consiliul colegiului teritorial.
Art. 456. - Veniturile pot fi
utilizate pentru cheltuieli cu organizarea şi funcţionarea, cheltuieli de
personal, cheltuieli materiale şi servicii, cheltuieli de capital,
perfecţionarea pregătirii profesionale, acordarea de burse prin concurs
medicilor, întrajutorarea medicilor cu venituri mici, crearea de instituţii cu
scop filantropic şi ştiinţific, acordarea de premii pentru membrii cu
activităţi profesionale deosebite, alte cheltuieli aprobate, după caz, de
consiliul colegiului teritorial, respectiv de Consiliul naţional al Colegiului Medicilor din România.
CAPITOLUL IV
Rolul, atribuţiile şi drepturile autorităţii de stat
Art. 457. - Ministerul Sănătăţii Publice, în calitate
de autoritate de stat, urmăreşte ca activitatea Colegiului Medicilor din
România să se desfăşoare în condiţiile legii.
Art. 458. - Reprezentantul autorităţii de stat cu
rangul de secretar de stat în Ministerul Sănătăţii Publice este membru al
Consiliului naţional al Colegiului Medicilor din România şi este numit prin
ordin al ministrului sănătăţii publice.
Art. 459. - In cazul în care
reprezentantul autorităţii de stat constată că nu sunt respectate prevederile
legale, acesta sesizează organele de conducere ale Colegiului Medicilor din
România. In termen de 15 zile de la efectuarea demersului, acestea adoptă
măsurile necesare de încadrare în normele în vigoare şi informează Ministerul
Sănătăţii Publice în acest sens.
Art. 460. - In cazul nerespectării prevederilor art.
459, Ministerul Sănătăţii Publice se adresează instanţelor judecătoreşti
competente.
CAPITOLUL V
Dispoziţii tranzitorii şi finale
Art. 461. - In vederea facilitării accesului la
exerciţiul profesiei de medic pe teritoriul României, Ministerul Sănătăţii
Publice în colaborare cu Colegiul Medicilor din România recunoaşte calificările
de medic dobândite în conformitate cu normele Uniunii Europene într-un stat
membru al Uniunii Europene, într-un stat aparţinând Spaţiului Economic European
sau în Confederaţia Elveţiană de cetăţenii acestor state, iar încadrarea în
muncă se face conform legii.
Art. 462. - (1) Normele privind
recunoaşterea diplomelor, certificatelor şi titlurilor de medic, eliberate de
un stat membru al Uniunii Europene, de un stat aparţinând Spaţiului Economic
European şi de Confederaţia Elveţiană cetăţenilor acestora, se elaborează de
Ministerul Sănătăţii Publice în colaborare cu Colegiul Medicilor din România şi
se aprobă prin hotărâre a Guvernului.
(2) Nomenclatorul de specialităţi medicale,
medico-dentare şi farmaceutice pentru reţeaua de asistenţă medicală se
elaborează de Ministerul Sănătăţii Publice şi se aprobă prin ordin al
ministrului sănătăţii publice.
(3) Normele privind întocmirea, emiterea şi
utilizarea dovezilor de onorabilitate şi moralitate profesională ale medicilor
se elaborează în colaborare de autorităţile competente române definite de
prezenta lege şi se aprobă prin hotărâre a Guvernului.
Art. 463. - (1) Atribuţiile Colegiului Medicilor din
România nu pot fi exercitate de nici o altă asociaţie profesională.
(2) Colegiul Medicilor din România nu se poate
substitui organizaţiilor patronale sau sindicale şi în
îndeplinirea atribuţiilor sale nu poate face uz de prerogativele acestora
prevăzute de lege.
(3) Membrii Colegiului Medicilor din România pot face
parte şi din alte asociaţii profesionale.
Art. 464. - Statutul Colegiului
Medicilor din România, Codul de deontologie medicală, cu modificările şi
completările ulterioare, precum şi deciziile Consiliului naţional care privesc
organizarea şi funcţionarea Colegiului Medicilor din România sau drepturile şi
obligaţiile acestora ca membri ai Colegiului Medicilor din România se publică
în Monitorul Oficial al României, Partea I.
Art. 465. - Pe durata exercitării profesiei în regim
salarial sau/şi independent medicul este obligat să încheie o asigurare de
răspundere civilă pentru greşeli în activitatea profesională.
Art. 466. - (1) Medicii care ocupă funcţii publice în
cadrul aparatului central al Ministerului Sănătăţii Publice, în cadrul
autorităţilor de sănătate publică judeţene şi a municipiului Bucureşti, în
cadrul Casei Naţionale de Asigurări de Sănătate şi, respectiv, în cadrul
caselor de asigurări de sănătate judeţene şi a municipiului Bucureşti, precum
şi cei din cadrul ministerelor sau instituţiilor centrale cu reţele sanitare
proprii pot desfăşura în afara programului normal de lucru, în condiţiile legii,
activităţi profesionale,
potrivit calificării pe care o deţin. Prevederile se aplică, cu respectarea
reglementărilor legale referitoare la conflictul de interese şi
incompatibilităţi stabilite pentru sistemul sanitar, iar activităţile
profesionale se desfăşoară exclusiv în unităţi sanitare private.
(2) Medicilor prevăzuţi la alin. (1) li se aplică în
mod corespunzător prevederile art. 35 alin. (1) şi (3) din Legea nr. 53/2003 -
Codul muncii, cu modificările şi completările ulterioare.
Art. 467. - La data intrării în vigoare a prezentului
titlu se abrogă Legea nr. 306/2004 privind exercitarea profesiei de medic,
precum şi organizarea şi funcţionarea Colegiului Medicilor din România,
publicată în Monitorul Oficial al României, Partea I, nr. 578 din 30 iunie 2004, cu modificările şi completările
ulterioare, precum şi orice alte dispoziţii contrare.
Prezentul titlu transpune integral prevederile
referitoare la exerciţiul profesiei de medic cuprinse în:
- Directiva Consiliului nr.
93/16 din 5 aprilie 1993 privind facilitarea liberei circulaţii a medicilor şi
recunoaşterea reciprocă a diplomelor, certificatelor şi a altor titluri de
medic, cu modificările şi completările ulterioare, publicată în Jurnalul
Oficial al Comunităţilor Europene (JOCE) nr. 165 din 7 iulie 1993, p. 1;
- art. 5 alin. (1) lit. a), alin. (2) şi (3), art. 6,
art. 7 alin. (1), alin. (2) lit. a)-c) si alin. (3), art. 8, art. 50 alin. (1)
şi (4), art. 51, art. 52 alin. (1), art. 53, 54 şi art. 56 alin. (1) şi (2) din
Directiva 2005/36/CE din 7 septembrie 2005 privind recunoaşterea calificărilor
profesionale, publicată în Jurnalul Oficial al Comunităţilor Europene (JOCE)
nr. L 255 din 30 septembrie 2005;
- art. 11 din Regulamentul Consiliului nr. 1.612/68CEE din 15 octombrie 1968 privind libera circulaţie a lucrătorilor
în interiorul Comunităţii Europene, publicat în Jurnalul Oficial al
Comunităţilor Europene (JOCE) nr. L 257 din 19 octombrie 1968;
- Directiva Consiliului 2003/109/CE din 25 noiembrie
2003 privind statutul cetăţenilor din statele terţe
care sunt rezidenţi pe termen lung, publicat în Jurnalul Oficial al
Comunităţilor Europene (JOCE) nr. L 16 din 23 ianuarie 2004.
TITLUL XIII
Exercitarea profesiei de medic dentist Organizarea şi funcţionarea
Colegiului Medicilor Dentişti din România
CAPITOLUL I
Exercitarea profesiei de medic dentist
SECŢIUNEA 1
Dispoziţii generale
Art. 468. - Prevederile prezentului titlu se aplică
activităţilor de medic dentist exercitate în România în regim salarial şi/sau independent.
Art. 469. - Profesia de medic dentist se exercită, pe
teritoriul României, în condiţiile prezentei legi, de către persoanele fizice
posesoare ale unui titlu oficial de calificare în medicina dentară, după cum
urmează:
a) cetăţeni ai statului român;
b) cetăţeni ai unui stat membru al Uniunii Europene,
ai unui stat aparţinând Spaţiului Economic European sau ai Confederaţiei
Elveţiene;
c) soţul unui cetăţean român, precum şi descedenţii şi
ascendenţii în linie directă aflaţi în întreţinerea unui cetăţean român,
indiferent de cetăţenia acestora;
d) membrii de familie ai unui cetăţean al unuia
dintre statele prevăzute la lit. b), aşa cum sunt definiţi la art. 2 alin. (1)
pct. 3 din Ordonanţa de urgenţă a Guvernului nr. 102/2005 privind libera
circulaţie pe teritoriul României a cetăţenilor statelor membre ale Uniunii
Europene şi Spaţiului Economic European, aprobată cu modificări prin Legea nr.
260/2005;
e) cetăţenii statelor terţe beneficiari ai statutului
de rezident permanent în România;
f) beneficiari ai statutului de rezident pe termen
lung acordat de unul dintre statele prevăzute la lit. b).
Art. 470. - (1) In sensul prezentului titlu, expresiile
folosite au următoarele semnificaţii:
a) medici dentişti,
cetăţeni ai unui stat membru al Uniunii Europene, ai unui stat aparţinând
Spaţiului Economic European sau ai Confederaţiei Elveţiene - persoanele prevăzute la art. 469 lit. b) şi, prin asimilare,
medicii dentişti aflaţi în situaţiile prevăzute la art. 469 lit. d) şi f);
b) stat membru de
origine sau de provenienţă, stat membru de stabilire sau, după caz, stat membru
gazdă - un stat membru al Uniunii Europene, un
stat aparţinând Spaţiului Economic European sau Confederaţia Elveţiană;
(2) Prin titlu oficial de calificare în medicina dentară se înţelege:
a) diploma de medic stomatolog sau diploma de medic
dentist, eliberate de o instituţie de învăţământ superior din domeniul
medicinei dentare, acreditată din România;
b) certificatul de specialist în ortodonţie şi
ortopedie dento-facială, precum şi certificatul de specialist în chirurgie
dento-alveolară, eliberate de Ministerul Sănătăţii Publice;
c) diploma, certificatul sau un alt titlu în medicină
dentară, eliberate conform normelor Uniunii Europene de statele membre ale
Uniunii Europene, statele aparţinând Spaţiului Economic European sau de
Confederaţia Elveţiană;
d) diploma, certificatul sau un alt titlu în medicină
dentară, dobândite într-un stat terţ şi recunoscute de unul dintre statele
membre enumerate la lit. c) ori echivalate de România.
Art. 471. - (1) Titlurile oficiale de calificare în
medicina dentară obţinute în afara României, a statelor membre ale Uniunii
Europene, a statelor aparţinând Spaţiului Economic European sau a Confederaţiei
Elveţiene se echivalează potrivit legii.
(2) Excepţie de la prevederile alin. (1) fac titlurile
oficiale de calificare în medicina dentară care au fost recunoscute de unul
dintre aceste state.
Art. 472. - (1) Profesia de medic dentist are ca scop
asigurarea sănătăţii publice şi a individului prin activităţi de prevenţie,
diagnostic şi tratament ale maladiilor şi anomaliilor oro-dento-maxilare şi ale
ţesuturilor adiacente, desfăşurate cu respectarea prevederilor Codului
deontologic al medicului dentist.
(2) Natura acestor activităţi încadrează profesia de
medic dentist în rândul profesiilor din sectorul sanitar cu risc crescut de
biocontaminare, beneficiind de toate facilităţile acordate de legislaţia în
vigoare.
(3) Caracterul specific al activităţilor exercitate
în baza titlurilor oficiale de calificare în medicina dentară, prevăzute de
lege, individualizează, distinge şi separă profesia de medic dentist de
profesia de medic.
Art. 473. - (1) In exercitarea profesiei medicul
dentist trebuie să dovedească disponibilitate, corectitudine, devotament şi
respect faţă de fiinţa umană. Independenţa profesională conferă medicului
dentist dreptul de iniţiativă şi decizie în exercitarea actului medico-dentar
şi deplină răspundere a acestuia.
(2) Medicul dentist nu este funcţionar public în timpul
exercitării profesiei, prin natura umanitară şi liberală a acesteia.
Art. 474. - (1) Profesia de medic dentist, indiferent
de forma de exercitare, salariată şi/sau independentă, se exercită numai de
către medicii dentişti membri ai Colegiului Medicilor Dentişti din România.
(2) In vederea accesului la una dintre activităţile de
medic dentist şi exerciţiului acesteia, medicii dentişti cetăţeni ai unui stat
membru al Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European
sau ai Confederaţiei Elveţiene, stabiliţi în unul dintre aceste state, sunt
exceptaţi, în caz de prestare temporară sau ocazională de servicii
medico-dentare, de la obligativitatea înscrierii în Colegiul Medicilor Dentişti
din România.
Art. 475. - (1) La primirea ca membru în Colegiul Medicilor Dentişti din România medicul dentist va depune
următorul jurământ:
„Odată admis printre membrii profesiei de medic
dentist:
Mă angajez solemn să-mi consacru viaţa în slujba
umanităţii;
Voi păstra profesorilor mei respectul şi recunoştinţa care le sunt datorate;
Voi exercita profesia cu conştiinţă şi demnitate;
Sănătatea pacienţilor va fi pentru mine obligaţie
sacră;
Voi păstra secretele încredinţate de pacienţi, chiar şi
după decesul acestora;
Voi menţine prin toate mijloacele onoarea şi nobila
tradiţie a profesiei de medic dentist;
Colegii mei vor fi fraţii mei;
Nu voi îngădui să se interpună între datoria mea şi
pacient consideraţii de naţionalitate, rasă, religie, partid sau stare socială;
Voi păstra respectul deplin pentru viaţa umană de la
începuturile sale, chiar sub ameninţare, şi nu voi utiliza cunoştinţele mele
profesionale contrar legilor umanităţii.
Fac acest jurământ în mod solemn, liber, pe
onoare!"
(2) Prevederile alin. (1) se aplică şi:
a) medicilor dentişti cetăţeni români stabiliţi în
străinătate şi care doresc să exercite profesia în România;
b) medicilor dentişti cetăţeni ai unui stat membru al
Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene, stabiliţi în România şi care doresc să profeseze;
c) medicilor dentişti cetăţeni ai unui stat membru al
Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene, stabiliţi în unul dintre aceste state şi care solicită
intrarea în profesie în România;
d) medicilor dentişti care întrunesc condiţiile
prevăzute la art. 469 lit. c) şi e).
(3) Medicii dentişti prevăzuţi la alin. (2) lit. b)
şi c) pot depune jurământul în limba română sau în una dintre limbile de
circulaţie în Uniunea Europeană.
Art. 476. - (1) Profesia de medic dentist se exercită
pe teritoriul României de persoanele prevăzute la art. 469 care îndeplinesc
următoarele condiţii:
a) deţin un titlu oficial de calificare în medicina
dentară prevăzut de prezenta lege;
b) nu se găsesc în vreunul
dintre cazurile de nedemnitate sau incompatibilitate prevăzute de prezenta
lege;
c) sunt apţi din punct de vedere medical pentru
exercitarea profesiei de medic dentist;
d) sunt membri ai Colegiului Medicilor Dentişti din
România;
e) prin excepţie de la lit.
d), în caz de prestare temporară sau ocazională de servicii, medicii dentişti
care întrunesc condiţiile
prevăzute la art. 469 lit. b), d) şi f) trebuie să înştiinţeze Ministerul
Sănătăţii Publice cu privire la prestarea temporară sau ocazională de servicii
medico-dentare pe teritoriul României şi să fie înregistraţi pe această
perioadă la Colegiul Medicilor Dentişti din România.
(2) Medicii dentişti cetăţeni ai unui stat membru al
Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene, stabiliţi pe teritoriul României, precum şi medicii
dentişti care întrunesc condiţiile prevăzute la art. 469 lit. c) şi e) exercită
profesia de medic dentist cu aceleaşi drepturi şi obligaţii ca şi medicii
dentişti cetăţeni români membri ai Colegiului Medicilor Dentişti din România.
Art. 477. - (1) Profesia de medic dentist se exercită
în România cu titlul profesional corespunzător calificării profesionale
însuşite, după cum urmează:
a) medic dentist;
b) specialist în ortodonţie şi
ortopedie dento-facială;
c) specialist în chirurgia dento-alveolară.
(2) Prevederile alin. (1) se aplică şi cetăţenilor
unui stat membru al Uniunii Europene, ai unui stat aparţinând Spaţiului
Economic European sau ai Confederaţiei Elveţiene care deţin un titlu oficial de
calificare în medicina dentară şi care exercită profesia în România.
(3) Medicii dentişti care întrunesc condiţiile
prevăzute la art. 469 şi la art. 476 alin. (1) lit. a)-d) pot desfăşura
activităţi medico-dentare conform pregătirii profesionale în sistemul naţional
de asigurări de sănătate sau/şi în sistemul privat, fie ca angajaţi, fie ca
persoană fizică independentă în formele prevăzute de lege.
Art. 478. - Controlul şi supravegherea profesiei de
medic dentist se realizează de Ministerul Sănătăţii Publice şi de Colegiul
Medicilor Dentişti din România, denumite în continuare autorităţi competente
române.
Art. 479. - (1) In cazul în care un medic dentist îşi
întrerupe activitatea profesională sau se află într-o situaţie de
incompatibilitate pe o perioadă mai mare de 5 ani, Colegiul Medicilor Dentişti
din România va reatesta competenţa profesională a acestuia în vederea reluării
activităţii medico-dentare.
(2) Procedura privind modalităţile şi condiţiile de
verificare şi atestare a nivelului profesional se stabileşte de Consiliul
naţional al Colegiului Medicilor Dentişti din România, conform Codului
deontologic al medicului dentist şi Regulamentului de organizare şi funcţionare
al Colegiului Medicilor Dentişti din România.
(3) Prevederile alin. (1) se aplică şi medicilor
dentişti cetăţeni ai unui stat membru al Uniunii Europene, ai unui stat
aparţinând Spaţiului Economic European sau ai Confederaţiei Elveţiene stabiliţi
pe teritoriul României.
Art. 480. - (1) Practicarea
profesiei de medic dentist de către o persoană care nu are această calitate
constituie infracţiune şi se pedepseşte conform Codului penal.
(2) Colegiul Medicilor Dentişti din România, prin
preşedintele colegiului teritorial sau al Consiliului naţional al Colegiului
Medicilor Dentişti din România, este în drept să exercite acţiunea civilă sau
să sesizeze, după caz, organele judiciare şi autorităţile competente pentru
urmărirea şi trimiterea în judecată a persoanelor care îşi atribuie sau care
întrebuinţează fără drept titlul ori calitatea de medic dentist sau care
practică în mod ilegal medicina dentară.
(3) Acţiunea penală împotriva unui membru al
Colegiului Medicilor Dentişti din România cu privire la fapte ce au legătură cu
exercitarea profesiei de medic dentist se pune în mişcare cu înştiinţarea
prealabilă a colegiului teritorial al cărui membru este medicul dentist respectiv şi a Biroului executiv
naţional.
SECŢIUNEA a 2-a
Nedemnităţi şi incompatibilităţi
Art. 481. - Este nedemn de a exercita profesia de medic
dentist:
a) medicul dentist care a fost condamnat definitiv
pentru săvârşirea cu intenţie a unei infracţiuni contra umanităţii sau vieţii
în împrejurări legate de exercitarea profesiei de medic dentist şi pentru care
nu a intervenit reabilitarea;
b) medicul dentist căruia i s-a aplicat pedeapsa
interdicţiei de a exercita profesia, pe durata stabilită, prin hotărâre
judecătorească sau disciplinară.
Art. 482. - (1) Exercitarea profesiei de medic dentist
este incompatibilă cu:
a) calitatea de angajat sau
colaborator al unităţilor de producţie ori distribuţie de produse farmaceutice,
materiale sanitare sau materiale de tehnică dentară;
b) exercitarea în calitate de medic dentist, în mod
nemijlocit, de acte şi fapte de comerţ;
c) orice ocupaţie de natură a
aduce atingere demnităţii profesionale de medic dentist sau bunelor moravuri;
d) starea de sănătate fizică sau psihică
necorepunzătoare pentru exercitarea acestei profesii, atestată ca atare prin
certificat medical eliberat de comisia de expertiză medicală şi recuperare a
capacităţii de muncă;
e) folosirea cu bună ştiinţă a cunoştinţelor
medico-dentare în defavoarea sănătăţii pacientului sau în scop criminal.
(2) Excepţie de la prevederile alin. (1) lit. b) fac
activităţile de prevenţie de medicină dentară.
(3) La solicitarea medicului dentist în cauză sau la
sesizarea oricărei persoane sau autorităţi/instituţii interesate, preşedintele
colegiului din care face parte medicul dentist respectiv poate constitui o
comisie, special instituită pentru fiecare caz în parte, alcătuită din 3 medici
dentişti primari, pentru a confirma sau infirma situaţia de incompatibilitate
prevăzută la alin. (1) lit. a)-c) sau e). In cazurile prevăzute la alin. (1) lit.
d) acesta poate solicita organelor în drept confirmarea sau infirmarea stării
de incompatibilitate.
(4) Pe timpul stării de incompatibilitate se suspendă
dreptul de exercitare a profesiei.
(5) In termen de 10 zile de la apariţia situaţiei de
incompatibilitate, medicul dentist este obligat să anunţe colegiul teritorial
al cărui membru este.
SECŢIUNEA a 3-a
Autorizarea exercitării profesiei de medic
dentist
Art. 483. - (1) Medicii dentişti care întrunesc
condiţiile prevăzute la art. 469 exercită profesia pe baza certificatului de
membru al Colegiului Medicilor Dentişti din România, avizat anual pe baza
asigurării de răspundere civilă, pentru greşeli în activitatea profesională,
valabilă pentru anul respectiv.
(2) In caz de prestare temporară sau ocazională de
servicii medico-dentare pe teritoriul României, medicii dentişti cetăţeni ai
unui stat membru al Uniunii Europene, ai unui stat aparţinând Spaţiului
Economic European sau ai Confederaţiei Elveţiene, stabiliţi în unul dintre
aceste state, sunt exceptaţi de la obligativitatea obţinerii certificatului de
membru al Colegiului Medicilor Dentişti din România. Accesul la activităţile de
medic dentist pe durata prestării serviciilor se face conform prevederilor art.
492.
(3) Certificatul de membru al Colegiului Medicilor
Dentişti din România se acordă pe baza următoarelor acte:
a) documentele care atestă formarea în profesie;
b) certificatul de sănătate;
c) declaraţia pe propria răspundere privind
îndeplinirea condiţiilor prevăzute la art. 481 şi 482;
d) certificatul de cazier judiciar.
(4) Certificatul de membru devine operativ numai după
încheierea asigurării de răspundere civilă.
Art. 484. - (1) Medicii se pensionează la vârsta
prevăzută de lege.
(2) In unităţile sanitare publice, medicii membri
titulari şi corespondenţi ai Academiei Române, profesori universitari,
cercetători ştiinţifici gradul I, doctori în ştiinţe medicale care desfăşoară activităţi
medico-dentare pot continua, la cerere, activitatea până la împlinirea vârstei
de 70 de ani.
(3) Medicii dentişti care au depăşit limita de vârstă
prevăzută la alin. (1) pot profesa în continuare în unităţi sanitare private.
Desfăşurarea activităţii se face în baza certificatului de membru şi a avizului
anual al Colegiului Medicilor Dentişti din România eliberat pe baza
certificatului de sănătate şi a asigurării privind răspunderea civilă pentru
greşeli în activitatea profesională, încheiată pentru anul respectiv.
(4) Medicii dentişti deţinuţi sau internaţi din
motive politice, aflaţi în situaţiile prevăzute la art. 1 alin. (1) şi (2) din
Decretul-lege nr. 118/1990 privind acordarea unor drepturi persoanelor
persecutate din motive politice de dictatura instaurată cu începere de la 6
martie 1945, precum şi a celor deportate în străinătate ori constituite în
prizonieri, republicat, cu modificările şi completările ulterioare, pot fi
menţinuţi, la cerere, în activitatea profesională, pe baza certificatului anual
de sănătate. Aceste prevederi se aplică şi medicilor dentişti care, din motive
politice, au fost obligaţi să îşi întrerupă studiile o anumită perioadă,
obţinându-şi licenţa cu întârziere, ori celor care au fost împiedicaţi să îşi
reia activitatea profesională.
(5) In cazul unităţilor sanitare publice care
înregistrează deficit de personal medico-dentar, precum şi al unităţilor
sanitare publice aflate în zone defavorizate, medicii dentişti îşi pot continua
activitatea peste vârsta de pensionare prevăzută de lege. Criteriile de
menţinere în activitate în aceste situaţii se stabilesc prin norme aprobate
prin hotărâre a Guvernului.
(6) Medicii dentişti care au împlinit vârsta de
pensionare prevăzută de lege nu pot deţine funcţii de conducere în cadrul
Ministerului Sănătăţii Publice, ministerelor şi instituţiilor centrale cu reţea
sanitară proprie, autorităţilor de sănătate publică, Casei Naţionale de
Asigurări de Sănătate, caselor judeţene de asigurări de sănătate şi a
municipiului Bucureşti, precum şi în cadrul spitalelor publice şi oricărei alte
unităţi sanitare publice.
CAPITOLUL II
Dispoziţii privind exercitarea profesiei de medic dentist în România de către
medicii dentişti cetăţeni ai unui stat membru al Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European sau ai Confederaţiei Elveţiene
SECŢIUNEA 1
Dispoziţii privind facilitarea dreptului de
stabilire
Art. 485. - (1) In caz de stabilire pe teritoriul
României, solicitările medicilor dentişti cetăţeni ai unui stat membru al
Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene cu privire la accesul la una dintre activităţile
prevăzute la art. 472 se soluţionează de Ministerul Sănătăţii Publice, în
colaborare cu Colegiul Medicilor Dentişti din România, în termen de 3 luni de
la depunerea dosarului complet de
către cel interesat. Aceştia primesc certificatul de
membru al Colegiului Medicilor Dentişti din România în urma aplicării
procedurii de recunoaştere a calificării profesionale.
(2) Dosarul prevăzut la alin. (1) cuprinde:
a) copia documentului de cetăţenie;
b) copia documentelor care atestă formarea în profesie;
c) certificatul emis de autorităţile competente ale
statului membru de origine sau de provenienţă prin care se atestă că titlurile
oficiale de calificare sunt cele prevăzute de Directiva 2005/36CE;
d) certificatul de sănătate fizică şi psihică emis de
statul membru de origine sau de provenienţă;
e) dovada emisă de statul membru de origine sau de
provenienţă, prin care se atestă onorabilitatea şi moralitatea posesorului;
f) dovada de asigurare privind răspunderea civilă
pentru greşeli în activitatea profesională, emisă de instituţiile abilitate din
unul dintre statele membre prevăzute la alin. (1).
(3) Documentele prevăzute la alin. (2) lit. d)-f)
sunt valabile 3 luni de la data emiterii.
(4) In situaţia în care pentru accesul şi exerciţiul
activităţii prevăzute la alin. (1) statul membru de origine sau provenienţă nu
impune o astfel de cerinţă şi, în consecinţă, nu emite cetăţenilor săi
documentul prevăzut la alin. (2) lit. d), autorităţile competente române
acceptă din partea acestuia un atestat echivalent certificatului de sănătate.
(5) In cazul în care statul membru de origine sau de
provenienţă nu impune o astfel de cerinţă şi, în consecinţă, nu emite
cetăţenilor săi documentul prevăzut la alin. (2) lit. e), autorităţile
competente române acceptă atestatul eliberat pe baza declaraţiei sub jurământ
sau a declaraţiei solemne a solicitantului de către autoritatea judiciară sau
administrativă competentă sau, după caz, de notarul sau organizaţia profesională
abilitată în acest sens de acel stat.
Art. 486. - (1) In termen de 30 de zile de la primirea
dosarului, Ministerul Sănătăţii Publice informează solicitantul asupra
documentelor necesare completării acestuia.
(2) Deciziile autorităţilor competente române în aceste
cazuri pot fi atacate la instanţa de contencios administrativ.
Art. 487. - (1) Atunci când autorităţile competente
române au cunoştinţă de fapte grave şi precise care pot avea repercusiuni
asupra începerii activităţii profesionale sau asupra exercitării profesiei de
medic dentist în România, comise de medicii dentişti cetăţeni ai unui stat
membru al Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European
sau ai Confederaţiei Elveţiene, anterior stabilirii în România şi în afara
teritoriului său, acestea informează statul membru de origine sau de
provenienţă al celor în cauză.
(2) Autorităţile competente române comunică statului
membru gazdă informaţiile solicitate cu privire la sancţiunile disciplinare de
natură profesională sau administrativă, precum şi cu privire la sancţiunile
penale interesând exerciţiul profesiei de medic dentist, aplicate medicilor
dentişti pe durata exercitării profesiei în România.
(3) Autorităţile competente române analizează
informaţiile transmise de statul membru gazdă cu privire la faptele grave şi
precise comise de medicii dentişti cetăţeni români sau care provin din România,
anterior stabilirii în statul membru gazdă şi în afara teritoriului său, fapte
care pot avea repercusiuni asupra începerii activităţii profesionale sau asupra
exercitării profesiei de medic dentist în acel stat.
(4) Autorităţile competente române decid asupra
naturii şi amplorii investigaţiilor pe care le întreprind în situaţiile pentru
care au fost sesizate şi comunică statului membru gazdă consecinţele care rezultă cu privire la atestatele şi
documentele pe care le-au emis în cazurile respective.
SECŢIUNEA a 2-a
Dispoziţii cu privire la libera prestare a
serviciilor medico-dentare
Art. 488. - (1) Prezentele dispoziţii se aplică
medicilor dentişti cetăţeni ai unui stat membru al Uniunii Europene, ai unui
stat aparţinând Spaţiului Economic European sau ai Confederaţiei Elveţiene,
care sunt stabiliţi în vederea exercitării profesiei în unul dintre aceste
state, atunci când se deplasează pe teritoriul României pentru a exercita în
regim temporar şi ocazional activităţile de medic dentist.
(2) Caracterul temporar şi ocazional al prestării
activităţilor medico-dentare este stabilit, de la caz la caz, de Ministerul
Sănătăţii Publice în funcţie de durata, frecvenţa, periodicitatea şi
continuitatea acestora.
Art. 489. - (1) Medicii dentişti cetăţeni ai unui stat
membru al Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European
sau ai Confederaţiei Elveţiene, stabiliţi în unul dintre aceste state, sunt
exceptaţi de la obligaţia înscrierii în Colegiul Medicilor Dentişti din
România, precum şi de la plata cotizaţiei de membru, atunci când solicită
accesul la una dintre activităţile de medic dentist în vederea prestării
temporare sau ocazionale de servicii medico-dentare în
România.
(2) Aceştia sunt înregistraţi automat la Colegiul
Medicilor Dentişti din România pe durata prestării serviciilor respective, în
baza copiei documentelor prestatorului prevăzute la art. 492 şi transmise în
acest scop de Ministerul Sănătăţii Publice.
(3) Exerciţiul activităţilor de medic dentist, în
aceste situaţii, se face în concordanţă cu celelalte drepturi şi obligaţii
prevăzute de lege pentru medicii dentişti cetăţeni români membri ai Colegiului
Medicilor Dentişti din România.
Art. 490. - Pe durata prestării
cu caracter temporar sau ocazional a serviciilor medico-dentare pe teritoriul
României, persoanele prevăzute la art. 489 alin. (1) se supun dispoziţiilor cu
caracter profesional, regulamentar sau administrativ al calificărilor
profesionale care definesc profesia şi utilizarea titlurilor, dispoziţiilor cu
privire la faptele profesionale grave care afectează direct şi specific
protecţia şi securitatea consumatorilor, precum şi dispoziţiilor disciplinare
prevăzute de lege pentru medicii dentişti cetăţeni români membri ai Colegiului
Medicilor Dentişti din România.
Art. 491. - Prestarea cu caracter temporar sau
ocazional a serviciilor medico-dentare pe teritoriul României de către
persoanele prevăzute la art. 489 alin. (1) se face cu titlul profesional
prevăzut de lege pentru calificarea profesională însuşită.
Art. 492. - (1) Solicitările medicilor dentişti
cetăţeni ai unui stat membru al Uniunii Europene, ai unui stat aparţinând
Spaţiului Economic European sau ai Confederaţiei Elveţiene, stabiliţi în unul
dintre aceste state, cu privire la prestarea temporară sau ocazională de
servicii medico-dentare în România, se soluţionează de Ministerul Sănătăţii
Publice în colaborare cu Colegiul Medicilor Dentişti din România.
(2) In cazul în care, în scopul
prestării temporare de servicii medico-dentare, solicitantul se află la prima
deplasare în România sau în cazul în care în situaţia acestuia intervin schimbări
materiale atestate de documente, acesta va înainta Ministerului Sănătăţii
Publice:
a) o declaraţie prealabilă
scrisă, în care se precizează durata de prestare, natura, locul de desfăşurare
a acestor activităţi, precum şi domeniul de asigurare sau alte mijloace
de protecţie personală sau colectivă privind
responsabilitatea profesională de care solicitantul beneficiază în statul
membru de stabilire;
b) copia documentului de cetăţenie;
c) o dovadă prin care autorităţile competente ale
statului membru de stabilire atestă că la data eliberării acestui document
posesorul este stabilit legal pe teritoriul său în vederea exercitării
activităţilor de medic dentist şi nu i-a fost interzisă exercitarea acestora,
nici chiar cu titlu temporar;
d) diplomele, certificatele sau alte titluri de medic
dentist prevăzute de lege sau de normele Uniunii Europene pentru prestarea
activităţilor în cauză.
(3) Declaraţia prevăzută la alin. (2) lit. a) poate fi
înaintată prin toate mijloacele şi se reînnoieşte o dată pe an, dacă prestatorul
intenţionează să furnizeze, de manieră temporară sau ocazională, în cursul anului respectiv, servicii medico-dentare în România.
Art. 493. - (1) In caz de prestare temporară a
serviciilor, medicii dentişti cetăţeni ai unui stat membru al Uniunii Europene,
ai unui stat aparţinând Spaţiului Economic European sau ai Confederaţiei
Elveţiene, stabiliţi în unul dintre aceste state, sunt exceptaţi de la
procedura de acreditare prevăzută de legislaţia asigurărilor sociale de
sănătate.
(2) Persoanele prevăzute la alin. (1) au obligaţia de a
informa în prealabil Casa Naţională de Asigurări de Sănătate asupra serviciilor
pe care urmează să le presteze pe teritoriul României, iar în caz de urgenţă,
în termen de maximum 7 zile de la prestarea acestora.
Art. 494. - Incepând cu data aderării la Uniunea
Europeană, autorităţile competente române vor retrage, după caz, temporar sau
definitiv, documentele prevăzute la art. 492 alin. (2) lit. c) eliberate
medicilor dentişti care întrunesc condiţiile prevăzute la art. 469 lit. a), c)
şi e), precum şi medicilor dentişti stabiliţi în România care întrunesc
condiţiile prevăzute la art. 469 lit. b), d) şi f), în cazul în care acestora
li se aplică sancţiunile prevăzute de lege cu suspendarea sau interdicţia
exercitării profesiei.
Art. 495. - (1) Pentru fiecare prestare de servicii
autorităţile competente române pot solicita autorităţilor competente omoloage
din statul membru de stabilire informaţii pertinente cu privire la legalitatea
condiţiei de stabilire, buna conduită profesională a solicitantului, precum şi
la absenţa în cazul acestuia a sancţiunilor disciplinare
sau penale.
(2) La solicitarea statului membru gazdă,
autorităţile competente române transmit informaţiile solicitate cu respectarea
prevederilor art. 499.
(3) Autorităţile competente asigură schimbul necesar
de informaţii pentru ca plângerea beneficiarului împotriva prestatorului de
servicii medico-dentare în regim temporar sau ocazional să fie corect
soluţionată. In această situaţie, beneficiarul este informat asupra cursului
demersului său.
SECŢIUNEA a 3-a
Dispoziţii comune cu privire la dreptul de
stabilire şi libera prestare de servicii medico-dentare
Art. 496. - Medicii dentişti cetăţeni ai unui stat
membru al Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European
sau ai Confederaţiei Elveţiene care, în timpul exercitării profesiei în România
încalcă dispoziţiile, legile şi regulamentele profesiei răspund potrivit legii.
Art. 497. - (1) Medicii dentişti cetăţeni ai unui stat
membru al Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European
sau ai Confederaţiei Elveţiene care exercită profesia de medic dentist în
România au dreptul de a ataşa la titlul profesional prevăzut la art. 477 titlul legal de formare obţinut în statul
membru de origine sau de provenienţă, în limba statului emitent şi, eventual,
abrevierea acestui titlu în măsura în care nu este identic cu titlul
profesional. Titlul legal de formare va fi însoţit de numele şi locul
instituţiei sau ale organismului emitent.
(2) Dacă titlul respectiv de formare desemnează în
România o pregătire complementară neînsuşită de beneficiar, acesta va utiliza
în exerciţiul profesiei forma corespunzătoare a titlului indicată de
autorităţile competente române.
Art. 498. - (1) Medicii dentişti cetăţeni ai unui stat
membru al Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European
sau ai Confederaţiei Elveţiene care doresc să exercite profesia în România pot
obţine de la autorităţile competente române informaţii cu privire la legislaţia
din domeniul sănătăţii, din domeniul securităţii sociale, precum şi cu privire la Codul deontologic al medicului dentist.
(2) In vederea furnizării informaţiilor prevăzute la
alin. (1), autorităţile competente române vor organiza la nivelul structurilor
teritoriale şi centrale birouri de informare legislativă.
(3) Medicii dentişti cetăţeni
ai unui stat membru al Uniunii Europene, ai unui stat aparţinând Spaţiului
Economic European sau ai Confederaţiei Elveţiene, care exercită profesia ca urmare
a recunoaşterii calificării profesionale de către autorităţile competente
române, trebuie să posede cunoştinţele lingvistice necesare desfăşurării
activităţilor profesionale în România.
Art. 499. - (1) Autorităţile competente române
colaborează îndeaproape cu autorităţile competente omoloage ale statelor membre
ale Uniunii Europene, ale statelor aparţinând Spaţiului Economic European şi,
respectiv, ale Confederaţiei Elveţiene, asigurând confidenţialitatea
informaţiilor transmise.
(2) Schimbul de informaţii privind sancţiunile
disciplinare sau penale aplicate în caz de fapte grave şi precise, susceptibile
de a avea consecinţe asupra activităţilor de medic dentist, se va face cu
respectarea prevederilor Legii nr. 506/2004 privind prelucrarea datelor cu caracter
personal şi protecţia vieţii private în sectorul comunicaţiilor electronice şi
a prevederilor Legii nr. 677/2001 pentru protecţia persoanelor cu privire la
prelucrarea datelor cu caracter personal şi libera circulaţie a acestor date,
cu modificările şi completările ulterioare.
CAPITOLUL III
Organizarea şi funcţionarea Colegiului Medicilor
Dentişti din România
SECŢIUNEA 1
Caracteristici generale
Art. 500. - (1) Colegiul Medicilor Dentişti din România
este organism profesional, apolitic, fără scop patrimonial, de drept public, cu
responsabilităţi delegate de autoritatea de stat, în domeniul autorizării,
controlului şi supravegherii profesiei de medic dentist ca profesie liberală,
de practică publică autorizată.
(2) Colegiul Medicilor Dentişti din România are
autonomie instituţională în domeniul său de competenţă, normativ şi
jurisdicţional profesional.
(3) Ministerul Sănătăţii Publice urmăreşte modul de
respectare a prevederilor legale în activitatea Colegiului Medicilor Dentişti
din România.
(4) Colegiul Medicilor Dentişti din România cuprinde
toţi medicii dentişti care întrunesc condiţiile prevăzute la art. 469 lit. a),
c) şi e), precum şi medicii dentişti stabiliţi în România care întrunesc
condiţiile prevăzute la art. 469 lit. b),
d) şi f) şi care exercită profesia de medic dentist în
condiţiile prezentului titlu.
Art. 501. - (1) Colegiul
Medicilor Dentişti din România se organizează şi funcţionează pe criterii
teritoriale, la nivel naţional şi judeţean, respectiv la nivelul municipiului
Bucureşti.
(2) Sediul Colegiului Medicilor Dentişti din România
este în municipiul Bucureşti.
(3) Patrimoniul este format din bunuri mobile şi
imobile dobândite în condiţiile legii.
SECŢIUNEA a 2-a
Atribuţiile Colegiului Medicilor Dentişti din România
Art. 502. - (1) Colegiul Medicilor Dentişti din România
are următoarele atribuţii generale:
a) colaborează în domeniul său de competenţă cu
Ministerul Sănătăţii Publice, prin asigurarea controlului aplicării
regulamentelor şi normelor care organizează şi reglementează exercitarea
profesiei de medic dentist, indiferent de forma de exercitare şi de unitatea
sanitară în care se desfăşoară;
b) apără demnitatea, promovează drepturile şi
interesele membrilor săi în toate sferele de activitate, apără onoarea,
libertatea şi independenţa profesională ale medicului dentist în exercitarea
profesiei;
c) asigură respectarea de
către medicii dentişti a obligaţiilor ce le revin faţă de pacient şi de
sănătatea publică;
d) atestă onorabilitatea şi moralitatea profesională
ale membrilor săi;
e) întocmeşte, actualizează permanent Registrul unic
al medicilor dentişti din România, administrează pagina de Internet de
publicare a acestuia şi înaintează trimestrial Ministerului Sănătăţii Publice
un raport privind situaţia numerică a membrilor săi, precum şi a evenimentelor
înregistrate în domeniul autorizării, controlului şi supravegherii exercitării
profesiei de medic dentist;
f) elaborează şi adoptă Regulamentul de organizare şi
funcţionare al Colegiului Medicilor Dentişti din România şi Codul deontologic
al medicului dentist, luând măsurile necesare pentru respectarea unitară a
acestora;
g) dezvoltă metodologii, iniţiază şi elaborează
ghiduri şi protocoale de practică medico-dentară, pe nivelurile de competenţă
ale unităţilor sanitare, pe care le propune spre aprobare Ministerului
Sănătăţii Publice;
h) colaborează în domeniul său
de competenţă cu instituţii/autorităţi publice, organizaţii desemnate de
Ministerul Sănătăţii Publice la elaborarea criteriilor şi standardelor de
dotare a cabinetelor de practică medico-dentară, indiferent de forma de
proprietate, şi le supune spre aprobare Ministerului Sănătăţii Publice;
i) îi reprezintă pe membrii săi în relaţiile cu
asociaţii ştiinţifice, profesionale, patronale şi cu sindicatele;
j) stabileşte şi reglementează regimul de publicitate a
activităţilor medico-dentare;
k) colaborează în domeniul său de competenţă cu
organizaţii, autorităţi/instituţii publice, persoane fizice/juridice cu
atribuţii desemnate de Ministerul Sănătăţii Publice, asigurând cadrul necesar
desfăşurării unei concurenţe loiale bazate exclusiv pe promovarea competenţei
profesionale;
l) controlează modul în care
sunt respectate de către angajatori independenţa profesională a medicilor
dentişti şi dreptul acestora de decizie în exercitarea actului medico-dentar;
m) colaborează în domeniul său de competenţă cu
Ministerul Sănătăţii Publice la consultările privind reglementările din
domeniul medico-dentar sau al asigurărilor sociale de sănătate;
n) acţionează, alături de instituţiile sanitare
centrale şi teritoriale, ca în unităţile medico-dentare publice şi private
(cabinete, ambulatorii, spitale) să fie asigurată calitatea actului
medico-dentar;
o) organizează judecarea cazurilor de abateri de la
normele de etică profesională şi de deontologie medico-dentară şi a cazurilor
de greşeli în activitatea profesională, în calitate de organ de jurisdicţie
profesională;
p) sprijină instituţiile şi acţiunile de asistenţă
medico-socială pentru medicii dentişti şi familiile lor;
q) promovează relaţiile pe plan extern cu organizaţii
şi formaţiuni similare;
r) în cadrul Colegiului
Medicilor Dentişti din România funcţionează comisii ce reprezintă
specialităţile medicinei dentare prevăzute în Nomenclatorul specialităţilor
medicale, medico-dentare şi farmaceutice pentru reţeaua de asistenţă medicală,
elaborat de Ministerul Sănătăţii Publice;
s) colaborează cu organizaţii, autorităţi/instituţii
publice, persoane fizice/juridice cu atribuţii desemnate de Ministerul
Sănătăţii Publice, reprezentând în domeniul său de competenţă medicii dentişti
cu practică independentă care desfăşoară activităţi medicale în cadrul
sistemului de asigurări sociale de sănătate;
t) avizează, în domeniul său de competenţă, autorizarea
de instalare a cabinetelor medicale dentare publice sau private şi se pronunţă
în acest sens în legătură cu demersurile întreprinse în vederea interzicerii
instalării şi funcţionării acestora, ţinând seama ca exercitarea activităţilor
medico-dentare să se facă în concordanţă cu competenţa profesională a medicului
dentist, cu dotarea tehnică, precum şi cu respectarea normelor de igienă;
u) colaborează cu Ordinul Asistenţilor Medicali şi
Moaşelor din România în ceea ce priveşte activitatea profesională a
tehnicienilor dentari şi asistenţilor medicali care desfăşoară activitate în
medicina dentară;
v) organizează centre de pregătire lingvistică,
necesare pentru exercitarea activităţii profesionale de către medicii cetăţeni
ai statelor membre ale Uniunii Europene, ai statelor aparţinând Spaţiului
Economic European sau ai Confederaţiei Elveţiene;
x) colaborează în domeniul său de competenţă cu
organizaţii de profil profesional-ştiinţific, patronal, sindical, din domeniul
sanitar, şi cu organizaţii neguvernamentale în toate problemele ce privesc
asigurarea sănătăţii populaţiei;
y) coordonează, controlează şi supraveghează
funcţional, organizatoric şi financiar colegiile teritoriale.
(2) In domeniul formării profesionale, Colegiul
Medicilor Dentişti din România are următoarele atribuţii:
a) participă în domeniul său de competenţă cu
Ministerul Educaţiei şi Cercetării şi Ministerul Sănătăţii Publice la
stabilirea numărului anual de locuri de pregătire în unităţile de învăţământ
superior de medicină dentară;
b) colaborează în domeniul său de competenţă cu
Ministerul Sănătăţii Publice, alături de alte organizaţii, persoane
fizice/juridice, la formarea, specializarea şi perfecţionarea pregătirii
profesionale a medicilor dentişti;
c) colaborează în domeniul său de competenţă cu
Ministerul Sănătăţii Publice la elaborarea metodologiei de acordare a gradului
profesional, a tematicii de concurs şi la elaborarea Nomenclatorului de
specialităţi medicale, medico-dentare şi farmaceutice pentru reţeaua de
asistenţă medicală;
d) iniţiază şi promovează, în domeniul său de
competenţă, împreună cu organizaţii, autorităţi/instituţii publice, persoane
fizice/juridice cu atribuţii desemnate de Ministerul Sănătăţii Publice, forme
de educaţie medicală continuă şi de ridicare a gradului de competenţă profesională
a membrilor săi;
e) urmăreşte realizarea orelor de educaţie medicală
continuă necesare reavizării la 5 ani a calităţii de membru al Colegiului
Medicilor Dentişti din România;
f) susţine activitatea şi dezvoltarea cercetării
ştiinţifice şi organizează manifestări ştiinţifice în domeniul medicinei
dentare;
g) colaborează prin compartimentul de calitate a
serviciilor de sănătate cu autorităţi/instituţii publice, persoane
fizice/juridice cu atribuţii desemnate de Ministerul Sănătăţii Publice, în vederea
stabilirii şi creşterii standardelor de practică profesională, a asigurării
calităţii actului medico-dentar în unităţile sanitare.
Art. 503. - In exercitarea atribuţiilor prevăzute de
prezentul titlu Colegiul Medicilor Dentişti din România, prin structurile
naţionale sau teritoriale, are dreptul de a formula acţiune în justiţie în nume
propriu sau în numele membrilor săi.
SECŢIUNEA a 3-a
Membrii Colegiului Medicilor Dentişti din România
Art. 504. - (1) In vederea exercitării profesiei de
medic dentist, medicii dentişti cetăţeni români şi medicii dentişti cetăţeni ai
unui stat membru al Uniunii Europene, ai unui stat aparţinând Spaţiului
Economic European sau ai Confederaţiei Elveţiene, stabiliţi în România, precum
şi medicii dentişti care întrunesc condiţiile prevăzute de art. 469 lit. c) şi
e) au obligaţia să se înscrie în Colegiul Medicilor Dentişti din România.
(2) Calitatea de membru este dovedită prin
certificatul de membru al Colegiului Medicilor Dentişti din România, care se
eliberează la înscrierea în corpul profesional.
(3) Inscrierea în Colegiul Medicilor Dentişti din
România şi eliberarea certificatului de membru se fac numai pentru medicii
dentişti care îndeplinesc condiţiile prevăzute la art. 476 alin. (1) lit. a),
b) şi c) şi au depus jurământul prevăzut la art. 475.
(4) Depunerea jurământului se va menţiona în
certificatul de membru al Colegiului Medicilor Dentişti din România.
(5) Pot deveni la cerere membri ai Colegiului
Medicilor Dentişti din România şi medicii dentişti cetăţeni ai unui stat membru
al Uniunii Europe, ai unui stat aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene, stabiliţi în unul dintre aceste state şi care
prestează temporar sau ocazional servicii medico-dentare în România, cu
respectarea prevederilor alin. (3).
(6) Membrii Colegiului Medicilor Dentişti din România
sunt înscrişi în Registrul unic al medicilor dentişti din România, care se
publică pe pagina de Internet a Colegiului Medicilor Dentişti din România.
Art. 505. - (1) La cerere, membrii Colegiului Medicilor
Dentişti din România, care din motive obiective întrerup pe o durată de până la
5 ani exercitarea profesiei de medic dentist, pot solicita suspendarea
calităţii de membru pe acea durată.
(2) Pe durata suspendării la cerere a calităţii de
membru al Colegiului Medicilor Dentişti din România se suspendă obligaţiile şi
drepturile ce decurg din prezenta lege.
(3) Intreruperea exercitării profesiei de medic
dentist pe o durată mai mare de 5 ani atrage, de drept, pierderea calităţii de
membru al Colegiului Medicilor Dentişti din România.
Art. 506. - Medicii dentişti cetăţeni români şi medicii
dentişti cetăţeni ai unui stat membru al Uniunii Europene, ai unui stat
aparţinând Spaţiului Economic European sau ai Confederaţiei Elveţiene,
stabiliţi în România, care doresc să exercite profesia, se înscriu ca membri ai
Colegiului Medicilor Dentişti din România la colegiul teritorial în raza căruia
se află unitatea la care urmează să îşi desfăşoare activitatea sau la colegiul teritorial în raza căruia îşi au
domiciliul sau, după caz, reşedinţa.
SECŢIUNEA a 4-a
Drepturile şi obligaţiile membrilor Colegiului
Medicilor Dentişti din România
Art. 507. - Membrii Colegiului Medicilor Dentişti din
România au următoarele drepturi:
a) dreptul să aleagă şi să fie aleşi în organele de
conducere de la nivelul structurilor teritoriale şi/sau naţionale ale
Colegiului Medicilor Dentişti din România;
b) dreptul să se adreseze organelor abilitate ale
Colegiului Medicilor Dentişti din România şi să primească informaţiile
solicitate;
c) dreptul să participe la orice acţiune a Colegiului
Medicilor Dentişti din România şi să fie informaţi în timp util despre aceasta;
d) dreptul să folosească împreună cu membrii lor de
familie toate dotările sociale, profesionale, culturale şi sportive ale
Colegiului Medicilor Dentişti din România şi ale colegiilor teritoriale;
e) dreptul să poarte însemnele Colegiului Medicilor
Dentişti din România;
f) dreptul de a contesta sancţiunile primite;
g) dreptul de a solicita ajutoare materiale pentru
situaţii deosebite, atât personal, cât şi prin membrii lor de familie.
Art. 508. - Obligaţiile
membrilor Colegiului Medicilor Dentişti din România sunt următoarele:
a) să respecte dispoziţiile Regulamentului de
organizare şi funcţionare al Colegiului Medicilor Dentişti din România, ale
Codului deontologic al medicului dentist, hotărârile organelor de conducere ale
Colegiului Medicilor Dentişti din România şi regulamentele profesiei;
b) să rezolve sarcinile ce le-au fost încredinţate în
calitate de membru sau de reprezentant al corpului profesional;
c) să participe la manifestările iniţiate de organele
de conducere, la activităţile profesionale ori de pregătire profesională
iniţiate ori organizate de organele de conducere naţionale sau locale;
d) să participe la şedinţele ori adunările la care au
fost convocaţi;
e) să execute cu bună-credinţă sarcinile care decurg
din hotărârile organelor de conducere ale Colegiului Medicilor Dentişti din
România;
f) să se abţină de la deliberările organelor de
conducere în care sunt aleşi, în cazul în care, în îndeplinirea unor atribuţii
ale acestor organe, au un interes propriu;
g) să păstreze secretul profesional;
h) să respecte normele, principiile şi îndatoririle deontologiei
medicale;
i) să aibă un comportament demn în exercitarea
profesiei ori a calităţii de membru al Colegiului Medicilor Dentişti din
România;
j) să achite în termenul stabilit cotizaţia datorată în
calitate de membru al Colegiului Medicilor Dentişti din România;
k) să rezolve litigiile cu alţi membri, în primul rând
prin mediere de către comisiile organizate în acest scop în cadrul Colegiului
Medicilor Dentişti din România;
l) să execute cu bună-credinţă
atribuţiile ce le revin în calitate de reprezentant sau membru în organele de
conducere ale Colegiului Medicilor Dentişti din România, în colegiile judeţene
sau în Colegiul Medicilor Dentişti al Municipiului Bucureşti.
Art. 509. - Obligaţiile membrilor Colegiului Medicilor
Dentişti din România, ce decurg din calitatea lor specială de medici dentişti,
sunt:
a) să respecte şi să aplice în orice împrejurare
normele de deontologie ale profesiei de medic dentist;
b) să nu aducă prejudicii reputaţiei profesiei sau
altor membri, respectând statutul de corp profesional al Colegiului Medicilor
Dentişti din România;
c) să acorde cu promptitudine şi necondiţionat
îngrijirile medico-dentare de urgenţă, ca o îndatorire fundamentală
profesională şi civică;
d) să acţioneze pe toată durata exercitării profesiei
în vederea creşterii gradului de pregătire profesională;
e) să aplice parafa cuprinzând numele, prenumele,
gradul profesional, specialitatea şi codul pe toate actele medicale pe care le
semnează;
f) să respecte drepturile pacienţilor.
Art. 510. - (1) In vederea creşterii gradului de
pregătire profesională şi asigurării unui nivel ridicat al cunoştinţelor
medico-dentare, medicii dentişti sunt obligaţi să efectueze un număr de cursuri
de pregătire şi alte forme de educaţie medicală continuă şi informare în
domeniul ştiinţelor medicale, pentru cumularea numărului de credite stabilit în
acest sens de Colegiul Medicilor Dentişti din România. Sunt creditate
programele, precum şi celelalte forme de educaţie medicală continuă avizate de
Colegiul Medicilor Dentişti din România.
(2) Medicii dentişti care nu realizează pe parcursul a
5 ani numărul minim de credite de educaţie medicală continuă, stabilit de
Consiliul naţional al Colegiului Medicilor Dentişti din România, sunt
suspendaţi din exercitarea profesiei până la realizarea numărului de credite
respectiv.
SECŢIUNEA a 5-a
Organizare şi funcţionare
A. Organizarea la nivel teritorial
Art. 511. - (1) Colegiul Medicilor Dentişti din România
este organizat la nivel naţional şi judeţean, respectiv al municipiului Bucureşti,
în colegii ale medicilor dentişti, denumite în continuare colegii teritoriale.
(2) Colegiile teritoriale au personalitate juridică, patrimoniu şi buget proprii, precum şi autonomie
funcţională, organizatorică şi financiară în condiţiile prezentei legi. Sediul
colegiului teritorial este în reşedinţa de judeţ, respectiv în municipiul
Bucureşti.
Art. 512. - Organele de conducere
ale Colegiului Medicilor Dentişti din România, la nivel judeţean sau al
municipiului Bucureşti, sunt: adunarea generală, consiliul judeţean, respectiv
al municipiului Bucureşti, şi biroul consiliului.
Art. 513. - (1) Adunarea generală a colegiilor
teritoriale este alcătuită din medicii dentişti înscrişi în colegiul teritorial
respectiv.
(2) Adunarea generală a colegiilor teritoriale are
următoarele atribuţii:
a) aprobă planul de activitate al consiliului;
b) aprobă bugetul de venituri şi cheltuieli;
c) alege membrii consiliului;
d) alege membrii comisiei de cenzori a colegiului
teritorial sau, după caz, aprobă cenzorul extern propus de colegiul teritorial;
e) alege reprezentanţii colegiului teritorial în
Adunarea generală naţională a Colegiului Medicilor Dentişti din România.
(3) Adunarea generală a colegiului teritorial se
întruneşte anual în primul trimestru al anului sau, în mod extraordinar, ori de
câte ori este nevoie.
Art. 514. - (1) Consiliul colegiului judeţean,
respectiv al municipiului Bucureşti, este format din:
a) 7 membri pentru un număr de până la 100 medici
dentişti înscrişi;
b) 11 membri pentru 101-300 de medici dentişti
înscrişi;
c) 15 membri pentru 301-500 de medici dentişti
înscrişi;
d) 29 de membri pentru 501-1.000 de medici dentişti înscrişi;
e) 49 de membri pentru colegiile cu peste 1.000 de
medici dentişti înscrişi.
(2) Proporţional cu numărul de membri ai consiliului se
vor alege 3-9 membri supleanţi.
Art. 515. - (1) Consiliul colegiului judeţean,
respectiv al municipiului Bucureşti, va alege dintre membrii săi un birou
executiv format din preşedinte, 2 vicepreşedinţi, un secretar şi un trezorier,
aleşi pentru un mandat de 4 ani.
(2) Membrii organelor de conducere de la nivel
teritorial se aleg prin vot secret, pentru un mandat de 4 ani.
Art. 516. - (1) Alegerea organelor de conducere de la
nivel teritorial sau naţional se face conform Regulamentului electoral aprobat
de Consiliul naţional al Colegiului Medicilor Dentişti din România.
(2) Funcţiile în biroul executiv al colegiilor
teritoriale, în Biroul executiv naţional şi în Consiliul naţional al Colegiului
Medicilor Dentişti din România sunt incompatibile cu:
a) funcţia corespunzătoare dintr-un patronat/sindicat
profesional;
b) funcţii de conducere în cadrul Ministerului
Sănătăţii Publice şi ministerelor cu reţea sanitară proprie, autorităţilor de
sănătate publică teritoriale, Casei Naţionale de Asigurări de Sănătate, precum
şi caselor judeţene de asigurări de sănătate.
Art. 517. - (1) Consiliul colegiului judeţean, respectiv al municipiului Bucureşti, se întruneşte la
convocarea preşedintelui, în şedinţe ordinare, la interval de două luni. In mod
excepţional, la solicitarea a două treimi din numărul membrilor săi, consiliul
colegiului judeţean, respectiv al municipiului Bucureşti, poate fi convocat în
şedinţe extraordinare. Intre şedinţe, consiliul colegiului judeţean, respectiv
al municipiului Bucureşti, este condus de biroul executiv, care asigură
activitatea permanentă a acestuia.
(2) Deciziile consiliului
colegiului judeţean, respectiv al municipiului Bucureşti, se adoptă în prezenţa
a cel puţin două treimi din numărul membrilor săi, cu votul favorabil a
jumătate plus unu din numărul total al acestora.
Art. 518. - (1) Consiliul colegiului judeţean,
respectiv al municipiului Bucureşti, şi, respectiv, biroul executiv al acestora
exercită atribuţiile date în competenţa lor, prin Regulamentul de organizare şi
funcţionare al Colegiului Medicilor Dentişti din România, adoptat de adunarea
generală a acestuia.
(2) In vederea exercitării
atribuţiilor, consiliul colegiului judeţean, respectiv al municipiului
Bucureşti, îşi desfăşoară activitatea în comisii, alese de adunarea generală
teritorială respectivă, pe domenii de activitate sau pe specialităţi ale
medicinei dentare, în conformitate cu Regulamentul de organizare şi funcţionare
adoptat de adunarea generală a Colegiului Medicilor Dentişti din România.
B. Organizarea la nivel
naţional
Art. 519. - (1) Conducerea Colegiului Medicilor
Dentişti din România, la nivel naţional, se exercită de către:
a) Adunarea generală naţională;
b) Consiliul naţional;
c) Biroul executiv naţional.
(2) Biroul executiv naţional şi preşedintele
acestuia, aleşi de Adunarea generală naţională, sunt de drept organele de
conducere ale Consiliului naţional al Colegiului Medicilor Dentişti din
România.
(3) Nu pot primi sau exercita mandatul de membru al
organelor de conducere ale Colegiului Medicilor Dentişti din România, atât la
nivel naţional, cât şi teritorial, medicii dentişti care deţin funcţii de conducere în cadrul Ministerului
Sănătăţii Publice, respectiv ministerelor şi instituţiilor cu reţea sanitară
proprie, structurilor deconcentrate ale acestora ori în cadrul Casei Naţionale
de Asigurări de Sănătate, caselor judeţene de asigurări de sănătate, respectiv
a municipiului Bucureşti, patronatelor şi sindicatelor profesionale, precum şi
orice fel de funcţii de demnitate publică.
(4) Medicii dentişti pentru care, în timpul mandatului
de membru al organelor de conducere, a survenit situaţia de incompatibilitate
sunt suspendaţi din funcţie. Suspendarea durează până la încetarea situaţiei de
incompatibilitate sau până la expirarea mandatului.
(5) Numărul de mandate în organele de conducere de la
nivel teritorial şi naţional este de maximum două, care pot fi şi consecutive.
Art. 520. - (1) Adunarea generală naţională a
Colegiului Medicilor Dentişti din România este alcătuită din reprezentanţi
aleşi de adunarea generală din fiecare judeţ şi din municipiul Bucureşti, prin
vot direct şi secret.
(2) Norma de reprezentare în Adunarea generală
naţională este de:
a) 2 reprezentanţi pentru colegiile judeţene care au
sub 50 de membri înscrişi;
b) 4 reprezentanţi pentru colegiile judeţene care au
sub 120 de membri înscrişi;
c) 6 reprezentanţi pentru colegiile judeţene care au
sub 200 de membri înscrişi;
d) 8 reprezentanţi pentru colegiile judeţene care au
sub 300 de membri înscrişi;
e) 10 reprezentanţi pentru colegiile judeţene cu
peste 300 de membri înscrişi;
f) 15 reprezentanţi pentru colegiile judeţene cu
peste 500 de membri înscrişi;
g) 20 de reprezentanţi pentru colegiile judeţene cu
peste 701 membri înscrişi;
h) un reprezentant la 100 de membri înscrişi pentru
Colegiul Medicilor Dentişti al Municipiului Bucureşti.
(3) Adunarea generală
naţională a Colegiului Medicilor Dentişti din România se întruneşte anual în
primul trimestru al anului sau în mod extraordinar ori de câte ori este nevoie.
Art. 521. - (1) Adunarea generală naţională adoptă
Codul deontologic al medicului dentist şi Regulamentul de organizare şi
funcţionare al Colegiului Medicilor Dentişti din România în prezenţa a cel
puţin două treimi din numărul reprezentanţilor aleşi.
(2) Deciziile Adunării generale naţionale a Colegiului
Medicilor Dentişti din România se adoptă cu majoritate simplă de voturi în
prezenţa a cel puţin două treimi din numărul reprezentanţilor aleşi.
Art. 522. - Adunarea generală naţională a Colegiului
Medicilor Dentişti din România are următoarele atribuţii:
a) adoptă atât Codul deontologic al medicului dentist
şi Regulamentul de organizare şi funcţionare al Colegiului Medicilor Dentişti
din România, cât şi modificările lor ulterioare;
b) alege membrii Biroului executiv naţional pentru
mandatul de 4 ani;
c) dezbate şi votează Raportul anual de activitate
prezentat de Biroul executiv naţional şi de comisiile de specialitate ale Colegiului
Medicilor Dentişti din România privind activitatea desfăşurată între sesiunile
adunării generale;
d) revocă din funcţie membrii aleşi, pentru abateri de
la prevederile prezentei legi şi, respectiv, ale Regulamentului de organizare
şi funcţionare al Colegiului Medicilor Dentişi din România, care aduc
prejudicii activităţii organismului profesional;
e) alege comisia de cenzori sau, după caz, aprobă
cenzorul contabil autorizat, propus de Consiliul naţional al Colegiului
Medicilor Dentişti din România;
f) aprobă bugetul de venituri şi cheltuieli anual al
Colegiului Medicilor Dentişti din România;
g) dezbate şi votează raportul Comisiei de cenzori;
h) stabileşte obiectivele generale ale Colegiului
Medicilor Dentişti din România pe termen scurt, mediu şi lung.
Art. 523. - (1) Intre sesiunile Adunării generale
naţionale Colegiul Medicilor Dentişti din România este condus de Consiliul
naţional.
(2) Consiliul naţional al Colegiului Medicilor
Dentişti din România este alcătuit din Biroul executiv naţional, câte un
reprezentant al fiecărui judeţ, din 3 reprezentanţi ai municipiului Bucureşti,
un reprezentant numit de Ministerul Sănătăţii Publice, ca autoritate de stat,
şi câte un reprezentant din fiecare minister şi instituţie centrală cu reţea
sanitară proprie.
(3) Consiliul naţional al Colegiului Medicilor
Dentişti din România se întruneşte legal în prezenţa a cel puţin două treimi
din numărul reprezentanţilor stabiliţi la alin. (2).
Art. 524. - Deciziile Consiliului naţional al
Colegiului Medicilor Dentişti din România se adoptă în prezenţa a cel puţin
două treimi din numărul membrilor săi, cu votul favorabil a jumătate plus unu
din numărul total al membrilor.
Art. 525. - Atribuţiile
Consiliului naţional al Colegiului Medicilor Dentişti din România sunt următoarele:
a) elaborează Codul deontologic al medicului dentist,
precum şi Regulamentul de organizare şi funcţionare al Colegiului Medicilor
Dentişti din România;
b) fixează cotizaţia care
trebuie plătită obligatoriu de către fiecare medic dentist consiliului
judeţean, respectiv al municipiului Bucureşti, stabilind partea din această
cotizaţie care trebuie virată către Consiliul naţional al Colegiului Medicilor
Dentişti din România;
c) stabileşte indemnizaţia pentru membrii Biroului
executiv naţional şi biroului consiliilor teritoriale, precum şi indemnizaţiile
de şedinţă pentru membrii Consiliului naţional;
d) gestionează bunurile Colegiului Medicilor Dentişti
din România şi poate să iniţieze şi să subvenţioneze acţiuni interesând
profesiunea de medic dentist şi acţiuni de întrajutorare;
e) controlează şi coordonează activitatea consiliului
judeţean, respectiv al municipiului Bucureşti, şi controlează gestiunea acestora;
f) soluţionează, în termen de 30 de zile de la
înregistrare, contestaţiile formulate împotriva deciziilor date de consiliile
judeţene, respectiv al municipiului Bucureşti, în conformitate cu regulamentele
proprii;
g) colaborează cu Ministerul Sănătăţii Publice la
elaborarea Nomenclatorului de specialităţi medicale, medico-dentare şi
farmaceutice pentru reţeaua de asistenţă medicală;
h) colaborează, în domeniul său de competenţă, cu
Ministerul Sănătăţii Publice la elaborarea de norme privind exercitarea profesiei de medic dentist pe teritoriul României;
i) colaborează cu Ministerul Sănătăţii Publice la
elaborarea tematicilor şi a metodologiilor concursurilor şi examenelor pentru
medicii dentişti;
j) stabileşte sistemul de credite de educaţie medicală
continuă pe baza căruia se evaluează activitatea de perfecţionare profesională
a medicilor dentişti;
k) stabileşte condiţiile privind desfăşurarea de către
cabinetele şi unităţile medico-dentare a publicităţii şi aprobă conţinutul
materialului publicitar.
Art. 526. - In cadrul Consiliului naţional al
Colegiului Medicilor Dentişti din România funcţionează mai multe comisii al
căror număr, competenţe, precum şi regulament de funcţionare sunt stabilite de
acesta.
Art. 527. - (1) Biroul executiv naţional al Colegiului
Medicilor Dentişti din România asigură activitatea permanentă a acestuia, în
conformitate cu legea şi regulamentele proprii.
(2) Biroul executiv naţional este alcătuit dintr-un
preşedinte, 3 vicepreşedinţi, un secretar general şi un trezorier, aleşi în mod
individual pe funcţii de Adunarea generală naţională, pentru un mandat de 4
ani.
(3) Biroul executiv naţional conduce şedinţele
Consiliului naţional şi activitatea Colegiului Medicilor Dentişti din România
între şedinţele Consiliului naţional.
Art. 528. - (1) Consiliul naţional al Colegiului
Medicilor Dentişti din România participă, în domeniul său de competenţă, în
colaborare cu Ministerul Sănătăţii Publice, la elaborarea tuturor programelor
de sănătate şi a actelor normative cu efect asupra
medicinei dentare.
(2) La negocierea anuală a contractului-cadru pentru
specialitatea medicină dentară Consiliul naţional al Colegiului Medicilor
Dentişti din România reprezintă în domeniul său de competenţă medicii dentişti
cu practică independentă, aflaţi în relaţii contractuale cu casele de asigurări
sociale de sănătate.
Art. 529. - (1) Contractul de muncă al persoanei care
exercită o funcţie de conducere în Biroul executiv al consiliului judeţean,
respectiv al municipiului Bucureşti, şi al Consiliului naţional al Colegiului
Medicilor Dentişti din România se suspendă, la cererea persoanei în cauză, pe
perioada cât îndeplineşte funcţia respectivă, cu menţinerea locului de muncă.
(2) Persoana aflată în situaţia prevăzută la alin.
(1) beneficiază de vechime în muncă pe perioada exercitării funcţiei
respective.
(3) Remunerarea persoanelor care exercită funcţii de
conducere în Biroul executiv naţional sau local este stabilită prin vot, cu
majoritate simplă, de Consiliul naţional al Colegiului Medicilor Dentişti din
România.
SECŢIUNEA a 6-a
Răspunderea disciplinară
Art. 530. - (1) Medicul dentist răspunde disciplinar
pentru nerespectarea legilor şi regulamentelor profesiei de medic dentist, a
Codului deontologic al medicului dentist, a regulilor de bună practică
profesională, a Regulamentului de organizare şi funcţionare al Colegiului
Medicilor Dentişti din România, pentru nerespectarea deciziilor obligatorii
adoptate de organele de conducere ale Colegiului Medicilor Dentişti din
România, precum şi pentru orice fapte săvârşite în legătură cu profesia sau în
afara acesteia, care sunt de natură să prejudicieze onoarea şi prestigiul
profesiei sau ale instituţiei Colegiului Medicilor Dentişti din România.
(2) Răspunderea disciplinară a membrilor Colegiului
Medicilor Dentişti din România, potrivit prezentului titlu, nu exclude
răspunderea penală, contravenţională, civilă sau materială, conform
prevederilor legale.
Art. 531. - (1) Sancţiunile disciplinare sunt:
a) mustrare;
b) avertisment;
c) vot de blam;
d) interdicţia de a exercita
profesia ori anumite activităţi medico-dentare pe o perioadă de la o lună la 6
luni;
e) retragerea calităţii de membru al Colegiului
Medicilor Dentişti din România.
(2) Retragerea calităţii de membru al Colegiului
Medicilor Dentişti din România operează de drept pe durata stabilită prin hotărâre
definitivă de instanţele judecătoreşti cu privire la interzicerea exercitării
profesiei.
(3) La sancţiunile prevăzute la alin. (1) se poate
prevedea, după caz, obligarea celui sancţionat la efectuarea unor cursuri de
perfecţionare sau de educaţie medico-dentară ori alte forme de pregătire
profesională.
Art. 532. - (1) In cadrul fiecărui colegiu teritorial
se organizează şi funcţionează comisia de disciplină care judecă în complete de
3 membri abaterile disciplinare săvârşite de medicii dentişti înscrişi în acel
colegiu.
(2) La nivelul Colegiului Medicilor Dentişti din
România se organizează şi funcţionează Comisia superioară de disciplină care
judecă în complete de 5 membri contestaţiile formulate împotriva deciziilor
comisiilor de disciplină teritoriale.
(3) Unul dintre membrii comisiilor de disciplină este
desemnat de autorităţile de sănătate publică, la nivel teritorial, şi de
Ministerul Sănătăţii Publice, la nivelul Comisiei superioare de disciplină.
(4) Calitatea de membru al comisiilor de disciplină
încetează prin deces, demisie, pierderea calităţii de membru al Colegiului
Medicilor Dentişti din România ori prin numirea unui alt reprezentant în cazul
membrilor desemnaţi de Ministerul Sănătăţii Publice sau de autorităţile de
sănătate publică.
(5) Procedura judecării abaterilor, alegerea
membrilor comisiilor de disciplină, durata mandatului acestora şi încetarea
mandatului sunt prevăzute de Regulamentul de organizare şi funcţionare al
Colegiului Medicilor Dentişti din România.
(6) Deciziile de sancţionare pronunţate de comisiile
de disciplină de la nivelul colegiilor teritoriale pot fi contestate de medicul
dentist sancţionat, în termen de 15 zile de la comunicare.
(7) Impotriva deciziei
Comisiei superioare de disciplină, în termen de 15 zile de la comunicare,
medicul dentist sancţionat poate formula o acţiune în anulare la secţia de
contencios administrativ a tribunalului în raza căruia îşi desfăşoară
activitatea.
Art. 533. - Unităţile sanitare
sau cele de medicină legală au obligaţia de a pune la dispoziţia comisiilor de
disciplină sau a persoanelor desemnate cu investigarea abaterilor disciplinare
documentele medicale solicitate, precum şi orice alte date şi informaţii
necesare soluţionării cauzei.
Art. 534. - (1) Acţiunea disciplinară poate fi pornită
în termen de cel mult 6 luni de la data săvârşirii faptei sau de la data
cunoaşterii consecinţelor prejudiciabile.
(2) Sancţiunile prevăzute la art. 531 alin. (1) lit.
a)-c) se radiază în termen de 6 luni de la data executării lor, iar cea
prevăzută la lit. d), în termen de un an de la data expirării perioadei de
interdicţie.
(3) In cazul aplicării sancţiunii prevăzute la art.
531 alin. (1) lit. e), medicul dentist poate face o nouă cerere de redobândire
a calităţii de membru al colegiului după un an de la data aplicării sancţiunii
de comisiile de disciplină. Redobândirea calităţii de membru al Colegiului
Medicilor Dentişti din România se face în condiţiile prezentei legi.
(4) In situaţia în care, prin decizia comisiei de
disciplină, au fost dispuse şi măsurile prevăzute la art. 531 alin. (3),
radierea sancţiunii se va face numai după prezentarea dovezii ducerii la
îndeplinire a măsurii dispuse de comisia de disciplină.
(5) Repetarea unei abateri
disciplinare până la radierea sancţiunii aplicate constituie o circumstanţă
agravantă, care va fi avută în vedere la aplicarea noii sancţiuni.
(6) Decizia pronunţată se comunică medicului dentist
sancţionat şi Biroului executiv al Colegiului Medicilor Dentişti din România.
(7) Deciziile privind aplicarea sancţiunilor care se
soldează cu suspendarea sau interzicerea exercitării profesiei se comunică şi
Ministerului Sănătăţii Publice şi, respectiv, angajatorului.
(8) Persoana fizică/juridică
ce a făcut sesizarea va fi informată cu privire la soluţionarea cauzei de către
comisia de disciplină.
SECŢIUNEA a 7-a
Venituri şi cheltuieli
Art. 535. - Veniturile Colegiului Medicilor Dentişti
din România se constituie din:
a) taxa de înscriere;
b) cotizaţiile lunare ale membrilor;
c) contravaloarea serviciilor prestate membrilor sau
persoanelor fizice şi juridice;
d) donaţii de la persoane fizice şi juridice;
e) legate;
f) drepturi editoriale;
g) încasări din vânzarea publicaţiilor proprii;
h) fonduri rezultate din manifestările culturale şi
ştiinţifice;
i) alte surse.
Art. 536. - (1) Neplata cotizaţiei datorate Colegiului
Medicilor Dentişti din România pe o perioadă de 6 luni şi după atenţionarea
scrisă de către consiliul teritorial al Colegiului Medicilor Dentişti din România
se sancţionează cu suspendarea exercitării profesiei până la plata cotizaţiei
datorate şi atrage plata unor majorări de întârziere în cuantumul prevăzut de
dispoziţiile legale aplicabile instituţiilor publice.
(2) Penalităţile de întârziere se vor aplica şi
colegiilor teritoriale care nu varsă partea de cotizaţie stabilită de Consiliul
naţional.
Art. 537. - (1) Cuantumul cotizaţiei de membru al
Colegiului Medicilor Dentişti din România, precum şi partea din aceasta care
trebuie vărsată către forurile naţionale se stabilesc de către Consiliul
naţional al Colegiului Medicilor Dentişti din România.
(2) Partea din cotizaţie aferentă funcţionării
Colegiului Medicilor Dentişti din România va fi virată, până cel mai târziu la
sfârşitul lunii următoare celei pentru care a fost percepută cotizaţia,
înaintea oricăror alte plăţi.
(3) Obligaţia urmăririi şi efectuării vărsării cotei
aferente Consiliului naţional revine preşedintelui consiliului teritorial.
Neîndeplinirea acestei obligaţii se sancţionează de Consiliul naţional conform
art. 531 lit. a)-c).
Art. 538. - Pentru serviciile prestate persoanelor care
nu sunt membre ale Colegiului Medicilor Dentişti din România tarifele se
stabilesc, după caz, de Consiliul naţional, respectiv
de consiliul colegiului teritorial.
Art. 539. - (1) Fondurile băneşti pot fi utilizate
pentru cheltuieli de administraţie, salarizare personal, fonduri fixe, material
gospodăresc, finanţarea cheltuielilor organizatorice, perfecţionarea pregătirii
profesionale, acordarea de burse de merit prin concurs medicilor dentişti,
întrajutorarea medicilor dentişti cu venituri mici şi a familiilor lor.
(2) Modul de alocare a fondurilor prevăzute la alin.
(1) se stabileşte de Consiliul naţional al Colegiului Medicilor Dentişti din
România.
CAPITOLUL IV
Rolul, atribuţiile şi drepturile autorităţii de stat
Art. 540. - Ministerul Sănătăţii Publice, în calitate
de autoritate de stat, urmăreşte ca activitatea Colegiului Medicilor Dentişti din România să se
desfăşoare în condiţiile legii.
Art. 541. - Reprezentantul autorităţii de stat cu
rangul de secretar de stat în Ministerul Sănătăţii Publice este membru al
Consiliului naţional al Colegiului Medicilor Dentişti din România şi este numit
prin ordin al ministrului sănătăţii publice.
Art. 542. - In cazul în care reprezentantul autorităţii
de stat constată că nu sunt respectate prevederile legale, acesta sesizează
organele de conducere ale Colegiului Medicilor Dentişti din România. In termen
de 15 zile de la efectuarea demersului, acestea adoptă măsurile necesare de
încadrare în normele în vigoare şi informează Ministerul Sănătăţii Publice în
acest sens.
Art. 543. - In cazul nerespectării prevederilor art.
542, Ministerul Sănătăţii Publice se adresează instanţelor judecătoreşti
competente.
CAPITOLUL V
Dispoziţii tranzitorii şi finale
Art. 544. - (1) Atribuţiile Colegiului Medicilor
Dentişti din România nu pot fi exercitate de nici o altă asociaţie
profesională.
(2) Colegiul Medicilor Dentişti din România nu se
poate substitui organizaţiilor patronale sau sindicale şi în îndeplinirea
atribuţiilor sale nu poate face uz de prerogativele acestora prevăzute de lege.
(3) Membrii Colegiului Medicilor Dentişti din România
pot face parte şi din alte asociaţii profesionale.
Art. 545. - (1) Actualele organe de conducere ale
Colegiului Medicilor Dentişti din România de la nivel naţional şi teritorial
vor rămâne în funcţie şi îşi vor exercita mandatul până la împlinirea duratei
pentru care au fost alese.
(2) In termen de 90 de zile de
la intrarea în vigoare a noului statut al Colegiului Medicilor Dentişti din
România se vor organiza comisii de disciplină, în condiţiile prezentului titlu.
Art. 546. - Regulamentul de organizare şi funcţionare
al Colegiului Medicilor Dentişti din România, Codul de deontologie al medicului
dentist, cu modificările şi completările ulterioare, precum şi deciziile
Consiliului naţional care privesc organizarea şi funcţionarea Colegiului
Medicilor Dentişti din România sau drepturile şi obligaţiile acestora ca membri
ai Colegiului Medicilor Dentişti din România se vor publica în Monitorul
Oficial al României, Partea I.
Art. 547. - Pe durata exercitării profesiei în regim
salarial sau/şi independent medicul dentist este obligat să încheie o asigurare
de răspundere civilă pentru greşeli în activitatea profesională.
Art. 548. - (1) Medicii dentişti care ocupă funcţii
publice în cadrul aparatului central al Ministerului Sănătăţii Publice, în
cadrul autorităţilor de sănătate publică judeţene, respectiv a municipiului
Bucureşti, în cadrul Casei Naţionale de Asigurări de Sănătate şi, respectiv, în
cadrul caselor de asigurări de sănătate judeţene şi a municipiului Bucureşti,
pot desfăşura în afara programului normal de lucru, în condiţiile legii,
activităţi profesionale, potrivit calificării pe care o deţin, exclusiv în
unităţi sanitare private.
(2) Medicilor dentişti prevăzuţi la alin. (1) li se
aplică în mod corespunzător prevederile art. 35 alin. (1) şi (3) din Legea nr.
53/2003 - Codul muncii, cu modificările şi completările ulterioare.
Art. 549. - In termen de 60 de zile de la intrarea în
vigoare a prezentului titlu, administraţia publică locală, prin consiliile
judeţene şi Consiliul General al Municipiului Bucureşti, va da în
administrare colegiilor judeţene, respectiv al municipiului Bucureşti, şi Colegiului Medicilor
Dentişti din România spaţii corespunzătoare pentru desfăşurarea activităţii.
Art. 550. - In vederea facilitării accesului la
exerciţiul profesiei de medic dentist pe teritoriul României Ministerul
Sănătăţii Publice, în colaborare cu Colegiul Medicilor Dentişti din România,
recunoaşte calificările de medic dentist dobândite în conformitate cu normele
Uniunii Europene, într-un stat membru al Uniunii Europene, într-un stat
aparţinând Spaţiului Economic European sau în Confederaţia Elveţiană, de
cetăţenii acestor state, iar încadrarea în muncă se face conform legii.
Art. 551. - (1) Normele privind recunoaşterea
diplomelor, certificatelor şi titlurilor de medic dentist, eliberate de un stat
membru al Uniunii Europene, de un stat aparţinând Spaţiului Economic European
şi de Confederaţia Elveţiană cetăţenilor acestora, se elaborează de Ministerul
Sănătăţii Publice, în colaborare cu Colegiul Medicilor Dentişti din România, şi
se aprobă prin hotărâre a Guvernului.
(2) Nomenclatorul de specialităţi medicale,
medico-dentare şi farmaceutice pentru reţeaua de asistenţă medicală se
elaborează de Ministerul Sănătăţii Publice şi se aprobă prin ordin al
ministrului sănătăţii publice.
(3) Normele privind întocmirea,
emiterea şi utilizarea dovezilor de onorabilitate şi moralitate profesională a
medicilor dentişti se elaborează în colaborare de către autorităţile competente
române definite de prezenta lege şi se aprobă prin hotărâre a Guvernului.
Art. 552. - La data intrării în
vigoare a prezentului titlu se abrogă Legea nr. 308/2004 privind exercitarea
profesiei de medic dentist, precum şi înfiinţarea, organizarea şi funcţionarea
Colegiului Medicilor Dentişti din România, publicată în Monitorul Oficial al
României, Partea I, nr. 582
din 30 iunie 2004, cu modificările şi completările ulterioare, precum şi orice
alte dispoziţii contrare.
Prezentul titlu transpune în totalitate prevederile
referitoare la exercitarea profesiei de medic dentist, cuprinse în:
a) Directiva 78/686/CEE din
25 iulie 1978 privind recunoaşterea reciprocă a diplomelor, certificatelor şi
altor titluri de medic dentist, inclusiv măsuri pentru facilitarea exercitării
efective a dreptului de stabilire şi a libertăţii de prestare a serviciilor, cu
modificările şi completările ulterioare, publicată în Jurnalul Oficial al
Comunităţilor Europene (JOCE) nr. L 233 din 24 august 1978;
b) art. 5 alin. (1) lit. a), alin. (2) şi (3), art.
6, art. 7 alin. (1), alin. (2) lit. a)-c) şi alin. (3), art. 8, art. 36 alin.
(2), art. 50 alin. (1) şi (4), art. 51, art. 52 alin. (1), art. 53, 54 şi art.
56 alin. (1) şi (2) din Directiva 2005/36/CE din 7 septembrie 2005 privind
recunoaşterea calificărilor profesionale, publicată în Jurnalul Oficial al
Comunităţilor Europene (JOCE) nr. L 255 din 30 septembrie
2005;
c) art. 11 din Regulamentul Consiliului nr. 1.612/68
CEE din 15 octombrie 1968 privind libera circulaţie a lucrătorilor în
interiorul Comunităţii Europene, publicat în Jurnalul Oficial al Comunităţilor
Europene (JOCE) nr. L 257 din 19 octombrie 1968;
d) Directiva Consiliului 2003/109/CE din 25 noiembrie
2003 privind statutul cetăţenilor din statele terţe care sunt rezidenţi pe
termen lung, publicat în Jurnalul Oficial al Comunităţilor Europene (JOCE) nr.
L 16 din 23 ianuarie 2004.
TITLUL XIV
Exercitarea profesiei de farmacist. Organizarea şi funcţionarea Colegiului Farmaciştilor din România
CAPITOLUL I
Exercitarea profesiei de farmacist
SECŢIUNEA 1
Dispoziţii generale
Art. 553. - Profesia de farmacist se exercită pe teritoriul României, în condiţiile prezentei legi,
de către persoanele fizice posesoare ale unui titlu oficial de calificare în
farmacie, după cum urmează:
a) cetăţeni ai statului român;
b) cetăţeni ai unui stat membru al Uniunii Europene,
ai unui stat aparţinând Spaţiului Economic European sau ai Confederaţiei
Elveţiene;
c) soţul unui cetăţean român, precum şi descendenţii
şi ascendenţii în linie directă, aflaţi în întreţinerea unui cetăţean român,
indiferent de cetăţenia acestora;
d) membrii de familie ai unui
cetăţean al unuia dintre statele prevăzute la lit. b), aşa cum sunt definiţi de
art. 2 alin. (1) pct. 3 din Ordonanţa de urgenţă a Guvernului nr. 102/2005
privind libera circulaţie pe teritoriul României a cetăţenilor statelor membre
ale Uniunii Europene şi Spaţiului Economic European, aprobată cu modificări şi
completări prin Legea nr. 260/2005;
e) cetăţenii statelor terţe beneficiari ai statutului
de rezident permanent în România;
f) beneficiari ai statutului de rezident pe termen lung, acordat de unul dintre statele prevăzute la lit. b).
Art. 554. - (1) In înţelesul prezentului titlu,
termenii şi noţiunile folosite au următoarele semnificaţii:
a) farmacişti cetăţeni ai
unui stat membru al Uniunii Europene, ai unui stat aparţinând Spaţiului
Economic European sau ai
Confederaţiei Elveţiene - persoanele prevăzute la
art. 553 lit. b) şi, prin asimilare, şi farmaciştii aflaţi în situaţiile
prevăzute la art. 553 lit. d) şi f);
b) stat membru de origine sau de provenienţă sau stat membru gazdă - un stat membru al
Uniunii Europene, un stat aparţinând Spaţiului Economic European sau
Confederaţia Elveţiană.
(2) Prin titlu oficial de calificare în farmacie se înţelege:
a) diploma de farmacist, eliberată de o instituţie de
învăţământ superior medico-farmaceutic acreditată din România;
b) certificatul de farmacist specialist, eliberat de
Ministerul Sănătăţii Publice;
c) diploma, certificatul sau un alt titlu de
farmacist, eliberate conform normelor Uniunii Europene de statele membre ale Uniunii Europene, statele aparţinând Spaţiului Economic
European sau de Conferinţa Elveţiană;
d) diploma, certificatul sau un alt titlu de
farmacist, dobândite într-un stat terţ şi recunoscute de unul dintre statele
membre prevăzute la lit. c) ori echivalate în România.
Art. 555. - (1) Titlurile oficiale de calificare în
profesia de farmacist, obţinute în afara României, a statelor membre ale
Uniunii Europene, a statelor aparţinând Spaţiului Economic European sau a
Confederaţiei Elveţiene, se echivalează potrivit legii.
(2) Excepţie de la prevederile alin. (1) fac titlurile
oficiale de calificare în profesia de farmacist care au fost recunoscute de
unul dintre aceste state.
Art. 556. - Monitorizarea şi controlul exercitării
profesiei de farmacist se realizează de Colegiul Farmaciştilor din România şi de Ministerul Sănătăţii
Publice, denumite în continuare autorităţi competente române.
Art. 557. - (1) Profesia de farmacist este profesie
independentă şi se exercită pe baza certificatului de membru al Colegiului
Farmaciştilor din România, în regim salarial şi/sau independent, cu respectarea
prevederilor prezentei legi.
(2) Profesia de farmacist se exercită pe bază de
contract de muncă şi/sau contract de furnizare de servicii farmaceutice.
Profesia de farmacist se exercită în regim independent, după înregistrarea la
administraţia financiară din raza de domiciliu.
(3) In timpul exercitării profesiei, farmacistul nu
este funcţionar public.
(4) Apărarea principiilor prevăzute la alin. (1) este
asigurată de Colegiul Farmaciştilor din România.
Art. 558. - (1) Exercitarea profesiei de farmacist se
realizează prin următoarele activităţi:
a) prepararea formelor farmaceutice ale medicamentelor;
b) fabricarea şi controlul medicamentelor;
c) controlul medicamentelor într-un laborator pentru
controlul medicamentelor;
d) depozitarea, conservarea şi distribuirea
medicamentelor en gros;
e) prepararea, controlul, depozitarea şi distribuţia
medicamentelor în farmacii deschise publicului;
f) prepararea, controlul,
depozitarea şi eliberarea medicamentelor din farmaciile de spital;
g) acordarea de informaţii şi consultanţă privind
medicamentele.
(2) Farmacistul, în conformitate cu pregătirea sa
universitară, este competent să exercite şi alte activităţi profesionale precum:
a) colaborare cu medicul pentru stabilirea şi
urmărirea terapiei pacientului;
b) farmacovigilenţă;
c) fabricarea, controlul, depozitarea, conservarea şi
distribuţia produselor din plante, suplimentelor nutritive, produselor
igieno-cosmetice, dispozitivelor medicale, medicamentelor de uz veterinar,
substanţelor farmaceutice active şi auxiliare;
d) analize în laboratoare de biochimie, toxicologie
şi igienă a mediului şi alimentelor;
e) marketing şi management farmaceutic;
f) activităţi didactice sau
administraţie sanitară.
(3) In toate activităţile prevăzute la alin. (1)
farmacistul are deplină răspundere şi drept de decizie.
Art. 559. - (1) In exercitarea profesiei farmacistul
trebuie să dovedească profesionalism, devotament, corectitudine,
disponibilitate şi respect faţă de persoana care i se adresează pentru
obţinerea serviciilor farmaceutice necesare.
(2) La absolvirea instituţiei de învăţământ din România
farmacistul va depune următorul jurământ:
„In întreaga mea activitate de farmacist
voi da dovadă de o atitudine profund umană faţă de om şi colectivitate.
Voi respecta demnitatea şi personalitatea bolnavului,
exercitând profesiunea cu conştiinciozitate, respectând normele de etică şi de
deontologie farmaceutică.
Voi fi corect cu mine însumi şi
cu confraţii mei, cărora le voi cere colaborarea, şi nu voi refuza să le acord
sprijinul, când mi se va cere, în interesul bolnavului.
Voi păstra secretele încredinţate de pacienţi, chiar şi
după decesul acestora.
Nu voi accepta sub nici un
motiv ca activitatea mea de farmacist să fie utilizată împotriva sănătăţii şi
vieţii omului.
Voi fi răbdător şi înţelegător faţă de cel care,
datorită bolii, nu-mi acordă respectul cuvenit.
Jur, pe onoare, în mod solemn şi liber!"
Art. 560. - (1) Profesia de
farmacist poate fi exercitată pe teritoriul României de persoanele prevăzute la
art. 553, care îndeplinesc următoarele condiţii:
a) deţin un titlu oficial de calificare în farmacie,
prevăzut de lege;
b) nu se găsesc în vreunul dintre cazurile de
nedemnitate sau incompatibilitate prevăzute de prezenta lege;
c) sunt apte din punct de vedere medical pentru
exercitarea profesiei de farmacist;
d) sunt membri ai Colegiului Farmaciştilor din
România. (2) Farmaciştii cetăţeni ai unui stat membru al Uniunii
Europene, ai unui stat aparţinând Spaţiului Economic
European sau ai Confederaţiei Elveţiene, stabiliţi în România, precum şi
farmaciştii care întrunesc condiţiile prevăzute la art. 553 lit. c) şi e) au,
în exercitarea profesiei, aceleaşi drepturi şi obligaţii ca şi farmaciştii
cetăţeni români, membri ai Colegiului Farmaciştilor din România.
Art. 561. - (1) Profesia de farmacist se exercită în
România cu titlul profesional corespunzător calificării profesionale însuşite,
după cum urmează:
a) farmacist;
b) farmacist specialist în una dintre specialităţile
farmaceutice prevăzute de Nomenclatorul de specialităţi medicale,
medico-dentare şi farmaceutice pentru reţeaua de asistenţă medicală.
(2) Prevederile alin. (1) se aplică şi cetăţenilor unui
stat membru al Uniunii Europene, ai unui stat aparţinând Spaţiului Economic
European sau ai Confederaţiei Elveţiene, care deţin un titlu oficial de
calificare în farmacie, precum şi experienţa profesională complementară
prevăzută la art. 568, atunci când este cazul, şi care exercită profesia în
România.
SECŢIUNEA a 2-a
Nedemnităţi şi incompatibilităţi
Art. 562. - Este nedemn să exercite profesia de
farmacist:
a) farmacistul care a fost condamnat definitiv prin
hotărâre judecătorească pentru săvârşirea cu intenţie a unei infracţiuni contra
umanităţii sau vieţii, în împrejurări legate de exercitarea profesiei de
farmacist, şi pentru care nu a intervenit reabilitarea;
b) farmacistul căruia i s-a aplicat pedeapsa
interdicţiei de a exercita profesia, pe durata stabilită prin hotărâre
judecătorească definitivă sau disciplinară.
Art. 563. - (1) Exercitarea profesiei de farmacist este
incompatibilă cu:
a) profesia de medic;
b) oricare ocupaţie de natură a aduce atingere
demnităţii profesiei de farmacist sau bunelor moravuri,
conform Codului deontologic al farmacistului;
c) starea de sănătate fizică sau psihică
necorespunzătoare pentru exercitarea profesiei de farmacist.
(2) In termen de 10 zile de la naşterea situaţiei de
incompatibilitate, farmacistul este obligat să anunţe colegiul al cărui membru
este.
(3) Preşedintele colegiului din care face parte
farmacistul poate desemna o comisie special constituită pentru fiecare caz în
parte, alcătuită din 3 farmacişti primari, pentru a confirma sau a infirma
situaţia de incompatibilitate prevăzută la alin. (1) lit. a) şi b). In cazurile
prevăzute la alin. (1) lit. c), acesta poate solicita organelor în drept
confirmarea sau infirmarea stării de incompatibilitate.
(4) Pe timpul stării de incompatibilitate se suspendă
de drept calitatea de membru al Colegiului Farmaciştilor din România şi dreptul
de exerciţiu al profesiei.
SECŢIUNEA a 3-a
Autorizarea exercitării profesiei de farmacist
Art. 564. - (1) Farmaciştii care întrunesc condiţiile
prevăzute la art. 553 exercită profesia pe baza certificatului de membru al
Colegiului Farmaciştilor din România, avizat anual pe baza asigurării de
răspundere civilă, pentru greşeli în activitatea profesională, valabilă pentru
anul respectiv.
(2) Certificatul de membru al Colegiului Farmaciştilor din România are valabilitate pe toată durata de
exercitare a profesiei, în cazul în care nu intervin situaţiile prevăzute la
art. 562 şi 563 sau nu se produc abateri sancţionate de lege cu suspendarea sau
interdicţia exercitării profesiei.
(3) Certificatul de membru al
Colegiului Farmaciştilor din România se acordă pe baza următoarelor acte:
a) documentele care atestă formarea în profesie;
b) certificatul de sănătate;
c) declaraţia pe propria răspundere privind
îndeplinirea condiţiilor prevăzute la art. 562 şi 563;
d) certificatul de cazier judiciar.
(4) Certificatul de membru devine operativ numai după
încheierea asigurării de răspundere civilă pentru greşeli în activitatea profesională.
Art. 565. - (1) Farmaciştii se pensionează la vârsta
prevăzută de lege.
(2) In unităţile sanitare publice farmaciştii membri
titulari şi corespondenţi ai Academiei Române, profesori universitari,
cercetători ştiinţifici gradul I, doctori în ştiinţe farmaceutice care desfăşoară activităţi
farmaceutice pot continua, la cerere, activitatea, până la împlinirea vârstei
de 70 de ani.
(3) Farmaciştii care au depăşit limita de vârstă
prevăzută la alin. (1) pot profesa în continuare în unităţi sanitare private.
Desfăşurarea activităţii se face în baza certificatului de membru şi a avizului
anual al Colegiului Farmaciştilor din România, eliberat pe baza certificatului
de sănătate şi a asigurării de răspundere civilă pentru greşeli în activitatea
profesională, încheiată pentru anul respectiv.
(4) In cazul unităţilor
sanitare publice care înregistrează deficit de farmacişti, precum şi al
unităţilor sanitare publice aflate în zone defavorizate, farmaciştii îşi pot
continua activitatea peste vârsta de pensionare prevăzută de lege. Criteriile
de menţinere în activitate în aceste situaţii se stabilesc prin norme aprobate
prin hotărâre a Guvernului.
(5) Farmaciştii care au împlinit vârsta de pensionare
prevăzută de lege nu pot deţine funcţii de conducere în cadrul Ministerului
Sănătăţii Publice, al ministerelor şi instituţiilor centrale cu reţea sanitară
proprie, al autorităţilor de sănătate publică, al Casei Naţionale de Asigurări
de Sănătate, al caselor judeţene de asigurări de sănătate, respectiv a municipiului
Bucureşti, precum şi în cadrul spitalelor publice şi al oricărei alte unităţi
sanitare publice.
Art. 566. - In farmaciile de spital farmacistul este
autorizat să elibereze medicamente numai pentru secţiile spitalului.
CAPITOLUL II
Dispoziţii privind exercitarea profesiei de
farmacist pe teritoriul României de către farmaciştii cetăţeni ai
unui stat membru al Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European sau ai Confederaţiei Elveţiene
SECŢIUNEA 1
Dispoziţii privind dreptul utilizării titlului de
formare
Art. 567. - (1) Farmaciştii cetăţeni ai unui stat
membru al Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European sau ai Confederaţiei
Elveţiene, care exercită profesia de farmacist în România, au dreptul de a
ataşa, la titlul profesional prevăzut la art. 561, titlul licit de formare
obţinut în statul membru de origine sau de provenienţă în limba acelui stat şi,
eventual, abrevierea lui. Titlul licit de formare va fi însoţit de numele şi locul
instituţiei sau ale organului emitent.
(2) Dacă titlul respectiv de formare desemnează în
România o pregătire complementară neînsuşită de beneficiar, acesta va utiliza,
în exerciţiul profesiei, forma corespunzătoare a titlului, indicată de
autorităţile competente române.
Art. 568. - In cazul în care accesul la una dintre
activităţile prevăzute la art. 558 sau exercitarea acesteia necesită, în afara
titlului oficial de calificare de farmacist prevăzut de lege, şi o experienţă
profesională complementară, autorităţile competente române recunosc
certificatul emis de statul membru de origine sau de provenienţă a posesorului,
prin care se atestă că acesta a desfăşurat activitatea în cauză în acel stat
pentru o perioadă de timp echivalentă cu cea prevăzută de legislaţia română
pentru activitatea în cauză.
SECŢIUNEA a 2-a
Dispoziţii privind facilitarea exercitării dreptului
de stabilire
Art. 569. - (1) Solicitările farmaciştilor cetăţeni ai
unui stat membru al Uniunii Europene, ai unui stat aparţinând Spaţiului
Economic European sau ai Confederaţiei Elveţiene cu privire la accesul în
România la una dintre activităţile farmaceutice se soluţionează de către
Ministerul Sănătăţii Publice, în colaborare cu Colegiul Farmaciştilor din
România, în termen de 3 luni de la data depunerii dosarului complet de către
cel interesat. Aceştia primesc certificatul de membru al Colegiului
Farmaciştilor din România în urma aplicării procedurii de recunoaştere a
calificării profesionale.
(2) Dosarul prevăzut la alin. (1) cuprinde următoarele
documente:
a) copia documentului de cetăţenie;
b) copia titlurilor oficiale
de calificare în farmacie prevăzute de lege;
c) certificatul emis de autorităţile competente ale
statului membru de origine sau provenienţă, prin care se atestă că titlurile
oficiale de calificare sunt cele prevăzute de Directiva 2005/36/CE;
d) certificatul de sănătate
fizică şi psihică emis de statul membru de origine sau provenienţă;
e) dovada emisă de statul membru de origine sau
provenienţă, prin care se atestă onorabilitatea şi moralitatea posesorului;
f) dovada de asigurare privind răspunderea civilă
pentru greşeli în activitatea profesională, emisă de instituţiile abilitate din
unul dintre statele membre prevăzute la alin. (1).
(3) Documentele prevăzute la alin. (2) lit. d)-f)
sunt valabile 3 luni de la data emiterii.
Art. 570. - (1) In situaţia în
care pentru accesul şi exerciţiul activităţii prevăzute la art. 569 alin. (1)
statul membru de origine sau provenienţă nu impune o astfel de cerinţă şi, în
consecinţă, nu emite cetăţenilor săi documentul prevăzut la art. 569 alin. (2)
lit. d), autorităţile competente române acceptă din partea acestuia un atestat
echivalent certificatului de sănătate.
(2) In cazul în care statul membru de origine sau
provenienţă nu impune o astfel de cerinţă şi, în consecinţă, nu emite
cetăţenilor săi documentul prevăzut la art. 569 alin. (2) lit. e), autorităţile
competente române acceptă
atestatul eliberat pe baza declaraţiei sub jurământ sau
a declaraţiei solemne a solicitantului de către autoritatea judiciară sau
administrativă competentă sau, după caz, de notarul sau organizaţia
profesională abilitată în acest sens de acel stat.
Art. 571. - (1) In termen de 30 de zile de la primirea
dosarului, Ministerul Sănătăţii Publice informează solicitantul asupra
documentelor necesare completării acestuia.
(2) Deciziile autorităţilor
competente române în aceste cazuri pot fi atacate la instanţa de contencios
administrativ.
Art. 572. - Farmaciştii cetăţeni ai unui stat membru al
Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene, stabiliţi în România şi care, în timpul exercitării
profesiei, încalcă dispoziţiile, legile şi regulamentele profesiei, răspund
potrivit legii.
Art. 573. - (1) Atunci când autorităţile competente
române au cunoştinţă de fapte grave şi precise care pot avea repercusiuni
asupra începerii activităţii profesionale sau asupra exercitării profesiei de
farmacist în România, comise de farmaciştii cetăţeni ai unui stat membru al
Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene, anterior stabilirii în România şi în afara
teritoriului său, acestea informează statul de origine sau de provenienţă a
celor în cauză.
(2) Autorităţile competente române comunică statului
membru gazdă informaţiile solicitate cu privire la sancţiunile disciplinare de
natură profesională sau administrativă, precum şi cu privire la sancţiunile
penale interesând exerciţiul profesiei de farmacist, aplicate farmaciştilor pe
durata exercitării profesiei în România.
(3) Autorităţile competente române analizează
informaţiile transmise de statul membru gazdă cu privire la faptele grave şi
precise comise de farmaciştii cetăţeni români sau care provin din România, anterior
stabilirii acestora în statul membru gazdă şi în afara teritoriului său, fapte
care pot avea repercusiuni asupra începerii activităţii profesionale sau asupra
exercitării profesiei de farmacist în acel stat.
(4) Autorităţile competente române decid asupra
naturii şi amplorii investigaţiilor pe care le întreprind în situaţiile pentru
care au fost sesizate şi comunică statului membru gazdă consecinţele care
rezultă cu privire la atestatele şi documentele pe care le-au emis în cazurile
respective.
Art. 574. - (1) Autorităţile competente române
colaborează îndeaproape cu autorităţile competente omoloage ale statelor membre
ale Uniunii Europene, ale statelor aparţinând Spaţiului Economic European şi,
respectiv, ale Confederaţiei Elveţiene, asigurând confidenţialitatea
informaţiilor transmise.
(2) Schimbul de informaţii privind sancţiunile
disciplinare sau penale aplicate în caz de fapte grave şi precise, susceptibile
de a avea consecinţe asupra activităţilor de farmacist, se va face cu
respectarea prevederilor Legii nr. 506/2004 privind prelucrarea datelor cu
caracter personal şi protecţia vieţii private în sectorul comunicaţiilor
electronice şi a prevederilor Legii nr. 677/2001 pentru protecţia persoanelor
cu privire la prelucrarea datelor cu caracter personal şi libera circulaţie a
acestor date, cu modificările şi completările ulterioare.
Art. 575. - (1) Farmaciştii cetăţeni ai unui stat
membru al Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European
sau ai Confederaţiei Elveţiene, care exercită profesia de farmacist în România,
au obligaţia de a se informa la autorităţile competente cu privire la
legislaţia care reglementează sectorul de sănătate, domeniul securităţii
sociale, precum şi cu privire la Codul deontologic al farmacistului.
(2) In vederea furnizării informaţiilor prevăzute la
alin. (1), autorităţile competente române vor organiza la nivelul structurilor
teritoriale şi centrale birouri de informare legislativă.
(3) Farmaciştii cetăţeni ai unui stat membru al
Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European sau ai
Confederaţiei Elveţiene, care exercită profesia ca urmare a recunoaşterii
calificării profesionale de către autorităţile competente române, trebuie să
posede cunoştinţele lingvistice necesare desfăşurării activităţilor
profesionale în România.
CAPITOLUL III
Organizarea şi funcţionarea Colegiului Farmaciştilor
din România
SECŢIUNEA 1
Dispoziţii generale
Art. 576. - (1) Colegiul Farmaciştilor din România este
organism profesional, apolitic, fără scop patrimonial, de drept public, cu
responsabilităţi delegate de autoritatea de stat, în domeniul autorizării,
controlului şi supravegherii profesiei de farmacist ca profesie liberală, de
practică publică autorizată.
(2) Colegiul Farmaciştilor din România are autonomie
instituţională în domeniul său de competenţă, normativ şi jurisdicţional
profesional.
(3) Ministerul Sănătăţii Publice urmăreşte modul de
respectare a prevederilor legale în activitatea Colegiului Farmaciştilor din
România.
(4) Colegiul Farmaciştilor din România cuprinde toţi
farmaciştii care întrunesc condiţiile prevăzute la art. 553 lit. a), c) şi e),
precum şi farmaciştii stabiliţi în România care întrunesc condiţiile prevăzute
la art. 553 lit. b), d) şi f) şi care exercită profesia de farmacist în
condiţiile prezentei legi şi sunt înregistraţi la colegiile teritoriale.
Art. 577. - Colegiul Farmaciştilor din România se
organizează şi funcţionează pe criterii teritoriale, la nivel naţional şi
judeţean, respectiv la nivelul municipiului Bucureşti.
Art. 578. - (1) Intre Colegiul Farmaciştilor din
România şi colegiile teritoriale există raporturi de autonomie funcţională,
organizatorică şi financiară, în condiţiile legii.
(2) Sediul Colegiului Farmaciştilor din România este în
municipiul Bucureşti.
SECŢIUNEA a 2-a
Atribuţiile Colegiului Farmaciştilor din România
Art. 579. - Colegiul Farmaciştilor din România are
următoarele atribuţii:
a) colaborează în domeniul său de competenţă cu Ministerul
Sănătăţii Publice prin asigurarea controlului aplicării regulamentelor şi
normelor care organizează şi reglementează exercitarea profesiei de farmacist,
indiferent de forma de exercitare şi de unitatea farmaceutică în care se
desfăşoară;
b) apără demnitatea şi promovează drepturile şi
interesele membrilor săi în toate sferele de activitate; apără onoarea,
libertatea şi independenţa profesională a farmacistului, precum şi dreptul
acestuia de decizie în exercitarea actului profesional; asigură respectarea de
către farmacişti a obligaţiilor ce le revin faţă de pacient şi de sănătatea
publică;
c) atestă onorabilitatea şi moralitatea profesională
a membrilor săi;
d) întocmeşte şi actualizează permanent Registrul unic
al farmaciştilor din România, administrează pagina de Internet de publicare a
acestuia şi înaintează trimestrial
Ministerului Sănătăţii Publice un raport privind
situaţia numerică a membrilor săi, precum şi a evenimentelor înregistrate în
domeniul autorizării, controlului şi supravegherii profesiei de farmacist;
e) elaborează şi adoptă Regulamentul de organizare şi
funcţionare a Colegiului Farmaciştilor din România şi Codul deontologic al
farmacistului;
f) colaborează în domeniul său de competenţă cu
Ministerul Sănătăţii Publice la formarea, specializarea şi perfecţionarea
pregătirii profesionale a farmaciştilor;
g) avizează, conform regulamentelor de organizare şi
funcţionare a unităţilor farmaceutice, fişa de atribuţii a postului de
farmacist, întocmită obligatoriu la nivelul fiecărei farmacii;
h) colaborează cu Ministerul Sănătăţii Publice în
vederea stabilirii şi creşterii standardelor de practică profesională, a
asigurării calităţii actului farmaceutic în unităţile farmaceutice;
i) colaborează cu Ministerul Sănătăţii Publice şi
participă, prin reprezentanţii săi, la activitatea de inspecţie farmaceutică
organizată de acesta, inclusiv pe bază de tematici comune de inspecţie şi
control;
j) colaborează cu Ministerul Sănătăţii Publice la
elaborarea metodologiei de acordare a gradului profesional şi a tematicii de
concurs;
k) iniţiază, promovează, organizează şi acreditează în
domeniul său de competenţă forme de educaţie farmaceutică continuă şi de
ridicare a gradului de competenţă profesională a membrilor săi, cu excepţia programelor
de studii complementare în vederea obţinerii de atestate;
l) controlează modul în care
sunt respectate de către angajatori independenţa profesională şi dreptul de
decizie profesională ale farmacistului;
m) reprezintă şi apără în domeniul său de competenţă
interesele membrilor, la solicitarea acestora, în faţa angajatorilor;
n) promovează şi stabileşte relaţii pe plan extern cu
instituţii şi organizaţii similare;
o) colaborează în domeniul său de competenţă cu
Ministerul Sănătăţii Publice la elaborarea reglementărilor profesiei de
farmacist;
p) organizează judecarea cazurilor de încălcare a
normelor de deontologie profesională ori a celor care reglementează exercitarea
profesiei sau a actului profesional;
q) organizează centre de pregătire lingvistică,
necesare pentru exercitarea activităţii profesionale de către farmaciştii
cetăţeni ai statelor membre ale Uniunii Europene, ai statelor aparţinând
Spaţiului Economic European sau ai Confederaţiei Elveţiene;
r) colaborează în domeniul său de competenţă cu
Ministerul Sănătăţii Publice, organizaţii patronale şi sindicale, precum şi cu
alte asociaţii ori cu organizaţii neguvernamentale, în toate problemele ce
privesc asigurarea sănătăţii populaţiei.
Art. 580. - In exercitarea atribuţiilor prevăzute de
prezentul titlu, Colegiul Farmaciştilor din România, prin structurile naţionale
sau teritoriale, are dreptul de a formula acţiune în justiţie în nume propriu
sau în numele membrilor săi.
SECŢIUNEA a 3-a
Membrii Colegiului Farmaciştilor din România
Art. 581. - (1) In vederea exercitării profesiei de
farmacist, farmaciştii cetăţeni români şi farmaciştii cetăţeni ai unui stat
membru al Uniunii Europene, ai unui stat aparţinând Spaţiului Economic European sau ai Confederaţiei
Elveţiene, stabiliţi în România, precum şi farmaciştii care întrunesc
condiţiile prevăzute la art. 553 lit. c) şi e) au obligaţia să se înscrie în
Colegiul Farmaciştilor din România.
(2) La data intrării în vigoare a prezentei legi au
de drept calitatea de membru al Colegiului Farmaciştilor din România toţi
farmaciştii înscrişi până la acea dată.
(3) Calitatea de membru al Colegiului Farmaciştilor
din România o pot păstra, la cerere, şi farmaciştii pensionari care au
practicat profesia de farmacist.
(4) Membrii Colegiului Farmaciştilor din România sunt
înscrişi în Registrul unic al farmaciştilor din România, care se publică pe
pagina de Internet a Colegiului Farmaciştilor din
România.
Art. 582. - (1) La cerere, membrii Colegiului
Farmaciştilor din România care, din motive obiective, întrerup pe o durată de
până la 5 ani exercitarea profesiei de farmacist pot solicita suspendarea
calităţii de membru pe acea durată.
(2) Pe durata suspendării la
cerere a calităţii de membru al Colegiului Farmaciştilor din România se
suspendă obligaţiile şi drepturile ce decurg din prezenta lege.
(3) Intreruperea exercitării profesiei de farmacist pe
o durată mai mare de 5 ani atrage, de drept, pierderea calităţii de membru al
Colegiului Farmaciştilor din România.
(4) O nouă înscriere se poate face numai în
condiţiile prezentei legi şi cu avizul favorabil al Consiliului naţional al
Colegiului Farmaciştilor din România.
Art. 583. - Farmaciştii care doresc să exercite
profesia se înscriu ca membri ai Colegiului Farmaciştilor din România la
colegiul teritorial în raza căruia se află unitatea la care îşi desfăşoară
activitatea sau la colegiul teritorial în raza căruia îşi au domiciliul sau
reşedinţa, dacă nu au încă un loc de muncă.
SECŢIUNEA a 4-a
Drepturile şi obligaţiile membrilor Colegiului
Farmaciştilor din România
Art. 584. - Membrii Colegiului Farmaciştilor din
România au următoarele drepturi:
a) să aleagă şi să fie aleşi în organele de conducere
de la nivelul structurilor teritoriale sau naţionale ale Colegiului
Farmaciştilor din România;
b) să se adreseze organelor abilitate ale Colegiului
Farmaciştilor din România şi să primească informaţiile solicitate;
c) să participe la orice acţiune a Colegiului
Farmaciştilor din România şi să fie informaţi în timp util despre aceasta;
d) să folosească, împreună cu membrii săi de familie,
toate dotările sociale, profesionale, culturale şi sportive ale Colegiului
Farmaciştilor din România şi ale colegiilor locale;
e) să poarte însemnele Colegiului Farmaciştilor din
România;
f) să conteste sancţiunile primite;
g) să solicite ajutoare materiale pentru situaţii
deosebite, atât personal, cât şi prin membrii lor de familie.
Art. 585. - Obligaţiile membrilor Colegiului
Farmaciştilor din România sunt următoarele:
a) să respecte dispoziţiile Regulamentului de
organizare şi funcţionare a Colegiului Farmaciştilor din România, Codul
deontologic al farmacistului, hotărârile organelor de conducere ale Colegiului
Farmaciştilor din România şi regulamentele profesiei;
b) să rezolve sarcinile ce le-au fost încredinţate în
calitate de membri sau reprezentanţi ai corpului profesional;
c) să participe la manifestările iniţiate de organele
de conducere, la activităţile profesionale ori de pregătire profesională
iniţiate ori organizate de către organele de conducere naţionale sau locale;
d) să participe la şedinţele ori adunările la care au
fost convocaţi;
e) să execute cu bună-credinţă sarcinile ce decurg din
hotărârile organelor de conducere ale corpului profesional;
f) să se abţină de la deliberările organelor de
conducere în care sunt aleşi, în cazul în care, în îndeplinirea unor atribuţii
ale acestor organe, au un interes propriu;
g) să păstreze secretul profesional;
h) să respecte normele, principiile şi îndatoririle
deontologiei profesionale şi să aibă un comportament demn în exercitarea
profesiei ori a calităţii de membru al Colegiului Farmaciştilor din România;
i) să achite, în termenul stabilit, cotizaţia datorată
în calitate de membru al Colegiului Farmaciştilor din România;
j) să rezolve litigiile cu alţi membri, în primul rând
prin intermediul medierii de către comisiile de specialitate din cadrul
Colegiului Farmaciştilor din România;
k) să execute cu bună-credinţă atribuţiile ce le revin
în calitate de reprezentant sau membru în organele de conducere ale Colegiului
Farmaciştilor din România, ale colegiilor judeţene, respectiv al municipiul
Bucureşti.
Art. 586. - Obligaţiile membrilor Colegiului
Farmaciştilor din România, ce decurg din calitatea lor specială de farmacişti,
sunt următoarele:
a) să respecte şi să aplice în orice împrejurare
normele de deontologie farmaceutică;
b) să nu aducă prejudicii reputaţiei corpului
profesional sau altor membri, respectând statutul de corp profesional al
Colegiului Farmaciştilor din România;
c) să acţioneze, pe toată durata exercitării
profesiei, în vederea creşterii gradului de pregătire profesională şi
cunoaşterii noutăţilor profesionale;
d) să respecte drepturile legale ale pacienţilor;
e) să acorde, cu promptitudine, asistenţă
farmaceutică de urgenţă, ca o îndatorire fundamentală, profesională şi civică.
Art. 587. - (1) In vederea creşterii gradului de
pregătire profesională şi asigurării unui nivel ridicat al cunoştinţelor
profesionale, farmaciştii sunt obligaţi să urmeze un număr de cursuri de pregătire
şi alte forme de educaţie continuă şi informare în domeniul ştiinţelor
profesionale, pentru cumularea numărului de credite stabilit în acest sens de
către Colegiul Farmaciştilor din România. Sunt creditate programele, precum şi
celelalte forme de educaţie farmaceutică continuă avizate de Colegiul
Farmaciştilor din România.
(2) Farmaciştii care nu realizează pe parcursul a 3 ani
numărul minim de credite de educaţie profesională continuă stabilit de
Consiliul Naţional al Colegiului Farmaciştilor din România sunt suspendaţi din
exerciţiul profesiei, până la realizarea numărului de credite respectiv.
SECŢIUNEA a 5-a
Organizarea şi funcţionarea
A. Organizarea la nivel teritorial
Art. 588. - (1) La nivelul fiecărui judeţ, respectiv al
municipiului Bucureşti, se organizează câte un colegiu al farmaciştilor, format
din toţi farmaciştii care exercită profesia în unitatea
administrativ-teritorială respectivă.
(2) Colegiile farmaciştilor au
personalitate juridică, patrimoniu şi buget propriu.
(3) Personalitatea juridică se dobândeşte de la data
constituirii şi înregistrării la administraţia financiară în raza căreia se
află sediul instituţiei.
(4) Sediul colegiului este în
oraşul de reşedinţă a judeţului, respectiv în municipiul Bucureşti, pentru
Colegiul Farmaciştilor Bucureşti.
(5) Nici un colegiu teritorial nu poate funcţiona în
afara Colegiului Farmaciştilor din România.
Art. 589. - Organele de conducere ale colegiului
teritorial sunt:
a) adunarea generală a farmaciştilor;
b) consiliul;
c) biroul consiliului;
d) preşedintele.
Art. 590. - (1) Adunarea generală este formată din toţi
farmaciştii înscrişi în colegiul teritorial respectiv.
(2) Adunarea generală se
întruneşte anual, în primul trimestru, la convocarea consiliului, şi adoptă
hotărâri cu majoritate simplă, în prezenţa a două treimi din numărul membrilor
săi. Dacă la prima convocare nu s-a realizat majoritatea de două treimi, după
10 zile se organizează o nouă şedinţă, cu aceeaşi ordine de zi, care va adopta hotărâri
indiferent de numărul membrilor prezenţi, dar nu mai puţin de jumătate plus unu
din totalul membrilor.
(3) Adunarea generală are următoarele atribuţii:
a) aprobă proiectul de buget al colegiului şi, în
baza raportului cenzorilor, descarcă de gestiune consiliul pentru anul fiscal
încheiat;
b) alege, dintre membrii săi, consiliul colegiului şi
reprezentanţii în Adunarea generală naţională a Colegiului Farmaciştilor din
România;
c) stabileşte indemnizaţia de
şedinţă a membrilor comisiei de disciplină;
d) alege comisia de cenzori a colegiului.
Art. 591. - (1) Membrii consiliului structurilor
teritoriale şi reprezentanţii în Adunarea generală naţională se aleg pe o
perioadă de 4 ani de către adunările generale teritoriale prin vot secret şi în
condiţiile participării a minimum două treimi din numărul membrilor adunării
generale.
(2) Dacă la adunarea de alegeri nu se realizeză
condiţia de participare, după două săptămâni se va organiza un nou scrutin care
va alege reprezentanţii, indiferent de numărul participanţilor.
Art. 592. - (1) Colegiul colegiului are un număr de
membri proporţional cu numărul farmaciştilor înscrişi în evidenţa colegiului la
data organizării alegerilor, după cum urmează:
a) 7 membri, pentru un număr de până la 100 de
farmacişti înscrişi;
b) 11 membri, pentru un număr de 101 până la 500 de
farmacişti înscrişi;
c) 13 membri, pentru un număr de 501 până la 1.000 de
farmacişti înscrişi;
d) 19 membri, pentru un număr de peste 1.000 de
farmacişti înscrişi.
(2) Consiliul judeţean sau al municipiului Bucureşti,
după caz, are un număr de 3-11 membri supleanţi, aleşi de adunarea generală.
Art. 593. - Consiliul colegiului teritorial exercită
atribuţiile prevăzute de lege şi date în competenţa sa prin Statutul Colegiului
Farmaciştilor din România sau prin hotărârea Consiliului naţional.
Art. 594 - (1) Consiliul colegiului teritorial, în
prima şedinţă organizată în termen de maximum 5 zile de la alegere, alege
biroul consiliului.
(2) Biroul consiliului este format dintr-un preşedinte,
3 vicepreşedinţi şi un secretar.
B. Organizarea la nivel
naţional
Art. 595. - (1) Colegiul Farmaciştilor din România este
format din toţi farmaciştii înscrişi în colegiile teritoriale.
(2) Colegiul Farmaciştilor din
România are personalitate juridică, patrimoniu şi buget propriu. Bugetul se
formează din contribuţia colegiilor teritoriale, în cote stabilite de Consiliul
naţional. Patrimoniul poate fi folosit şi în activităţi producătoare de
venituri, în condiţiile legii.
Art. 596. - Organele de conducere, la nivel naţional,
ale Colegiului Farmaciştilor din România sunt:
a) Adunarea generală naţională;
b) Consiliul naţional;
c) Biroul executiv;
d) preşedintele.
Art. 597. - (1) Adunarea generală naţională este
alcătuită din preşedinţii colegiilor teritoriale şi reprezentanţi aleşi de
adunările generale locale prin vot direct şi secret.
(2) Norma de reprezentare în adunarea generală este
de 1/50 de membri.
(3) Reprezentanţii în adunarea generală sunt aleşi pe
o durată de 4 ani.
(4) Proporţional cu numărul de farmacişti înscrişi în
evidenţa colegiului teritorial, se vor alege 3-11 membrii supleanţi.
Art. 598. - Adunarea generală naţională are următoarele
atribuţii:
a) adoptă Statutul Colegiului Farmaciştilor din
România, precum şi Codul deontologic al farmacistului;
b) aprobă modificarea acestora;
c) aprobă bugetul de venituri şi cheltuieli şi
execuţia celui pentru exerciţiul financiar expirat;
d) alege, dintre membrii săi, comisia de cenzori;
e) adoptă declaraţii care să reflecte poziţia
Colegiului Farmaciştilor din România cu privire la aspecte de interes general
în ceea ce priveşte profesia de farmacist ori statutul farmacistului în
societate;
f) revocă din funcţie membri aleşi, pentru abateri de
la prevederile prezentei legi şi, respectiv, ale Regulamentului de organizare
şi funcţionare a Colegiului Farmaciştilor din România, care aduc prejudicii
activităţii organismului profesional.
Art. 599. - (1) Adunarea generală naţională adoptă
hotărâri în prezenţa a cel puţin două treimi din numărul membrilor săi, cu
majoritate simplă de voturi.
(2) Dacă la prima convocare nu se realizează condiţia
de cvorum, după două săptămâni se va organiza o altă şedinţă, cu aceeaşi ordine
de zi, care va putea adopta hotărâri indiferent de numărul membrilor prezenţi,
cu excepţia situaţiilor prevăzute la art. 598 lit. a) şi b), pentru care este
necesară condiţia de cvorum prevăzută de lege.
(3) Adunarea generală naţională se întruneşte în
şedinţă ordinară în primul trimestru al anului în curs.
Art. 600. - Adunarea generală naţională este condusă de
preşedintele Colegiului Farmaciştilor din România.
Art. 601. - (1) Consiliul naţional al Colegiului
Farmaciştilor din România este alcătuit din preşedinţii colegiilor teritoriale,
3 reprezentanţi ai Colegiului Farmaciştilor din Bucureşti, respectiv
preşedintele şi 2 vicepreşedinţi, un reprezentant numit de Ministerul Sănătăţii
Publice ca autoritate de stat şi câte un reprezentant al farmaciştilor din
fiecare minister ori instituţie centrală cu reţea sanitară proprie. Consiliul
naţional al Colegiului Farmaciştilor din România poate fi asistat, cu rol
consultativ, de către un reprezentant al Academiei de Ştiinţe Medicale, al
Ministerului Muncii, Solidarităţii Sociale şi Familiei şi al Ministerului Justiţiei.
(2) Cheltuielile de deplasare şi diurna
reprezentanţilor în Consiliul naţional al Colegiului Farmaciştilor din România vor fi suportate de către colegiile
teritoriale ai căror reprezentanţi sunt.
(3) Consilul naţional al Colegiului Farmaciştilor din
România se întruneşte legal în prezenţa a cel puţin două treimi din numărul
reprezentanţilor prevăzuţi la alin. (1).
Art. 602. - Consiliul naţional lucrează în prezenţa a
două treimi din numărul membrilor cu drept de vot şi decide cu o majoritate
absolută de voturi, cu excepţia deciziilor referitoare la cotizaţie, pentru
care sunt necesare voturile favorabile a două treimi din numărul total al
membrilor.
Art. 603. - Deciziile Consiliului naţional al
Colegiului Farmaciştilor din România sunt obligatorii pentru colegiile
teritoriale şi pentru toţi farmaciştii care practică profesia de farmacist în
România.
Art. 604. - Atribuţiile Consiliului naţional sunt
următoarele:
a) elaborează Statutul Colegiului Farmaciştilor din
România, precum şi proiectele de modificare a acestuia;
b) elaborează Codul deontologic al farmacistului,
precum şi proiectele de modificare a acestuia;
c) colaborează cu Ministerul Sănătăţii Publice la
elaborarea Nomenclatorului de specialităţi medicale, medico-dentare şi
farmaceutice pentru reţeaua de asistenţă medicală;
d) colaborează cu Ministerul Sănătăţii Publice la
elaborarea tematicilor, metodologiilor, concursurilor şi examenelor pentru
farmacişti;
e) stabileşte sistemul de credite de educaţie
continuă, pe baza căruia se evaluează activitatea de perfecţionare profesională
a farmaciştilor;
f) colaborează cu Ministerul Sănătăţii Publice la
elaborarea normelor privind exercitarea profesiei de farmacist pe teritoriul
României;
g) colaborează cu Ministerul Sănătăţii Publice şi Ministerul
Educaţiei şi Cercetării la elaborarea strategiei şi programelor privind
dezvoltarea învăţământului farmaceutic;
h) fixează cotizaţia care trebuie plătită obligatoriu
de către fiecare farmacist consiliului judeţean sau al municipiului Bucureşti,
stabilind partea din această cotizaţie care trebuie virată către Consiliul
naţional al Colegiului Farmaciştilor din România;
i) gestionează bunurile Colegiului Farmaciştilor din
România şi poate să creeze şi să subvenţioneze acţiuni interesând profesiunea,
acţiuni de întrajutorare sau de sponsorizare;
j) soluţionează, prin comisiile de specialitate ale
Colegiului Farmaciştilor din România, în termen de 30 de zile de la
înregistrare, contestaţiile formulate împotriva deciziilor date de consiliile
judeţene, respectiv al municipiului Bucureşti, în conformitate cu regulamentele
proprii;
k) alege, dintre membrii săi, Biroul executiv al
Colegiului Farmaciştilor din România;
l) propune Adunării generale
naţionale proiectul privind bugetul de venituri şi cheltuieli al Colegiului
Farmaciştilor din România;
m) alege, dintre membrii săi, pe cei care vor forma
comisiile de lucru;
n) stabileşte indemnizaţiile membrilor Biroului
executiv şi indemnizaţia de şedinţă a membrilor Comisiei superioare de
disciplină;
o) avizează reînscrierea farmaciştilor care au pierdut
calitatea de membru al Colegiului Farmaciştilor din România, conform Codului
deontologic al farmacistului.
Art. 605. - (1) Consiliul naţional stabileşte, în
domeniul său de competenţă, strategia şi planul anual de control şi
supraveghere a modului de exercitare a profesiei de farmacist, precum şi condiţiile în care se desfăşoară aceasta.
(2) Reprezentanţii Colegiului Farmaciştilor din
România, anume desemnaţi, au dreptul de a desfăşura activităţi de control şi
supraveghere privind modul de exercitare a profesiei de farmacist în toate
unităţile farmaceutice din România.
Art. 606. - Biroul executiv al Colegiului Farmaciştilor
din România este format dintr-un preşedinte, 3 vicepreşedinţi şi un secretar
general, aleşi în mod individual de către Consiliul naţional dintre membrii
săi.
Art. 607. - Atribuţiile Biroului executiv sunt
următoarele:
a) asigură activitatea permanentă a Colegiului
Farmaciştilor din România între şedinţele Consiliului naţional;
b) aprobă angajarea de personal şi asigură execuţia
bugetului Colegiului Farmaciştilor din România;
c) întocmeşte raportul anual de activitate şi
gestiune, pe care îl supune aprobării Consiliului naţional;
d) acceptă donaţiile, legatele şi sponsorizările
făcute Colegiului Farmaciştilor din România şi le face publice în presa de
specialitate;
e) execută hotărârile Adunării generale naţionale şi
ale Consiliului naţional;
f) elaborează şi supune spre avizare Consiliului
naţional proiectul bugetului de venituri şi cheltuieli, pe baza bugetelor de
venituri şi cheltuieli ale colegiilor teritoriale;
g) informează Consiliul naţional cu privire la
deciziile emise între şedinţele Consiliului;
h) îndeplineşte orice alte sarcini stabilite de către
Consiliul naţional.
Art. 608. - Biroul executiv coordonează activitatea
comisiilor de lucru ale Consiliului naţional al Colegiului Farmaciştilor din
România.
Art. 609. - In exercitarea mandatului, membrii Biroului
executiv, precum şi membrii birourilor consiliilor colegiilor teritoriale vor
primi o indemnizaţie lunară, al cărei cuantum va fi aprobat, după caz, de
Consiliul naţional, respectiv consiliile colegiilor teritoriale.
Art. 610. - Preşedintele Biroului executiv al
Consiliului naţional este preşedintele Colegiului Farmaciştilor din România.
Art. 611. - Atribuţiile preşedintelui Colegiului
Farmaciştilor din România sunt următoarele:
a) reprezintă Colegiul Farmaciştilor din România în
relaţiile cu persoanele fizice şi juridice din ţară şi din străinătate;
b) încheie contracte şi convenţii în numele
Colegiului Farmaciştilor din România, cu aprobarea Biroului executiv;
c) convoacă şi conduce şedinţele Adunării generale,
ale Consiliului naţional;
d) aduce la îndeplinire deciziile Biroului executiv, hotărârile Consiliului naţional date în sarcina sa şi rezolvă
problemele şi lucrările curente;
e) angajează personalul de specialitate şi
administrativ;
f) îndeplineşte orice alte sarcini încredinţate de
Consiliul naţional ori de Biroul executiv.
Art. 612. - (1) Nu pot primi
sau exercita mandatul de membru al organelor de conducere ale Colegiului
Farmaciştilor din România, atât la nivel naţional, cât şi teritorial,
farmaciştii care deţin funcţii de conducere în cadrul Ministerului Sănătăţii
Publice, respectiv al ministerelor şi instituţiilor cu reţea sanitară proprie,
al structurilor deconcentrate ale acestuia ori în cadrul Casei Naţionale de
Asigurări de Sănătate, al caselor judeţene de asigurări de sănătate şi a
municipiului Bucureşti, al patronatelor şi sindicatelor profesionale, precum şi
orice fel de funcţii de demnitate publică.
(2) Farmaciştii pentru care pe timpul exercitării
mandatului de membru al organelor de conducere a survenit situaţia de
incompatibilitate pierd de drept mandatul încredinţat, urmând ca locul rămas
vacant să fie ocupat, după caz, de primul membru aflat pe lista supleanţilor
sau prin organizarea unei noi alegeri.
(3) Numărul de mandate în organele de conducere de la
nivel teritorial şi naţional este de maximum două, care pot fi şi consecutive.
SECŢIUNEA a 6-a
Răspunderea disciplinară
Art. 613. - Farmacistul răspunde disciplinar pentru
nerespectarea legilor şi regulamentelor profesionale, a Codului deontologic al
farmacistului şi a regulilor de bună practică profesională, a Statutului
Colegiului Farmaciştilor din România, pentru nerespectarea deciziilor
obligatorii adoptate de organele de conducere ale Colegiului Farmaciştilor din
România, precum şi pentru orice fapte săvârşite în legătură cu profesia sau în
afara acesteia, care sunt de natură să prejudicieze onoarea şi prestigiul
profesiei sau ale Colegiului Farmaciştilor din România.
Art. 614. - (1) In cazurile prevăzute la art. 613,
plângerea împotriva unui farmacist se depune la colegiul al cărui membru este.
(2) Biroul consiliului, în
baza anchetei disciplinare efectuate de către departamentul de jurisdicţie
profesională, poate decide:
a) respingerea plângerii ca vădit nefondată;
b) solicitarea completării anchetei disciplinare;
c) dispunerea trimiterii dosarului disciplinar la comisia de disciplină.
(3) Impotriva deciziei de respingere a plângerii
persoana care a făcut plângerea poate depune contestaţie la colegiul a cărui
decizie se contestă. Aceasta se soluţionează de către Biroul executiv al
Consiliului naţional.
Art. 615. - (1) In cadrul fiecărui colegiu teritorial
se organizează şi funcţionează o comisie de disciplină, constituită din 3
membri, independentă de conducerea colegiului, care judecă abaterile
disciplinare săvârşite de farmaciştii cuprinşi în acel colegiu.
(2) In cadrul Colegiului Farmaciştilor din România se
organizează şi funcţionează Comisia superioară de disciplină.
(3) Procedura judecării abaterilor este prevăzută în
Statutul Colegiului Farmaciştilor din România, cu respectarea principiului
egalităţii, a dreptului de apărare, precum şi a principiului
contradictorialităţii.
Art. 616. - (1) Membrii comisiilor de disciplină de la
nivelul colegiului teritorial sunt aleşi de către adunarea generală judeţeană,
respectiv de cea a municipiului Bucureşti, iar membrii Comisiei superioare de
disciplină vor fi aleşi de către Adunarea generală naţională.
(2) Membrii comisiilor de disciplină vor fi aleşi din
rândul farmaciştilor cu o vechime de peste 7 ani în profesie şi care nu au avut
abateri disciplinare în ultimii 5 ani.
(3) Funcţia de membru al comisiei de disciplină este
incompatibilă cu orice altă funcţie în cadrul Colegiului Farmaciştilor din
România.
(4) Durata mandatului membrilor comisiilor de
disciplină este de 4 ani.
(5) Unul dintre membrii comisiilor
de disciplină este desemnat de autorităţile de sănătate publică, la nivel
teritorial, şi de către Ministerul Sănătăţii Publice, la nivelul Comisiei
superioare de disciplină.
(6) Calitatea de membru al comisiilor de disciplină
încetează prin deces, demisie, pierderea calităţii de membru al Colegiului Farmaciştilor din
România ori prin numirea unui alt reprezentant în cazul membrilor desemnaţi de
către Ministerul Sănătăţii Publice sau autoritatea de sănătate publică.
Art. 617. - (1) Membrii comisiilor
de disciplină se aleg prin vot secret şi pe baza candidaturilor depuse.
(2) La nivel teritorial se va alege un număr de 3
membri, iar la nivel naţional 5 membri.
(3) Membrii comisiilor de disciplină îşi vor alege un
preşedinte, care conduce activitatea administrativă a comisiilor de disciplină.
(4) Preşedintele comisiei de disciplină prezintă
adunării generale raportul anual al activităţii comisiei de disciplină.
Art. 618. - (1) Sancţiunile disciplinare sunt:
a) mustrare;
b) avertisment;
c) vot de blam;
d) suspendarea calităţii de membru al Colegiului
Farmaciştilor din România pe o perioadă determinată, de la o lună la un an;
e) retragerea calităţii de membru al Colegiului
Farmaciştilor din România.
(2) Retragerea calităţii de membru al Colegiului
Farmaciştilor din România operează de drept pe durata stabilită de instanţa de
judecată prin hotărâre definitivă a instanţei judecătoreşti, cu privire la
interzicerea exercitării profesiei.
(3) La sancţiunile prevăzute la alin. (1) se poate
prevedea, după caz, obligarea celui sancţionat la efectuarea unor cursuri de
perfecţionare sau de educaţie farmaceutică ori altor forme de pregătire
profesională.
Art. 169. - (1) Decizia comisiei de disciplină se
comunică farmacistului cercetat disciplinar, persoanei care a făcut sesizarea,
Ministerului Sănătăţii Publice, Biroului executiv al Colegiului Farmaciştilor
din România şi persoanei cu care farmacistul sancţionat are încheiat contractul
de muncă.
(2) In termen de 15 zile de la comunicare, persoanele şi autorităţile prevăzute la alin. (1) pot contesta la
Comisia superioară de disciplină decizia pronunţată.
Art. 620. - (1) Acţiunea disciplinară poate fi pornită
în termen de cel mult 6 luni de la data săvârşirii faptei sau data luării la
cunoştinţă.
(2) Consecinţele executării aplicării sancţiunilor
prevăzute la art. 618 alin. (1) lit. a)-c) se radiază în termen de 6 luni de la
data executării lor, iar cea prevăzută la art. 618 alin. (1) lit. d), în termen
de un an de la data expirării perioadei de suspendare.
(3) In cazul aplicării sancţiunii prevăzute la art.
618 alin. (1) lit. e), farmacistul poate face o nouă cerere de redobândire a
calităţii de membru al colegiului, după expirarea perioadei stabilite de
instanţa judecătorească prin hotărâre penală definitivă, prin care s-a dispus
interdicţia exercitării profesiei, sau după 2 ani de la data aplicării
sancţiunii de către comisia de disciplină. Redobândirea calităţii de membru al
Colegiului Farmaciştilor din România se face în condiţiile legii.
(4) In situaţia în care prin decizia comisiei de
disciplină au fost dispuse şi măsurile prevăzute la art. 618 alin. (3),
radierea sancţiunii se va face numai după prezentarea dovezii aducerii la
îndeplinire a măsurii dispuse de comisia de disciplină.
(5) Repetarea unei abateri
disciplinare până la radierea sancţiunii aplicate constituie circumstanţă
agravantă care va fi avută în vedere la aplicarea unei noi sancţiuni.
Art. 621. - (1) Ancheta disciplinară se exercită prin
persoane desemnate de către biroul consiliului teritorial
sau, după caz, de către Biroul executiv al Colegiului
Farmaciştilor din România.
(2) Unităţile sanitare sau farmaceutice au obligaţia de
a pune la dispoziţie comisiilor de disciplină sau persoanelor desemnate cu
investigarea abaterii disciplinare documentele profesionale solicitate, precum
şi orice alte date şi informaţii necesare soluţionării cauzei.
Art. 622. - Decizia pronunţată de Comisia superioară de
disciplină, precum şi cea pronunţată de Consiliul naţional pot fi contestate la
secţia de contencios administrativ a tribunalului în a cărui circumscripţie îşi
desfăşoară activitatea farmacistul sancţionat, în termen de 30 de zile de la
comunicare.
SECŢIUNEA a 7-a
Venituri şi cheltuieli
Art. 623. - Veniturile Colegiului Farmaciştilor din România se constituie din:
a) taxa de înscriere;
b) cotizaţii lunare ale membrilor;
c) contravaloarea serviciilor prestate membrilor sau
persoanelor fizice şi juridice;
d) donaţii şi sponsorizări de la persoane fizice şi
juridice;
e) legate;
f) drepturi editoriale;
g) încasări din vânzarea publicaţiilor proprii;
h) fonduri rezultate din manifestările culturale şi
ştiinţifice;
i) organizarea de cursuri de educaţie profesională
continuă;
j) alte surse.
Art. 624. - (1) Cotizaţiile datorate şi neplătite în
termenul fixat de către consiliul teritorial de către membrii Colegiului
Farmaciştilor din România determină plata unor penalităţi de întârziere în
cuantumul prevăzut de dispoziţiile legale aplicabile instituţiilor publice.
(2) Aceeaşi măsură se va aplica şi colegiilor
teritoriale care nu varsă partea de cotizaţie stabilită de Consiliul naţional.
Art. 625. - (1) Neplata cotizaţiei datorate de membrii
Colegiului Farmaciştilor din România pe o perioadă de 3 luni şi după
atenţionarea scrisă a consiliului local se sancţionează cu suspendarea
calităţii de membru al Colegiului, până la plata cotizaţiei datorate.
(2) Sancţiunea se aplică de către comisia locală de
disciplină, la sesizarea comisiei administrative şi financiar-contabile a
colegiului teritorial.
Art. 626. - Pentru serviciile prestate persoanelor care
nu sunt membre ale Colegiului Farmaciştilor din România, tarifele se stabilesc,
după caz, de către Consiliul naţional, respectiv consiliul colegiului
teritorial.
Art. 627. - (1) Cuantumul cotizaţiei
de membru al Colegiului Farmaciştilor din România, precum şi partea din aceasta
care trebuie vărsată către forurile naţionale se stabilesc de către Consiliul
naţional al Colegiului Farmaciştilor din România.
(2) Partea din cotizaţie aferentă funcţionării
structurii naţionale va fi virată până cel mai târziu la sfârşitul lunii
următoare aceleia pentru care a fost percepută cotizaţia.
Art. 628. - (1) Partea de cotizaţie datorată Colegiului
Farmaciştilor din România de către consiliile colegiilor teritoriale se va vira
către acesta înaintea altor plăţi.
(2) Obligaţia urmăririi şi efectuării vărsării cotei
aferente Colegiului Farmaciştilor din România revine preşedintelui consiliului
colegiului teritorial.
Art. 629. - Veniturile pot fi utilizate pentru cheltuieli cu organizarea şi funcţionarea,
cheltuieli de personal, cheltuieli materiale şi servicii, cheltuieli de
capital, perfecţionarea pregătirii profesionale, acordarea de burse prin
concurs farmaciştilor, întrajutorarea farmaciştilor cu venituri mici, crearea
de instituţii cu scop filantropic şi ştiinţific, alte cheltuieli aprobate, după
caz, de consiliul colegiului teritorial, respectiv de Consiliul naţional.
CAPITOLUL IV
Rolul, atribuţiile şi drepturile autorităţii de stat
Art. 630. - Ministerul Sănătăţii Publice, în calitate de autoritate de stat, urmăreşte ca
activitatea Colegiului Farmaciştilor din România să se desfăşoare în condiţiile
legii.
Art. 631. - Reprezentantul autorităţii de stat cu
rangul de secretar de stat în Ministerul Sănătăţii Publice este membru al
Consiliului naţional al Colegiului Farmaciştilor din România şi este numit prin
ordin al ministrului sănătăţii publice.
Art. 632. - In cazul în care reprezentantul autorităţii
de stat constată că nu sunt respectate prevederile legale, acesta sesizează
organele de conducere ale Colegiului Farmaciştilor din România. In termen de 15
zile de la efectuarea demersului acestea adoptă măsurile necesare de încadrare
în normele în vigoare şi informează Ministerul Sănătăţii Publice în acest sens.
Art. 633. - In cazul nerespectării prevederilor art.
632, Ministerul Sănătăţii Publice se adresează instanţelor judecătoreşti
competente.
CAPITOLUL V
Dispoziţii tranzitorii şi finale
Art. 634. - Practicarea profesiei de farmacist de o
persoană care nu are această calitate constituie infracţiune şi se pedepseşte
conform Codului penal.
Art. 635. - In vederea facilitării accesului la
exercitarea profesiei de farmacist pe teritoriul României, Ministerul Sănătăţii
Publice, în colaborare cu Colegiul Farmaciştilor din România, recunoaşte
calificările de farmacist dobândite în conformitate cu normele Uniunii
Europene, într-un stat membru al Uniunii Europene, într-un stat aparţinând
Spaţiului Economic European sau în Confederaţia Elveţiană, de către cetăţenii acestor
state, iar încadrarea în muncă se face conform legii.
Art. 636. - (1) Normele privind recunoaşterea
diplomelor, certificatelor şi titlurilor de farmacist eliberate de un stat
membru al Uniunii Europene, de un stat aparţinând Spaţiului Economic European
şi de Confederaţia Elveţiană cetăţenilor acestora se elaborează de către
Ministerul Sănătăţii Publice, în colaborare cu Colegiul Farmaciştilor din
România, şi se aprobă prin hotărâre a Guvernului.
(2) Nomenclatorul de specialităţi medicale,
medico-dentare şi farmaceutice pentru reţeaua de asistenţă medicală se
elaborează de către Ministerul Sănătăţii Publice şi se aprobă prin ordin al
ministrului sănătăţii publice.
(3) Normele privind întocmirea, emiterea şi
utilizarea dovezilor de onorabilitate şi moralitate profesională a
farmaciştilor se elaborează în colaborare, de către autorităţile competente
române definite de prezenta lege, şi se aprobă prin hotărâre a Guvernului.
Art. 637. - (1) Atribuţiile Colegiului Farmaciştilor
din România nu pot fi exercitate de nici o altă asociaţie profesională.
(2) Colegiul Farmaciştilor din România nu se poate
substitui organizaţiilor patronale sau sindicale şi în îndeplinirea
atribuţiilor sale nu poate face uz de prerogativele acestora prevăzute de lege.
(3) Membrii Colegiului
Farmaciştilor din România pot face parte şi din alte asociaţii profesionale.
Art. 638. - Codul deontologic al farmacistului, cu
modificările şi completările ulterioare, precum şi deciziile Consiliului
naţional care privesc organizarea şi funcţionarea Colegiului Farmaciştilor din
România se publică în Monitorul Oficial al României, Partea I.
Art. 639. - Pe durata exercitării profesiei în regim
salarial sau/şi independent, farmacistul este obligat să încheie o asigurare de
răspundere civilă pentru greşeli în activitatea profesională şi să înştiinţeze
colegiul teritorial al cărui membru este.
Art. 640. - (1) Farmaciştii care ocupă funcţii publice
în cadrul aparatului central al Ministerului Sănătăţii Publice, în cadrul
autorităţilor de sănătate publică judeţene şi a municipiului Bucureşti, în
cadrul Casei Naţionale de Asigurări de Sănătate şi, respectiv, în cadrul
caselor de asigurări de sănătate judeţene şi a municipiului Bucureşti, pot
desfăşura în afara programului normal de lucru, în condiţiile legii, activităţi
profesionale, potrivit calificării pe care o deţin exclusiv în unităţi sanitare
sau farmaceutice private.
(2) Farmaciştilor prevăzuţi la alin. (1) li se aplică
în mod corespunzător prevederile art. 35 alin. (1) şi (3) din Legea nr. 53/2003
- Codul muncii, cu modificările şi completările ulterioare.
Art. 641. - La data intrării în vigoare a prezentului
titlu, se abrogă Legea nr. 305/2004 privind exercitarea profesiei de farmacist,
precum şi organizarea şi funcţionarea Colegiului Farmaciştilor din România,
publicată în Monitorul Oficial al României, Partea I,
nr. 578 din 30 iunie 2004.
Prezentul titlu transpune integral prevederile
referitoare la exerciţiul profesiei de farmacist, cuprinse în următoarele acte
normative ale Uniunii Europene:
a) art. 11 al Regulamentului
Consiliului nr. 1.612/68/CEE din 15 octombrie 1968 privind libera circulaţie a
lucrătorilor în interiorul Comunităţii Europene, publicat în Jurnalul Oficial
al Comunităţilor Europene (JOCE) nr. L 257 din 19 octombrie 1968;
b) Directiva Consiliului nr.
85/432/CEE din 16 septembrie 1985 pentru coordonarea dispoziţiilor legislative,
regulamentare şi administrative privind anumite activităţi din domeniul
farmaceutic, cu modificările şi completările ulterioare, publicată în Jurnalul Oficial
al Comunităţilor Europene (JOCE) nr. L 253 din 24 septembrie 1985, p.34;
c) Directiva Consiliului nr. 85/433/CEE din 16
septembrie 1985 privind recunoaşterea reciprocă a diplomelor, certificatelor şi
a altor titluri de farmacist, inclusiv măsuri pentru facilitarea exercitării
efective a dreptului de stabilire privind anumite activităţi în domeniul
farmaceutic, cu modificările şi completările ulterioare, publicată în Jurnalul
Oficial al Comunităţilor Europene (JOCE) nr. L 253 din 24 septembrie 1985, p. 37;
d) Directiva Consiliului 2003/109/CE din 25 noiembrie
2003 privind statutul cetăţenilor din statele terţe care sunt rezidenţi pe
termen lung, publicat în Jurnalul Oficial al Comunităţilor Europene (JOCE) nr.
L 16 din 23 ianuarie 2004;
e) art. 45, art. 50 alin. (1)
şi (4), art. 51, art. 52 alin. (1), art. 53, art. 54 şi art. 56 alin. (1) şi
(2) din Directiva Consiliului 2005/36/CE din 7 septembrie 2005 privind
recunoaşterea calificărilor profesionale, publicată în Jurnalul Oficial al
Comunităţilor Europene (JOCE) nr. L 255 din 30
septembrie 2005.
TITLUL XV
Răspunderea civilă a personalului medical şi a furnizorului de produse şi
servicii medicale, sanitare şi farmaceutice
CAPITOLUL I
Răspunderea civilă a personalului medical
Art. 642. - (1) In sensul
prezentului titlu, următorii termeni se definesc astfel:
a) personalul medical este medicul, medicul dentist, farmacistul, asistentul medical şi moaşa
care acordă servicii medicale;
b) malpraxisul este
eroarea profesională săvârşită în exercitarea actului medical sau
medico-farmaceutic, generatoare de prejudicii asupra pacientului, implicând
răspunderea civilă a personalului medical şi a furnizorului de produse şi
servicii medicale, sanitare şi farmaceutice.
(2) Personalul medical răspunde civil pentru
prejudiciile produse din eroare, care includ şi neglijenţa, imprudenţa sau
cunoştinţe medicale insuficiente în exercitarea profesiunii, prin acte
individuale în cadrul procedurilor de prevenţie, diagnostic sau tratament.
(3) Personalul medical
răspunde civil şi pentru prejudiciile ce decurg din nerespectarea
reglementărilor prezentului titlu privind confidenţialitatea, consimţământul
informat şi obligativitatea acordării asistenţei medicale.
(4) Personalul medical răspunde civil pentru
prejudiciile produse în exercitarea profesiei şi atunci când îşi depăşeşte
limitele competenţei, cu excepţia cazurilor de urgenţă în care nu este
disponibil personal medical ce are competenţa necesară.
(5) Răspunderea civilă reglementată prin prezenta
lege nu înlătură angajarea răspunderii penale, dacă fapta care a cauzat
prejudiciul constituie infracţiune conform legii.
Art. 643. - (1) Toate persoanele implicate în actul
medical vor răspunde proporţional cu gradul de vinovăţie al fiecăruia.
(2) Personalul medical nu este
răspunzător pentru daunele şi prejudiciile produse în exercitarea profesiunii:
a) când acestea se datorează condiţiilor de lucru,
dotării insuficiente cu echipament de diagnostic şi tratament, infecţiilor
nosocomiale, efectelor adverse, complicaţiilor şi riscurilor în general
acceptate ale metodelor de investigaţie şi tratament, viciilor ascunse ale
materialelor sanitare, echipamentelor şi dispozitivelor medicale, substanţelor
medicale şi sanitare folosite;
b) când acţionează cu bună-credinţă în situaţii de
urgenţă, cu respectarea competenţei acordate.
CAPITOLUL II
Răspunderea civilă a furnizorilor de servicii
medicale, materiale
sanitare, aparatură, dispozitive medicale şi medicamente
Art. 644. - (1) Unităţile sanitare publice sau private,
în calitate de furnizori de servicii medicale, răspund civil, potrivit
dreptului comun, pentru prejudiciile produse în activitatea de prevenţie,
diagnostic sau tratament, în situaţia în care acestea sunt consecinţa:
a) infecţiilor nosocomiale, cu excepţia cazului când
se dovedeşte o cauză externă ce nu a putut fi controlată de către instituţie;
b) defectelor cunoscute ale dispozitivelor şi
aparaturii medicale folosite în mod abuziv, fără a fi reparate;
c) folosirii materialelor sanitare, dispozitivelor medicale, substanţelor medicamentoase şi sanitare, după
expirarea perioadei de garanţie sau a termenului de valabilitate a acestora,
după caz;
d) acceptării de echipamente şi dispozitive medicale,
materiale sanitare, substanţe medicamentoase şi sanitare de la furnizori, fără
asigurarea prevăzută de lege, precum şi subcontractarea de servicii medicale
sau nemedicale de la furnizori fără asigurare de răspundere civilă în domeniul
medical.
(2) Unităţile prevăzute la alin. (1) răspund în
condiţiile legii civile pentru prejudiciile produse de
personalul medical angajat, în solidar cu acesta.
Art. 645. - Unităţile sanitare publice sau private,
furnizoare de servicii medicale, răspund civil şi pentru prejudiciile cauzate,
în mod direct sau indirect, pacienţilor, generate de nerespectarea
reglementărilor interne ale unităţii sanitare.
Art. 646. - Unităţile sanitare publice sau private,
furnizoare de servicii medicale, şi producătorii de echipamente şi dispozitive
medicale, substanţe medicamentoase şi materiale sanitare răspund potrivit legii
civile pentru prejudiciile produse pacienţilor în activitatea de prevenţie,
diagnostic şi tratament, generate în mod direct sau indirect de viciile ascunse
ale echipamentelor şi dispozitivelor medicale, substanţelor medicamentoase şi
materiale sanitare, în perioada de garanţie/valabilitate, conform legislaţiei
în vigoare.
Art. 647. - Prevederile art. 646 se aplică în mod
corespunzător şi furnizorilor de servicii medicale sau nemedicale,
subcontractate de către unităţile sanitare publice sau private furnizoare de
servicii medicale, în cazul prejudiciilor aduse pacienţilor în mod direct sau
indirect, ca urmare a serviciilor prestate.
Art. 648. - Furnizorii de utilităţi către unităţile
sanitare publice sau private furnizoare de servicii medicale răspund civil
pentru prejudiciile cauzate pacienţilor, generate de furnizarea
necorespunzătoare a utilităţilor.
CAPITOLUL III
Acordul pacientului informat
Art. 649. - (1) Pentru a fi supus la metode de
prevenţie, diagnostic şi tratament, cu potenţial de risc pentru pacient, după
explicarea lor de către medic, medic dentist, asistent medical/moaşă, conform
prevederilor alin. (2) şi (3), pacientului i se solicită acordul scris.
(2) In obţinerea acordului scris al pacientului, medicul,
medicul dentist, asistentul medical/moaşa sunt datori să prezinte pacientului
informaţii la un nivel ştiinţific rezonabil pentru puterea de înţelegere a
acestuia.
(3) Informaţiile trebuie să conţină: diagnosticul,
natura şi scopul tratamentului, riscurile şi consecinţele tratamentului propus,
alternativele viabile de tratament, riscurile şi consecinţele lor, prognosticul
bolii fără aplicarea tratamentului.
Art. 650. - Vârsta legală pentru exprimarea
consimţământului informat este de 18 ani. Minorii îşi pot exprima
consimţământul în absenţa părinţilor sau reprezentantului legal, în următoarele
cazuri:
a) situaţii de urgenţă, când părinţii sau
reprezentantul legal nu pot fi contactaţi, iar minorul are discernământul
necesar pentru a înţelege situaţia medicală în care se află;
b) situaţii medicale legate de diagnosticul şi/sau
tratamentul problemelor sexuale şi reproductive, la solicitarea expresă a
minorului în vârstă de peste 16 ani.
Art. 651. - (1) Medicul curant, asistentul
medical/moaşa răspund atunci când nu obţin consimţământul informat al
pacientului sau al reprezentanţilor legali ai acestuia, cu excepţia cazurilor
în care pacientul este lipsit de discernământ, iar reprezentantul legal sau ruda cea mai
apropiată nu poate fi contactat, datorită situaţiei de urgenţă.
(2) Atunci când reprezentantul legal sau ruda cea mai
apropiată nu poate fi contactat, medicul, asistentul medical/moaşa pot solicita
autorizarea efectuării actului medical autorităţii tutelare sau pot acţiona
fără acordul acesteia în situaţii de urgenţă, când intervalul de timp până la
exprimarea acordului ar pune în pericol, în mod ireversibil, sănătatea şi viaţa
pacientului.
CAPITOLUL IV
Obligativitatea asigurării asistenţei medicale
Art. 652. - (1) Medicul, medicul dentist, asistentul medical/moaşa au obligaţia de a acorda asistenţă
medicală/îngrijiri de sănătate unei persoane doar dacă au acceptat-o în
prealabil ca pacient, criteriile de acceptare urmând a fi stabilite prin
normele metodologice de aplicare a prezentei legi.
(2) Medicul, medicul dentist, asistentul
medical/moaşa nu pot refuza să acorde asistenţă medicală/îngrijiri de sănătate
pe criterii etnice, religioase şi orientare sexuală sau pe alte criterii de
discriminare interzise prin lege.
(3) Medicul, medicul dentist,
asistentul medical/moaşa au obligaţia de a accepta pacientul în situaţii de
urgenţă, când lipsa asistenţei medicale poate pune în pericol, în mod grav şi
ireversibil, sănătatea sau viaţa pacientului.
Art. 653. - (1) Atunci când medicul, medicul dentist, asistentul medical/moaşa au acceptat pacientul, relaţia
poate fi întreruptă:
a) odată cu vindecarea bolii;
b) de către pacient;
c) de către medic, în următoarele situaţii:
(i) atunci când pacientul este trimis altui medic,
furnizând toate datele medicale obţinute, care
justifică asistenţa altui medic cu competenţe sporite;
(ii) pacientul manifestă o atitudine ostilă şi/sau
ireverenţioasă faţă de medic. (2) Medicul va notifica pacientului, în situaţia
prevăzută la alin. (1) lit. c) pct. (ii), dorinţa terminării relaţiei, înainte
cu minimum 5 zile, pentru ca acesta să găsească o alternativă, doar în măsura
în care acest fapt nu pune în pericol starea sănătăţii pacientului.
Art. 654. - (1) Medicul, asistentul medical/moaşa, angajaţi
ai unei instituţii furnizoare de servicii medicale, au obligaţia acordării
asistenţei medicale/îngrijirilor de sănătate pacientului care are dreptul de a
primi îngrijiri medicale/de sănătate în cadrul instituţiei, potrivit
reglementărilor legale. (2) Medicul poate refuza asigurarea asistenţei medicale
în situaţiile menţionate la art. 653 alin. (1) lit. c).
Art. 655. - (1) In acordarea asistenţei medicale/
îngrijirilor de sănătate, personalul medical are obligaţia aplicării
standardelor terapeutice, stabilite prin ghiduri de practică în specialitatea
respectivă, aprobate la nivel naţional, sau, în lipsa acestora, standardelor
recunoscute de comunitatea medicală a specialităţii respective.
(2) Colegiul Medicilor din România va elabora şi va
supune spre aprobare Ministerului Sănătăţii Publice standardele terapeutice,
stabilite prin ghiduri de practică la nivel naţional, până la intrarea în
vigoare a prezentului titlu.
CAPITOLUL V
Asigurarea obligatorie de răspundere civilă
profesională pentru
medici, farmacişti şi alte persoane din domeniul
asistenţei medicale
Art. 656. - (1) Personalul medical definit la art. 642
alin. (1) lit. a) care acordă asistenţă medicală, în sistemul public şi/sau în cel privat, într-o
locaţie cu destinaţie specială pentru asistenţă medicală, precum şi atunci când
aceasta se acordă în afara acestei locaţii, ca urmare a unei cereri exprese din
partea persoanei sau a persoanelor care necesită această asistenţă ori a unui
terţ care solicită această asistenţă pentru o persoană sau mai multe persoane
care, din motive independente de voinţa lor, nu pot apela ele însele la această
asistenţă, va încheia o asigurare de malpraxis pentru cazurile de răspundere
civilă profesională pentru prejudicii cauzate prin actul medical.
(2) O copie după asigurare va fi prezentată înainte de
încheierea contractului de muncă, fiind o condiţie obligatorie pentru angajare.
Art. 657. - (1) Asigurătorul acordă despăgubiri pentru
prejudiciile de care asiguraţii răspund, în baza legii, faţă de terţe persoane
care se constată că au fost supuse unui act de maipraxis medical, precum şi
pentru cheltuielile de judecată ale persoanei prejudiciate prin actul medical.
(2) Despăgubirile se acordă indiferent de locul în
care a fost acordată asistenţă medicală.
(3) Asigurarea obligatorie
face parte din categoria B clasa 13 de asigurări de răspundere civilă şi va
cuprinde toate tipurile de tratamente medicale ce se efectuează în
specialitatea şi competenţa profesională a asiguratului şi în gama de servicii
medicale oferite de unităţile de profil.
Art. 658. - (1) Despăgubirile se acordă pentru sumele
pe care asiguratul este obligat să le plătească cu titlu de dezdăunare şi
cheltuieli de judecată persoanei sau persoanelor păgubite prin aplicarea unei asistenţe
medicale neadecvate, care poate avea drept efect inclusiv vătămarea corporală
ori decesul.
(2) In caz de deces, despăgubirile se acordă
succesorilor în drepturi ai pacientului care au solicitat acestea.
(3) Despăgubirile se acordă şi atunci când asistenţa
medicală nu s-a acordat, deşi starea persoanei sau persoanelor care au
solicitat sau pentru care s-a solicitat asistenţa medicală impunea această
intervenţie.
(4) Despăgubirile vor include şi eventualele
cheltuieli ocazionate de un proces în care asiguratul este obligat la plata
acestora; cheltuielile de judecată sunt incluse în limita răspunderii stabilită
prin poliţa de asigurare.
Art. 659. - Despăgubirile se plătesc şi atunci când
persoanele vătămate sau decedate nu au domiciliul sau reşedinţa în România, cu
excepţia cetăţenilor din Statele Unite ale Americii, Canada şi Australia.
Art. 660. - (1) In cazul în care pentru acelaşi
asigurat există mai multe asigurări valabile, despăgubirea se suportă în mod
proporţional cu suma asigurată de fiecare asigurător.
(2) Asiguratul are obligaţia de
a informa asigurătorul despre încheierea unor astfel de asigurări cu alţi
asigurători, atât la încheierea poliţiei, cât şi pe parcursul executării
acesteia.
Art. 661. - (1) Limitele maxime ale despăgubirilor de
asigurare se stabilesc de către CNAS, după consultarea asociaţiilor
profesionale din domeniul asigurărilor si CMR, CFR, CMDR, OAMMR şi OBBC.
(2) Nivelul primelor, termenele de plată şi celelalte
elemente privind acest tip de asigurări se stabilesc prin negociere între
asiguraţi şi asigurători.
Art. 662. - (1) Despăgubirile se pot stabili pe cale
amiabilă, în cazurile în care rezultă cu certitudine răspunderea civilă a
asiguratului.
(2) In cazul în care părţile - asigurat, asigurător şi
persoana prejudiciată - cad de acord sau nu, este certă culpa asiguratului,
despăgubirile se vor plăti numai în baza hotărârii definitive a instanţei
judecătoreşti competente.
Art. 663. - Despăgubirile se plătesc de către
asigurător nemijlocit persoanelor fizice, în măsura în care acestea nu au fost
despăgubite de asigurat.
Art. 664. - Despăgubirile pot fi solicitate şi se
plătesc şi către persoanele care nu au plătit contribuţia datorată la sistemul
public de sănătate.
Art. 665. - (1) Drepturile persoanelor vătămate sau decedate
prin aplicarea unei asistenţe medicale neadecvate se pot exercita împotriva
celor implicaţi direct sau indirect în asistenţa medicală.
(2) Aceste drepturi se pot exercita şi împotriva
persoanelor juridice care furnizează echipamente, instrumental medical şi
medicamente care sunt folosite în limitele instrucţiunilor de folosire sau
prescripţiilor în asistenţă medicală calificată, conform obligaţiei acestora,
asumată prin contractele de furnizare a acestora.
Art. 666. - (1) Despăgubirile nu se recuperează de la
persoana răspunzătoare de producerea pagubei când asistenţa medicală s-a făcut
în interesul părţii vătămate sau a decedatului, în lipsa unei investigaţii
complete ori a necunoaşterii datelor anamnezice ale acestuia, datorită
situaţiei de urgenţă, iar partea vătămată sau decedatul nu a fost capabil,
datorită circumstanţelor, să coopereze când i s-a acordat asistenţă.
(2) Recuperarea prejudiciilor de la persoana
răspunzătoare de producerea pagubei se poate realiza în următoarele cazuri:
a) vătămarea sau decesul este urmare a încălcării
intenţionate a standardelor de asistenţă medicală;
b) vătămarea sau decesul se datorează unor vicii
ascunse ale echipamentului sau a instrumentarului medical sau a unor efecte
secundare necunoscute ale medicamentelor administrate;
c) atunci când vătămarea sau decesul se datorează atât
persoanei responsabile, cât şi unor deficienţe administrative de care se face
vinovată unitatea medicală în care s-a acordat asistenţă medicală sau ca urmare
a neacordării tratamentului adecvat stabilit prin standarde medicale
recunoscute sau alte acte normative în vigoare, persoana îndreptăţită poate să
recupereze sumele plătite drept despăgubiri de la cei vinovaţi, alţii decât
persoana responsabilă, proporţional cu partea de vină ce revine acestora;
d) asistenţa medicală a părţii vătămate sau a
decedatului s-a făcut fără consimţământul acestuia, dar în alte împrejurări
decât cele prevăzute la alin. (1).
Art. 667. - Asiguraţii sau reprezentanţii acestora sunt
obligaţi să înştiinţeze în scris asigurătorul sau, dacă este cazul,
asigurătorii despre existenţa unei acţiuni în despăgubire, în termen de 3 zile
lucrătoare de la data la care au luat la cunoştinţă despre această acţiune.
CAPITOLUL VI
Procedura de stabilire a cazurilor de răspundere
civilă profesională
pentru medici, farmacişti şi alte persoane din domeniul asistenţei medicale
Art. 668. - (1) La nivelul autorităţilor de sănătate
publică judeţene şi a municipiului Bucureşti se constituie Comisia de
monitorizare şi competenţă profesională pentru cazurile de malpraxis, numită în
continuare Comisia.
(2) Comisia are în componenţă reprezentanţi ai
autorităţilor de sănătate publică judeţene şi, respectiv, ai municipiului
Bucureşti, casei judeţene de asigurări de sănătate, colegiului judeţean al
medicilor, colegiului judeţean al medicilor dentişti, colegiului judeţean al
farmaciştilor, ordinului judeţean al asistenţilor şi moaşelor din România, un
expert medico-legal, sub conducerea unui director adjunct al autorităţii de sănătate publică judeţene, respectiv a
municipiului Bucureşti.
(3) Regulamentul de organizare şi funcţionare a
Comisiei se elaborează de Ministerul Sănătăţii Publice, se aprobă prin ordin al
ministrului sănătăţii publice şi se publică în Monitorul Oficial al României,
Partea I.
Art. 669. - (1) Ministerul Sănătăţii Publice aprobă, la
propunerea Colegiului Medicilor din România, pentru fiecare judeţ şi municipiul
Bucureşti, o listă naţională de experţi medicali, în fiecare specialitate, care
vor fi consultaţi conform regulamentului de organizare şi funcţionare a Comisiei.
(2) Pe lista de experţi se poate înscrie orice medic,
medic dentist, farmacist, asistent medical/moaşă cu o vechime de cel puţin 8
ani în specialitate, cu avizul Colegiului Medicilor din România, Colegiului
Medicilor Dentişti, Colegiului Farmaciştilor şi, respectiv, al Ordinului
Asistenţilor Medicali şi Moaşelor din România.
(3) Modalitatea de remunerare a experţilor medicali
din lista naţională se stabileşte prin ordin al ministrului sănătăţii publice.
(4) Onorariile pentru serviciile prestate de către experţii medicali, desemnaţi potrivit art. 671, se
stabilesc în raport cu complexitatea cazului expertizat, sunt aprobate prin
ordin al ministrului sănătăţii publice şi vor fi suportate de partea interesată.
Art. 670. - Comisia poate fi sesizată de:
a) persoana sau, după caz, reprezentantul legal al
acesteia, care se consideră victima unui act de malpraxis săvârşit în
exercitarea unei activităţi de prevenţie, diagnostic şi tratament;
b) succesorii persoanei decedate ca urmare a unui act
de malpraxis imputabil unei activităţi de prevenţie,
diagnostic şi tratament.
Art. 671. - (1) Comisia desemnează, prin tragere la
sorţi, din lista judeţeană a experţilor un grup de experţi sau un expert, în
funcţie de complexitatea cazului, însărcinat cu efectuarea
unui raport asupra cazului.
(2) Experţii prevăzuţi la alin. (1) au acces la toate
documentele medicale aferente cazului, a căror cercetare o consideră necesară,
şi au dreptul de a audia şi înregistra depoziţiile tuturor persoanelor
implicate.
(3) Experţii întocmesc în
termen de 30 de zile un raport asupra cazului pe care îl înaintează Comisiei.
Comisia adoptă o decizie asupra cazului, în maximum 3 luni de la data
sesizării.
(4) Fiecare parte interesată are dreptul să primească
o copie a raportului experţilor şi a documentelor medicale care au stat la baza
acestuia.
Art. 672. - Comisia stabileşte, prin decizie, dacă în
cauză a fost sau nu o situaţie de malpraxis. Decizia se comunică tuturor
persoanelor implicate, inclusiv asiguratorului, în termen de 5 zile calendaristice.
Art. 673. - (1) In cazul în care asiguratorul sau
oricare dintre părţile implicate nu este de acord cu decizia Comisiei, o poate
contesta la instanţa de judecată competentă, în termen de 15 zile de la data
comunicării deciziei.
(2) Procedura stabilirii cazurilor de malpraxis nu
împiedică liberul acces la justiţie potrivit dreptului comun.
Art. 674. - (1) Intreaga procedură de stabilire a
cazurilor de malpraxis, până în momentul sesizării instanţei, este
confidenţială.
(2) Incălcarea confidenţialităţii de către persoana
care a făcut sesizarea duce la pierderea dreptului de a beneficia de procedura
de conciliere.
(3) Incălcarea confidenţialităţii de către membrii
Comisiei sau experţii desemnaţi de aceasta atrage sancţiuni
profesionale şi administrative,
conform regulamentelor aprobate.
CAPITOLUL VII
Dispoziţii finale
Art. 675. - (1) Comisia întocmeşte un raport anual
detaliat pe care îl prezintă Ministerului Sănătăţii Publice.
(2) Pe baza datelor astfel obţinute, Ministerul
Sănătăţii Publice elaborează un raport anual naţional asupra malpraxisului
medical, pe care îl prezintă Parlamentului, Guvernului şi opiniei publice.
Art. 676. - Instanţa competentă să soluţioneze
litigiile prevăzute în prezenta lege este judecătoria în a cărei circumscripţie
teritorială a avut loc actul de malpraxis reclamat.
Art. 677. - Actele de malpraxis în cadrul activităţii
medicale de prevenţie, diagnostic şi tratament se prescriu în termen de 3 ani
de la producerea prejudiciului, cu excepţia faptelor ce reprezintă infracţiuni.
Art. 678. - (1) Omisiunea încheierii asigurării de
malpraxis medical sau asigurarea sub limita legală de către persoanele fizice
şi juridice prevăzute de prezenta lege constituie abatere disciplinară şi se
sancţionează cu suspendarea dreptului de practică sau, după caz, suspendarea
autorizaţiei de funcţionare.
(2) Această sancţiune nu se aplică dacă asiguratul se
conformează în termen de 30 de zile obligaţiei legale.
Art. 679. - Prevederile prezentului titlu nu se aplică
activităţii de cercetare biomedicală.
Art. 680. - In termen de 60 de zile de la intrarea în
vigoare a prezentului titlu, Ministerul Sănătăţii Publice şi Comisia de
Supraveghere a Asigurărilor vor elabora împreună, prin ordin comun sau separat,
după caz, normele metodologice de aplicare a acestuia.
Art. 681. - La data intrării în vigoare a prezentului
titlu orice dispoziţie contrară se abrogă.
TITLUL XVI
Infiinţarea, organizarea şi funcţionarea Şcolii Naţionale de Sănătate
Publică şi
Management Sanitar
Art. 682. - Se înfiinţează
Şcoala Naţională de Sănătate Publică şi Management Sanitar, denumită în
continuare SNSPMS, instituţie
publică, persoană juridică română cu sediul în municipiul Bucureşti, Str.
Vaselor nr. 31, sectorul 2, coordonată de Ministerul Sănătăţii Publice, prin
reorganizarea Institutului Naţional de Cercetare-Dezvoltare în Sănătate
Bucureşti, care se desfiinţează.
Art. 683. - (1) SNSPMS are următoarele obiecte de
activitate:
a) organizarea şi desfăşurarea de cursuri în domeniul
administraţiei şi managementului sanitar, pentru pregătirea şi perfecţionarea
personalului cu studii superioare, precum şi a celui cu studii medii şi
postliceale cu precădere din domeniul sanitar;
b) desfăşurarea de activităţi de cercetare-dezvoltare
în domeniul sănătăţii publice şi private şi al managementului în sănătate;
c) acordarea asistenţei tehnice în domeniul sănătăţii
publice şi private şi al managementului serviciilor de sănătate;
d) alte activităţi specifice din domeniul sănătăţii
publice şi managementului sanitar, precum promovarea sănătăţii, efectuarea de
studii şi aplicaţii pentru evaluarea şi eficientizarea performanţelor
sistemului de sănătate sau alte documentări, analize şi proiecte pentru sprijinirea procesului de
reformă în contextul integrării europene.
(2) SNSPMS va organiza şi va desfăşura cursuri de
atestat, cursuri de scurtă durată şi alte tipuri de cursuri specifice în
domeniul managementului sanitar, cu precădere pentru personalul ce lucrează în
domeniul sanitar, inclusiv în administraţia publică sanitară, având dreptul de
a elibera certificate de absolvire şi diplome, fiind responsabil naţional
pentru atestatele de pregătire complementară în managementul serviciilor de
sănătate, economie sanitară şi management financiar şi în managementul
cabinetului medical şi promovarea sănătăţii.
(3) SNSPMS va organiza şi va desfăşura cursuri
universitare de masterat, inclusiv în parteneriat cu instituţii de profil
naţionale şi internaţionale, cu respectarea prevederilor legale în vigoare.
(4) SNSPMS este instituţie
specializată care asigură formarea şi perfecţionarea funcţionarilor publici din
sistemul sanitar şi al asigurărilor de sănătate, conform obligaţiei prevăzute
în legislaţia aplicabilă funcţionarilor publici, fiind abilitată şi recunoscută
în acest sens.
(5) Certificatele şi diplomele eliberate de SNSPMS
sunt recunoscute de Ministerul Sănătăţii Publice şi Ministerul Educaţiei şi
Cercetării şi sunt opozabile terţilor.
(6) Eliberarea certificatelor şi diplomelor se va
realiza în baza unui ordin comun al ministrului sănătăţii publice şi al
ministrului educaţiei şi cercetării.
(7) Organizarea şi desfăşurarea programelor de
pregătire teoretică şi practică prevăzute la alin. (1) lit. a) şi alin. (2) şi
eliberarea certificatelor şi diplomelor se vor face cu
respectarea prevederilor legale în vigoare.
(8) Consiliul de administraţie al SNSPMS poate aproba
intrarea în consorţii universitare, potrivit legii.
Art. 684. - (1) Conducerea SNSPMS este asigurată de
Consiliul de administraţie, care are în componenţă şapte membri: doi
reprezentanţi ai Ministerului Sănătăţii Publice, doi reprezentanţi ai
Ministerului Educaţiei şi Cercetării, doi reprezentanţi ai Casei Naţionale de
Asigurări de Sănătate şi directorul general.
(2) Preşedintele Consiliului de administraţie este
ales prin vot secret de către membrii Consiliului de administraţie.
(3) Membrii Consiliului de administraţie al SNSPMS
sunt numiţi prin ordin comun al ministrului sănătăţii publice, ministrului
educaţiei şi cercetării şi al preşedintelui Casei Naţionale de Asigurări de
Sănătate pentru un mandat de trei ani; mandatul încetează prin revocarea celor
care i-au numit, expirare a mandatului, demisie, deces.
(4) Pentru activitatea desfăşurată în calitate de
membri ai Consiliului de administraţie, aceştia au dreptul la o indemnizaţie
lunară, stabilită de Consiliul de administraţie, care nu poate fi mai mare de
20% din salariul de bază al directorului general al SNSPMS.
(5) Directorul general este numit prin ordin comun al
ministrului sănătăţii publice, ministrului educaţiei şi cercetării şi al
preşedintelui Casei Naţionale de Asigurări de Sănătate pentru o perioadă de
trei ani, prin concurs organizat de Consiliul de administraţie, potrivit
condiţiilor stabilite în regulamentul de organizare şi funcţionare.
(6) Conducerea executivă a SNSPMS este asigurată de
directorul general, care este ordonator de credite şi membru în Consiliul de
administraţie.
(7) Salariul de bază al directorului general se stabileşte
prin ordin al ministrului sănătăţii publice, potrivit reglementărilor legale.
Art. 685. - In structura SNSPMS va funcţiona un
Consiliu ştiinţific şi pedagogic care coordonează activităţile de învăţământ si
cercetare-dezvoltare desfăşurate de SNSPMS. Preşedintele Consiliului ştiinţific şi pedagogic este unul
dintre reprezentanţii Ministerului Educaţiei şi Cercetării din Consiliul de
administraţie. Numărul membrilor şi condiţiile necesare pentru a face parte din
Consiliul ştiinţific şi pedagogic vor fi prevăzute în statutul aprobat de
Consiliul de administraţie, care va aproba şi componenţa nominală a Consiliului
ştiinţific şi pedagogic.
Art. 686. - Regulamentul de organizare şi funcţionare,
statutul, organigrama, statul de funcţii şi structura de personal ale SNSPMS
vor fi aprobate prin ordin comun al ministrului sănătăţii publice, ministrului
educaţiei şi cercetării şi al preşedintelui Casei Naţionale de Asigurări de
Sănătate, la propunerea Consiliului de administraţie al SNSPMS, în 60 de zile
de la data intrării în vigoare a prezentului titlu.
Art. 687. - SNSPMS are
următoarele principale structuri funcţionale:
a) Centrul de formare postuniversitară în domeniul
sănătăţii publice, administraţiei şi managementului serviciilor de sănătate;
b) Centrul de management al serviciilor de sănătate;
c) Centrul de cercetare şi
evaluare a serviciilor de sănătate;
d) Centrul naţional de promovare a sănătăţii;
e) Departamentul de sănătate publică şi management al
serviciilor de sănătate pentru persoane cu studii medii şi postliceale din
domeniul sănătăţii publice şi private.
Art. 688. - (1) SNSPMS are normate zece posturi de
personal didactic sau cu grad ştiinţific echivalent, pentru primii doi ani de
la intrarea în vigoare a prezentului titlu, iar ulterior, în funcţie de
necesităţi, numărul acestor posturi se va stabili cu aprobarea Ministerului
Educaţiei şi Cercetării. Posturile de personal didactic vor fi ocupate conform
legislaţiei în vigoare. Personalul Institutului Naţional de
Cercetare-Dezvoltare în Sănătate este preluat de SNSPMS cu toate drepturile
salariale avute la data intrării în vigoare a prezentului titlu.
(2) Pentru nevoile de formare interdisciplinare se va
putea recurge la resurse umane existente în cadrul instituţiilor universitare
şi organizaţiilor interne şi internaţionale cu activitate în domeniu.
(3) Salariile individuale ale personalului se
stabilesc prin negociere, conform contractului colectiv de muncă, în baza Legii
nr. 53/2003 - Codul muncii, cu modificările şi completările ulterioare, şi a
celorlalte prevederi legale în vigoare, în limita fondului total destinat
plăţii salariilor prevăzut în bugetul de venituri şi cheltuieli.
Art. 689. - Ministerul Sănătăţii Publice şi Ministerul
Educaţiei şi Cercetării împreună cu ministerele de profil vor lua măsurile
corespunzătoare pentru asigurarea sediilor şi a bazei materiale necesare
SNSPMS.
Art. 690. - (1) Patrimoniul Institutului Naţional de
Cercetare-Dezvoltare în Sănătate Bucureşti se transferă la SNSPMS şi se va
prelua pe bază de protocol de predare-preluare, pe baza datelor din bilanţul
contabil întocmit la 31 decembrie 2005, actualizat potrivit prevederilor
legale, în termen de 30 de zile de la data intrării în vigoare a prezentului
titlu.
(2) Imobilul compus din construcţiile, anexele şi
terenul aferent, situate în municipiul Bucureşti, Str. Vaselor nr. 31, sectorul
2, în care a funcţionat Institutul Naţional de Cercetare-Dezvoltare în Sănătate
Bucureşti, trec în administrarea SNSPMS.
(3) Activul şi pasivul Institutului Naţional de Cercetare-Dezvoltare
în Sănătate Bucureşti se preiau pe bază de protocol de predare-preluare de
către SNSPMS, în termen de 30 de zile de la data intrării în vigoare a
prezentului titlu.
(4) SNSPMS preia toate drepturile şi este ţinută de
toate obligaţiile Institutului Naţional de Cercetare-Dezvoltare în Sănătate
Bucureşti, potrivit reglementărilor legale şi contractuale.
Art. 691. - (1) Infiinţarea SNSPMS ca instituţie de
învăţământ superior organizatoare de studii universitare de masterat se va face
cu respectarea prevederilor legale în vigoare, inclusiv cu parcurgerea etapei
de evaluare academică şi de acreditare.
(2) SNSPMS este autorizată provizoriu pe o perioadă de
5 ani, perioadă în care se vor face demersurile necesare acreditării, conform
normelor Consiliului Naţional de Evaluare Academică şi Acreditare.
Art. 692. - (1) Finanţarea SNSPMS se realizează din
venituri proprii, precum şi din donaţii, sponsorizări şi din alte surse, în
condiţiile legii.
(2) SNSPMS poate desfăşura activităţi aferente
programelor naţionale de sănătate, finanţate de la bugetul Ministerului
Sănătăţii Publice, şi activităţi de analiză, evaluare şi monitorizare a
serviciilor de sănătate decontate din Fondul naţional unic de asigurări sociale
de sănătate.
(3) Activităţile prevăzute la alin. (2) se realizează
prin negociere directă, pe bază de contracte încheiate cu Ministerul Sănătăţii
Publice şi, respectiv, cu Casa Naţională de Asigurări de Sănătate.
Art. 693. - Pe data intrării în vigoare a prezentului
titlu se abrogă Hotărârea Guvernului nr. 1.329/2002 privind înfiinţarea,
organizarea şi funcţionarea Institutului Naţional de Cercetare-Dezvoltare în
Sănătate Bucureşti, publicată în Monitorul Oficial al României, Partea I, nr. 876 din 4 decembrie 2002.
Art. 694. - Orice alte dispoziţii contrare prezentului
titlu se abrogă.
TITLUL XVII
Medicamentul
CAPITOLUL I
Delimitări conceptuale
Art. 695. - In înţelesul prezentului titlu, termenii şi
noţiunile folosite au următoarele semnificaţii:
1. medicament:
a) orice substanţă sau combinaţie de substanţe
prezentată ca având proprietăţi pentru tratarea sau prevenirea bolilor la om;
sau
b) orice substanţă sau combinaţie de substanţe care
poate fi folosită sau administrată la om, fie pentru restabilirea, corectarea
sau modificarea funcţiilor fiziologice prin exercitarea unei acţiuni farmacologice, imunologice sau metabolice, fie pentru stabilirea
unui diagnostic medical;
2. substanţă - orice materie, indiferent de origine, care poate fi:
- umană, precum: sânge uman şi produse derivate din
sângele uman;
- animală, precum: microorganisme, animale întregi,
părţi de organe, secreţii animale, toxine, extracte, produse derivate din
sânge;
- vegetală, precum: microorganisme, plante, părţi de
plante, secreţii vegetale, extracte;
- chimică, precum: elemente, substanţe chimice
naturale şi produşi chimici obţinuţi prin transformare chimică sau sinteză;
3. medicament imunologic - orice medicament care constă în vaccinuri, toxine, seruri sau
produse alergene:
a) vaccinurile, toxinele sau serurile se referă în
special la:
(i) agenţi folosiţi pentru producerea imunităţii
active, precum vaccinul holeric, BCG, vaccinul poliomielitic, vaccinul
variolic;
(ii) agenţi folosiţi pentru diagnosticarea stării de
imunitate, incluzând în special tuberculina şi tuberculina PPD, toxine folosite
pentru testele Schick şi Dick, brucelina;
(iii) agenţi folosiţi pentru producerea imunităţii
pasive, precum antitoxina difterică, globulina antivariolică, globulina
antilimfocitică;
b) produsele alergene sunt medicamentele destinate
identificării sau inducerii unei modificări specifice şi dobândite a
răspunsului imun la un agent alergizant;
4. medicament homeopat - orice medicament obţinut din substanţe numite suşe homeopate în acord
cu un procedeu de fabricaţie homeopat descris de Farmacopeea Europeană sau, în
abstanţa acesteia, de farmacopeele utilizate în prezent în România şi în
statele membre ale Uniuniii Europene; un medicament homeopat poate conţine mai
multe principii active;
5. medicament radiofarmaceutic - orice
medicament care, atunci când este gata de folosire,
conţine încorporaţi, în scopuri medicale, unul sau mai mulţi radionuclizi
(izotopi radioactivi);
6. generator de radionuclizi - orice sistem care încorporează un radionuclid-părinte fixat, care
serveşte la producerea unui radionuclid-fiică obţinut prin eluţie sau prin
orice altă metodă şi care este folosit într-un medicament radiofarmaceutic;
7. kit (trusă) - orice preparat care urmează să fie reconstituit sau combinat cu
radionuclizi în medicamentul radiofarmaceutic final, în mod obişnuit înaintea
administrării lui;
8. precursor radionuclidic - orice alt radionuclid produs pentru radiomarcarea altei substanţe
înaintea administrării;
9. medicament derivat din sânge uman sau plasmă umană
- medicament pe bază de constituenţi din sânge, preparaţi industrial de unităţi
publice sau private; asemenea medicamente includ în special albumină, factori
de coagulare şi imunoglobuline de origine umană;
10. reacţie adversă - un
răspuns nociv şi nedorit, care apare la utilizarea unui medicament în doze,
întrebuinţat în mod normal la om pentru profilaxia, diagnosticarea sau
tratamentul bolii ori pentru restabilirea, corectarea sau modificarea unor
funcţii fiziologice;
11. reacţie adversă gravă - o reacţie adversă care cauzează moartea, pune în pericol viaţa,
necesită spitalizarea sau prelungirea spitalizării, provoacă un handicap ori o
incapacitate durabilă sau importantă ori provoacă anomalii/malformaţii
congenitale;
12. reacţie adversă neaşteptată - o reacţie adversă a cărei natură, severitate sau evoluţie nu
corespunde informaţiilor din rezumatul caracteristicilor produsului;
13. rapoarte periodice actualizate referitoare la
siguranţă (RPAS) - rapoartele periodice conţinând
informaţiile înregistrate conform art. 816;
14. studiu de siguranţă
postautorizare - un
studiu farmaco-epidemiologic sau un studiu clinic realizat în concordanţă cu
prevederile autorizaţiei de punere pe piaţă, desfăşurat în scopul identificării
sau cuantificării unui risc din punctul de vedere al siguranţei pentru un
medicament autorizat;
15. abuz de medicamente - utilizarea intenţionată excesivă, permanentă sau sporadică, a
medicamentelor, care este însoţită de efecte nocive la nivel fizic sau psihic;
16. distribuţie angro a
medicamentelor - totalitatea activităţilor de
procurare, deţinere, livrare sau export de medicamente, cu excepţia activităţii
de eliberare a acestora către public; asemenea activităţi sunt efectuate de
fabricanţi ori depozitele
lor, importatori şi alţi distribuitori angro sau de farmacişti ori alte
persoane autorizate să furnizeze medicamente către public în România;
17. obligaţie de serviciu
public - obligaţia distribuitorilor angro de a
asigura permanent o gamă adecvată de medicamente care să răspundă necesităţilor
unui spaţiu geografic determinat şi de a livra pe întreg spaţiul respectiv
cantităţile solicitate în cel mai scurt termen de la primirea comenzii;
18. reprezentant al
deţinătorului autorizaţiei de punere pe piaţă - persoana
cunoscută în mod obişnuit sub denumirea de reprezentant
local, desemnată de către
deţinătorul autorizaţiei de punere pe piaţă să îl reprezinte în România;
19. prescripţie medicală
- orice prescripţie de medicamente emisă de o
persoană calificată în acest sens;
20. denumirea medicamentului - denumirea atribuită unui medicament, ce poate să fie o denumire
inventată care să nu conducă la confuzii cu denumirea comună ori cu o denumire
comună sau ştiinţifică, însoţită de marca ori numele deţinătorului autorizaţiei
de punere pe piaţă;
21. denumire comună - denumirea comună internaţională recomandată de către Organizaţia
Mondială a Sănătăţii (OMS) sau, dacă o astfel de denumire nu există, denumirea
comună uzuală;
22. concentraţia
medicamentului - conţinutul în substanţe active,
exprimat în cantitate pe unitatea dozată, pe unitatea de volum sau de greutate,
în funcţie de forma farmaceutică;
23. ambalaj primar - recipientul
sau orice altă formă de ambalaj aflată în contact direct cu medicamentul;
24. ambalaj secundar - ambalajul în care este
introdus ambalajul primar;
25. etichetare - informaţiile
de pe ambalajul primar sau secundar;
26. prospect - document
cuprinzând informaţiile pentru utilizator, care însoţeşte medicamentul;
27. autoritate competentă
- Agenţia Naţională a Medicamentului (ANM),
înfiinţată prin Ordonanţa Guvernului nr. 125/1998 privind înfiinţarea,
organizarea şi funcţionarea Agenţiei Naţionale a Medicamentului, aprobată cu
modificări şi completări prin Legea nr. 594/2002, cu modificările şi
completările ulterioare;
28. riscuri legate de utilizarea medicamentului:
- orice risc pentru
sănătatea pacientului sau pentru sănătatea publică, legat de calitatea,
siguranţa ori eficacitatea medicamentului;
- orice risc de efecte indezirabile asupra mediului;
29. raport risc-beneficiu - o evaluare a
efectelor terapeutice pozitive ale medicamentului,
comparativ cu riscurile definite la pct. 28 prima liniuţă;
30. medicament din plante
medicinale cu utilizare tradiţională - orice
medicament din plante care îndeplineşte condiţiile prevăzute la art. 714 alin
(1);
31. medicament din plante - orice medicament conţinând ca substanţe active exclusiv una sau mai
multe substanţe vegetale sau preparate din plante ori o combinaţie între una
sau mai multe astfel de substanţe vegetale ori preparate din plante;
32. substanţe
vegetale - plante, părţi din plante, alge, fungi,
licheni întregi, fragmentaţi sau tăiaţi, într-o formă neprocesată, de obicei
uscaţi, dar uneori proaspeţi; anumite exudate ce nu au fost supuse unui
tratament specific sunt, de asemenea, considerate a fi substanţe vegetale;
substanţele vegetale sunt definite precis prin partea din plantă care este
utilizată şi prin denumirea botanică în sistemul binominal (gen, specie,
varietate şi autor);
33. preparate din plante - preparate obţinute prin supunerea substanţelor din plante la
tratamente precum extracţia, distilarea, presarea, fracţionarea, purificarea,
concentrarea sau fermentarea; acestea includ substanţe din plante concasate sau
pulverizate, tincturi, extracte, uleiuri esenţiale, sucuri obţinute prin presare sau exudate procesate;
34. procedură centralizată
- procedura de autorizare de punere pe piaţă
prevăzută în Regulamentul Consiliului şi Parlamentului European nr. 726/2004,
care stabileşte procedurile comunitare pentru autorizarea şi supravegherea
medicamentelor de uz uman şi veterinar şi care constituie Agenţia Europeană a
Medicamentelor;
35. ţări terţe - alte ţări decât România şi statele membre ale Uniunii Europene.
CAPITOLUL II
Domeniu de aplicare
Art. 696. - (1) Prevederile prezentului titlu se aplică medicamentelor de uz uman, destinate punerii pe piaţă
în România, fabricate industrial sau produse printr-o metodă implicând un
proces industrial.
(2) In cazul în care, luând în considerare toate
caracteristicile unui produs, acesta poate fi încadrat
atât în definiţia de „medicament", cât şi în definiţia unui produs
reglementat de altă lege naţională, se aplică prevederile prezentului titlu.
(3) Fără a aduce atingere prevederilor alin. (1) şi
ale art. 697 lit. d), cap. IV al prezentului titlu se aplică medicamentelor destinate exclusiv exportului şi
produselor intermediare.
Art. 697. - Prevederile prezentului titlu nu se
aplică:
a) medicamentelor preparate în farmacie conform unei
prescripţii medicale pentru un anumit pacient (numite formule magistrale);
b) medicamentelor preparate în farmacie conform
indicaţiilor unei farmacopei şi destinate eliberării directe către pacienţii
farmaciei respective (numite formule oficinale);
c) medicamentelor destinate studiilor de cercetare şi
dezvoltare, dar fără a aduce atingere prevederilor legale referitoare la
implementarea bunei practici în desfăşurarea studiilor clinice efectuate cu
medicamente de uz uman;
d) produselor intermediare destinate a fi procesate
de către un fabricant autorizat;
e) radionuclizilor utilizaţi sub formă de surse
închise;
f) sângelui total, plasmei sau celulelor sangvine de
origine umană, exceptând plasma preparată printr-o metodă care presupune un
proces industrial.
Art. 698. - (1) Prezentul titlu nu derogă de la
prevederile legislaţiei naţionale compatibilizate cu normele comunitare
referitoare la protecţia radiologică a persoanelor supuse examinărilor sau
tratamentelor medicale ori la regulile de siguranţă pentru protecţia sănătăţii
populaţiei şi a lucrătorilor împotriva pericolelor datorate radiaţiilor
ionizante.
(2) Prezentul titlu nu aduce atingere legislaţiei
naţionale compatibilizate cu normele comunitare referitoare la schimbul de
substanţe terapeutice de origine umană.
(3) Prezentul titlu nu aduce atingere competenţelor Ministerului Sănătăţii Publice privind
stabilirea preţurilor medicamentelor sau includerea medicamentelor în domeniul
de aplicare a schemelor naţionale de asigurări de sănătate, pe baza condiţiilor
de sănătate, economice şi sociale.
Art. 699. - (1) Pentru
rezolvarea unor nevoi speciale se pot exclude de la aplicarea prevederilor
prezentului titlu medicamentele furnizate pentru a răspunde comenzilor
nesolicitate, dar făcute cu bună-credinţă, conform specificaţiilor unei persoane calificate autorizate, şi destinate
pacienţilor aflaţi sub responsabilitatea sa directă. Condiţiile de excludere se
stabilesc prin ordin al ministrului sănătăţii publice.
(2) Ministerul Sănătăţii Publice autorizează temporar
distribuţia unui medicament neautorizat în situaţia unei suspiciuni de epidemie
sau în cazul unei epidemii confirmate cu agenţi patogeni, toxine, precum şi în
cazul unei suspiciuni de răspândire ori răspândire confirmată de agenţi chimici
sau radiaţii nucleare care ar putea pune în pericol sănătatea populaţiei ori în
alte cazuri de necesitate neacoperite de medicamentele autorizate.
(3) Răspunderea civilă şi administrativă a
deţinătorilor autorizaţiilor de punere pe piaţă, fabricanţilor şi persoanelor
calificate din sănătate, cu respectarea prevederilor alin. (1), nu este
angajată pentru consecinţele rezultând din:
a) utilizarea unui medicament altfel decât pentru
indicaţiile autorizate;
b) utilizarea unui medicament neautorizat, în cazul
în care o asemenea utilizare este recomandată sau solicitată de o autoritate
naţională competentă ca răspuns la o suspiciune de răspândire sau la o
răspândire confirmată a agenţilor patogeni, toxinelor, agenţilor chimici sau
radiaţiilor nucleare, susceptibilă să producă daune.
(4) Prevederile alin. (3) se
aplică indiferent dacă a fost sau nu eliberată o autorizaţie naţională ori
comunitară de punere pe piaţă şi nu aduc atingere dispoziţiilor Legii nr. 240/2004
privind răspunderea producătorilor pentru pagubele generate de produsele cu
defecte.
CAPITOLUL III
Punerea pe piaţă
SECŢIUNEA 1
Autorizarea de punere pe piaţă
Art. 700. - (1) Nici un medicament nu poate fi pus pe
piaţă în România fără o autorizaţie de punere pe piaţă emisă de către Agenţia
Naţională a Medicamentului, în conformitate cu prevederile prezentului titlu,
sau fără o autorizaţie eliberată conform procedurii centralizate.
(2) Nici un medicament nu poate fi pus pe piaţă în
România fără o autorizaţie de punere pe piaţă emisă de către Agenţia Naţională
a Medicamentului, în conformitate cu prevederile
prezentului titlu.
(3) După ce un medicament a primit o autorizaţie
iniţială de punere pe piaţă, conform alin. (1), respectiv alin. (2), orice
concentraţii, forme farmaceutice, căi de administrare şi forme de prezentare
suplimentare, precum şi orice variaţii sau extensii trebuie autorizate separat
conform alin. (1), respectiv alin. (2), sau incluse în autorizaţia iniţială de
punere pe piaţă; toate aceste autorizaţii de punere pe piaţă sunt considerate
ca aparţinând aceleiaşi autorizaţii globale, mai ales în scopul aplicării
prevederilor art. 704 alin. (1) şi ale art. 852.
(4) Deţinătorul autorizaţiei de punere pe piaţă este
responsabil de punerea pe piaţă a medicamentului; desemnarea unui reprezentant
nu exonerează deţinătorul autorizaţiei de punere pe piaţă de răspundere
juridică.
(5) Autorizaţia prevăzută la alin. (1), respectiv
alin. (2), este necesară şi pentru generatorii de radionuclizi, kiturile
(truse), precursorii radionuclidici şi medicamentele radiofarmaceutice
fabricate industrial.
Art. 701. - Autorizaţia de punere pe piaţă nu este
necesară pentru medicamentele radiofarmaceutice preparate la momentul
utilizării de către o persoană sau instituţie care, conform legislaţiei
naţionale, este autorizată să utilizeze aceste medicamente potrivit
instrucţiunilor fabricantului,
într-un centru sanitar acreditat şi pornind exclusiv de la generatori de
radionuclizi, kituri (truse) sau precursori radionuclidici autorizaţi.
Art. 702. - (1) In vederea obţinerii unei autorizaţii
de punere pe piaţă pentru un medicament trebuie depusă o cerere la Agenţia
Naţională a Medicamentului.
(2) Sunt exceptate de la prevederile alin. (1)
medicamentele care trebuie să fie autorizate de Agenţia Europeană a
Medicamentelor prin procedura centralizată.
(3) O autorizaţie de punere
pe piaţă nu poate fi eliberată decât unui solicitant stabilit în România sau
într-un stat membru al Uniunii Europene.
(4) Cererea de autorizare de punere pe piaţă trebuie
să fie însoţită de următoarele informaţii şi documente, care trebuie să fie
transmise în conformitate cu normele şi protocoalele analitice,
farmacotoxicologice şi clinice referitoare la testarea medicamentelor, aprobate
prin ordin al ministrului sănătăţii publice:
a) numele sau denumirea şi domiciliul sau sediul
social ale solicitantului şi, unde este cazul, ale fabricantului;
b) denumirea medicamentului;
c) caracteristicile calitative şi cantitative ale tuturor
constituenţilor medicamentului, inclusiv denumirea comună internaţională (DCI)
recomandată de Organizaţia Mondială a Sănătăţii, dacă există o asemenea
denumire sau o referire la denumirea chimică relevantă;
d) evaluarea riscurilor pe care medicamentul le-ar
putea prezenta pentru mediu; acest impact este evaluat şi, de la caz la caz, se
iau măsuri specifice pentru limitarea sa;
e) descrierea metodei de fabricaţie;
f) indicaţiile terapeutice, contraindicaţiile şi
reacţiile adverse;
g) posologia, forma farmaceutică, modul şi calea de
administrare, precum şi perioada de valabilitate prezumată;
h) explicaţiile privind
măsurile de precauţie şi siguranţă care trebuie luate pentru depozitarea
medicamentului, administrarea sa la pacienţi şi eliminarea reziduurilor, precum
şi indicarea riscurilor potenţiale pe care medicamentul le prezintă pentru
mediu;
i) descrierea metodelor de control utilizate de
fabricant;
j) rezultatele:
- testelor farmaceutice (fizico-chimice, biologice sau
microbiologice);
- testelor preclinice (toxicologice şi farmacologice);
- studiilor clinice;
k) descrierea detaliată a sistemului de
farmacovigilenţă şi, acolo unde este cazul, a sistemului de management al
riscurilor pe care solicitantul îl va pune în aplicare;
l) o declaraţie privind faptul
că studiile clinice derulate în afara României şi Uniunii Europene îndeplinesc
criteriile etice din Normele referitoare la implementarea regulilor de bună
practică în desfăşurarea studiilor clinice efectuate cu medicamente de uz uman
aprobate prin ordin al ministrului sănătăţii publice;
m) un rezumat al caracteristicilor produsului, conform art. 708, o machetă a ambalajului secundar, conţinând detaliile
prevăzute la art. 763, şi ale ambalajului primar al medicamentului, conţinând
detaliile prevăzute la art. 764, precum şi prospectul, conform art. 769;
n) un document care să ateste faptul că fabricantul
este autorizat să producă medicamente în ţara sa;
o) - câte o copie de pe fiecare autorizaţie de punere
pe piaţă a medicamentului obţinută într-un alt stat, însoţită de lista statelor
membre ale Uniunii Europene în care cererea de autorizare depusă în
conformitate cu Directiva 2001/83/CE instituind codul comunitar al
medicamentelor de uz uman, publicată în Jurnalul Oficial al Comunităţilor
Europene (JOCE) nr. L311 din 28 noiembrie 2001,cu modificările şi completările ulterioare, este în curs de examinare;
- o copie de pe rezumatul caracteristicilor
produsului, propus de către solicitant, potrivit art. 708, sau aprobat de autoritatea
competentă a statului membru al Uniunii Europene în acord cu art. 21 din
Directiva 2001/83/CE;
- o copie a prospectului
propus conform art. 769 sau aprobat de autoritatea competentă a statului membru
al Uniunii Europene conform art. 61 din Directiva 2001/83/CE;
- detalii ale oricărei decizii de refuz al
autorizării pronunţate într-un alt stat, precum şi motivele acestei decizii.
Această informaţie trebuie actualizată periodic;
p) o copie a oricărei desemnări a medicamentului ca
medicament orfan în conformitate cu Regulamentul nr. 141/2000/CE privind
medicamentele orfane, publicat în Jurnalul Oficial al Comunităţilor Europene
(JOCE) nr. L 018 din 22 ianuarie 2000, însoţită de o copie a opiniei relevante
a Agenţiei Europene a Medicamentelor;
q) dovada că solicitantul beneficiază de serviciile
unei persoane calificate, responsabilă cu activitatea de famacovigilenţă, şi că
dispune de mijloacele necesare pentru notificarea oricărei reacţii adverse
suspectate a apărea în România sau într-un alt stat.
(5) Documentele şi informaţiile privind rezultatele
testelor farmaceutice şi preclinice şi ale studiilor clinice prevăzute la alin.
(4) lit. j) sunt însoţite de rezumate conform prevederilor art. 709.
Art. 703. - O cererea de autorizare de punere pe piaţă
pentru un generator de radionuclizi trebuie să conţină, pe lângă elementele
prevăzute la art. 702 şi la art. 704 alin. (1), următoarele informaţii şi
documente;
a) o descriere generală a sistemului, precum şi o
descriere detaliată a componentelor sistemului, care pot afecta compoziţia sau
calitatea preparării radionuclidului-fiică;
b) caracteristicile calitative şi cantitative ale eluatului sau ale sublimatului.
Art. 704. - (1) Prin derogare de la prevederile art.
702 alin. (4) lit. j) şi fără a aduce atingere legislaţiei privind protecţia
proprietăţii industriale şi comerciale, solicitantul nu trebuie să furnizeze
rezultatele testelor preclinice şi ale studiilor clinice, dacă poate demonstra
că medicamentul este un generic al unui medicament de referinţă care este sau a
fost autorizat de cel puţin 8 ani în România, într-un stat membru al Uniunii
Europene sau în Uniunea Europeană prin procedura centralizată.
Un medicament generic autorizat potrivit prezentei
prevederi nu va fi comercializat înainte de trecerea a 10 ani de la autorizarea
iniţială a medicamentului de referinţă.
Prima teză se aplică şi în cazul în care medicamentul
de referinţă nu a fost autorizat în România, iar cererea pentru medicamentul
generic a fost depusă în această ţară. In acest caz, solicitantul trebuie să
indice în documentaţia depusă numele statului membru al Uniunii Europene în
care medicamentul de referinţă este sau a fost autorizat. Agenţia Naţională a
Medicamentului solicită autorităţii competente din statul membru al Uniunii Europene
indicat de solicitant confirmarea faptului că medicamentul de referinţă este
sau a fost autorizat, compoziţia completă a medicamentului de referinţă şi,
dacă este cazul, altă documentaţie relevantă. La solicitări de acest tip ale
autorităţilor competente din statele membre ale Uniunii Europene, Agenţia
Naţională a Medicamentului răspunde în cel mult o lună.
Perioada de 10 ani la care se
face referire în teza a doua poate fi prelungită cu maximum un an dacă, în
timpul primilor 8 ani din acei 10 ani, deţinătorul autorizaţiei de punere pe piaţă obţine o autorizaţie
pentru una sau mai multe indicaţii terapeutice noi care, potrivit evaluării
ştiinţifice realizate în vederea autorizării, se consideră că aduc un beneficiu
clinic semnificativ în comparaţie cu terapiile existente.
(2) In înţelesul prezentului articol, termenii şi
noţiunile folosite au următoarele semnificaţii:
a) medicament de referinţă
- un medicament autorizat în conformitate cu art.
700 şi 702 ale prezentului titlu sau un medicament autorizat în unul dintre
statele membre ale Uniunii Europene sau în Uniunea Europeană prin procedura
centralizată;
b) medicament generic - un medicament care are aceeaşi compoziţie calitativă şi cantitativă
în ceea ce priveşte substanţele active şi aceeaşi formă farmaceutică ca
medicamentul de referinţă şi a cărui bioechivalenţă cu medicamentul de
referinţă a fost demonstrată prin studii de biodisponibilitate corespunzătoare.
Diferitele săruri, esteri, eteri, izomeri, amestecuri de izomeri, complecşi sau
derivaţi, ai unei substanţe active sunt consideraţi aceeaşi substanţă activă,
dacă nu prezintă proprietăţi semnificativ diferite în ceea ce priveşte
siguranţa şi/sau eficacitatea. In acest caz, solicitantul trebuie să furnizeze
informaţii suplimentare care să dovedească siguranţa şi/sau eficacitatea
diferitelor săruri, esteri sau derivaţi ai unei substanţe active autorizate.
Diferitele forme farmaceutice orale cu eliberare imediată sunt considerate a fi
aceeaşi formă farmaceutică. Solicitantul nu trebuie să furnizeze studii de
biodisponibilitate, dacă el poate demonstra că medicamentul generic
îndeplineşte criteriile relevante aşa cum sunt ele definite în ghidurile
detaliate corespunzătoare.
(3) Dacă medicamentul nu se încadrează în definiţia
unui medicament generic conform alin. (2) lit. b) sau dacă bioechivalenţă nu
poate fi demonstrată prin studii de biodisponibilitate ori în cazul
schimbărilor în substanţa/substanţele activă/active, indicaţiile terapeutice,
concentraţia, forma farmaceutică sau calea de administrare, faţă de
medicamentul de referinţă, este necesară furnizarea rezultatelor testelor
preclinice şi a studiilor clinice corespunzătoare.
(4) Când un medicament biologic, similar cu un
medicament biologic de referinţă, nu îndeplineşte condiţiile pentru a se
încadra în definiţia medicamentelor generice, datorită în special diferenţelor
legate de materiile prime sau diferenţelor dintre procesul de fabricaţie al
medicamentului biologic şi al medicamentului biologic de referinţă, trebuie
furnizate rezultatele testelor preclinice şi ale studiilor clinice
corespunzătoare în legătură cu aceste condiţii. Tipul şi cantitatea datelor
suplimentare de furnizat trebuie să respecte criteriile relevante prevăzute în
Normele şi protocoalele analitice, farmacotoxicologice şi clinice referitoare
la testarea medicamentelor, aprobate prin ordin al ministrului sănătăţii
publice, precum şi în ghidurile detaliate referitoare la acestea. Nu trebuie
furnizate rezultatele altor teste şi studii din dosarul medicamentului de
referinţă.
(5) In cazul în care se depune o cerere pentru o nouă
indicaţie a unei substanţe cu utilizare bine stabilită, suplimentar faţă de
prevederile alin. (1), se acordă o perioadă de exclusivitate a datelor
noncumulativă de un an, dacă au fost efectuate teste preclinice şi studii
clinice semnificative referitoare la noua indicaţie.
(6) Desfăşurarea testelor şi studiilor necesare în
scopul aplicării prevederilor alin. (1), (2), (3) şi (4) şi cerinţele practice
care rezultă nu sunt considerate ca fiind contrarii drepturilor privind
brevetele şi certificatele de protecţie suplimentară pentru medicamente.
Art. 705. - Prin derogare de la
prevederile art. 702 alin. (4) lit. j) şi fără a aduce atingere legislaţiei
privind protecţia proprietăţii industriale şi comerciale, solicitantul nu
trebuie să furnizeze rezultatele testelor preclinice şi studiilor clinice dacă
poate demonstra că substanţele active ale medicamentului au utilizare medicală
bine stabilită în Uniunea Europeană de cel puţin 10 ani, au o eficacitate recunoscută
şi un nivel de siguranţă acceptabil în condiţiile stabilite în Normele şi
protocoalele analitice, farmacotoxicologice şi clinice referitoare la testarea
medicamentelor, aprobate prin ordin al ministrului sănătăţii publice; în acest
caz, rezultatele testelor şi studiilor vor fi înlocuite de literatura
ştiinţifică corespunzătoare.
Art. 706. - In cazul medicamentelor ce conţin substanţe active care intră în compoziţia unor
medicamente autorizate, dar care nu au fost încă utilizate într-o combinaţie în
scop terapeutic, trebuie furnizate rezultatele unor noi teste preclinice şi
studii clinice în legătură cu acea combinaţie, conform prevederilor art. 702
alin. (4) lit. j), dar nu este necesară furnizarea referinţelor ştiinţifice
privind fiecare substanţă activă.
Art. 707. - După eliberarea autorizaţiei de punere pe
piaţă, deţinătorul autorizaţiei poate permite utilizarea documentaţiei
farmaceutice, preclinice şi clinice din dosarul medicamentului, în vederea
examinării solicitărilor ulterioare în legătură cu alte medicamente având
aceeaşi compoziţie calitativă şi cantitativă de substanţe active şi aceeaşi
formă farmaceutică.
Art. 708. - Rezumatul caracteristicilor produsului
conţine, în ordinea indicată mai jos, următoarele informaţii:
1. denumirea medicamentului urmată de concentraţie şi
de forma farmaceutică;
2. compoziţia calitativă şi cantitativă în ceea ce
priveşte substanţele active şi acei excipienţi a căror cunoaştere este necesară
pentru corecta administrare a medicamentului; se folosesc denumirile comune
uzuale sau denumirile chimice;
3. forma farmaceutică;
4. date clinice:
4.1. indicaţii terapeutice;
4.2. doze şi mod de
administrare pentru adulţi şi, dacă este cazul, pentru copii;
4.3. contraindicaţii;
4.4. atenţionări şi precauţii speciale pentru
utilizare şi, în cazul medicamentelor imunologice, orice precauţii speciale ce
trebuie luate de persoanele care manipulează astfel de produse şi le
administrează pacienţilor, împreună cu precauţiile care trebuie luate de
pacient;
4.5. interacţiuni cu alte medicamente şi alte forme de
interacţiune;
4.6. utilizare în timpul sarcinii şi alăptării;
4.7. efecte asupra capacităţii
de a conduce vehicule şi de a folosi utilaje;
4.8. reacţii adverse;
4.9. supradozaj (simptome, proceduri de urgenţă, antidoturi);
5. proprietăţi farmacologice:
5.1. proprietăţi farmacodinamice;
5.2. proprietăţi farmacocinetice;
5.3. date preclinice de
siguranţă;
6. informaţii farmaceutice:
6.1. lista excipienţilor;
6.2. incompatibilităţi majore;
6.3. perioada de valabilitate, inclusiv după
reconstituirea medicamentului sau după ce ambalajul primar a fost deschis
pentru prima dată, unde este cazul;
6.4. precauţii speciale pentru păstrare;
6.5. natura şi conţinutul ambalajului;
6.6. precauţii speciale privind eliminarea
medicamentelor nefolosite sau a reziduurilor rezultate din aceste medicamente,
dacă este cazul;
7. deţinătorul autorizaţiei de punere pe piaţă;
8. numărul (numerele) autorizaţiei de punere pe
piaţă;
9. data primei autorizări sau a reînnoirii
autorizaţiei;
10. data revizuirii textului;
11. pentru medicamentele radiofarmaceutice, detaliile
complete privind dozimetria radiaţiilor interne;
12. pentru medicamentele radiofarmaceutice,
instrucţiuni suplimentare detaliate pentru prepararea extemporanee şi controlul
calităţii unui astfel de preparat şi, unde este cazul, durata maximă de
păstrare în timpul căreia orice preparat intermediar, cum ar fi o eluţie sau
medicamentul gata de utilizare, corespunde specificaţiilor; în cazul autorizărilor
conform prevederilor art. 704, acele părţi ale rezumatului caracteristicilor
medicamentului de referinţă referitoare la indicaţii sau forme farmaceutice
încă protejate de brevet la momentul în care un medicament generic este pus pe
piaţă nu trebuie incluse.
Art. 709. - (1) Inaintea depunerii la Agenţia Naţională
a Medicamentului a rezumatelor detaliate prevăzute la art. 702 alin. (5),
solicitantul trebuie să se asigure că acestea au fost elaborate şi semnate de
experţi cu calificările tehnice şi profesionale necesare, care trebuie să fie
prezentate într-un scurt curriculum vitae.
(2) Persoanele având calificările tehnice şi
profesionale prevăzute la alin. (1) trebuie să justifice orice utilizare a
literaturii ştiinţifice prevăzute la art. 705 în conformitate cu condiţiile
stabilite în Normele şi protocoalele analitice, farmacotoxicologice şi clinice
referitoare la testarea medicamentelor, aprobate prin ordin al ministrului
sănătăţii publice.
(3) Rapoartele detaliate ale experţilor fac parte din
dosarul pe care solicitantul îl prezintă la Agenţia Naţională a Medicamentului.
SECŢIUNEA a 2-a
Dispoziţiile speciale aplicabile medicamentelor homeopate
Art. 710. - (1) Medicamentele homeopate fabricate şi
puse pe piaţă în România trebuie să fie autorizate conform art. 711, 712 şi
713.
(2) Agenţia Naţională a Medicamentului trebuie să
elaboreze o procedură de autorizare simplificată pentru medicamentele la care
se face referire la art. 711, care să fie aprobată prin ordin al ministrului
sănătăţii publice.
Art. 711. - (1) Pot face obiectul unei proceduri
speciale de autorizare simplificată numai medicamentele homeopate care satisfac
toate condiţiile următoare:
- cale de administrare orală sau externă;
- absenţa unor indicaţii terapeutice specifice pe
eticheta produsului sau în orice informaţie legată de produsul respectiv;
- existenţa unui grad sufucient de diluţie pentru a
garanta siguranţa medicamentului; în particular, medicamentul nu poate conţine
nici mai mult de o parte la 10.000 din tinctura-mamă, nici mai mult de 1% din
cea mai mică doză folosită în alopatie pentru substanţele active a căror
prezenţă într-un medicament alopat necesită prezentarea unei prescripţii
medicale.
La momentul autorizării, Agenţia Naţională a
Medicamentului stabileşte clasificarea privind modul de eliberare a
medicamentului.
(2) Criteriile şi regulile procedurale prevăzute la
art. 722 alin. (1), art. 727-732, 824, 828 şi 842 sunt aplicabile prin analogie la procedura specială de autorizare simplificată pentru medicamentele
homeopate, cu excepţia dovedirii eficacităţii terapeutice.
Art. 712. - (1) O cerere pentru autorizare simplificată
poate să se refere la o serie de medicamente derivate din aceeaşi suşă
homeopată.
(2) Pentru a demonstra în special calitatea
farmaceutică şi omogenitatea de la o serie de fabricaţie la alta a acestor
medicamente, cererea trebuie să fie însoţită de următoarele documente:
- denumirea ştiinţifică sau
altă denumire dintr-o farmacopee a suşei/suşelor homeopate, împreună cu
declararea diverselor căi de administrare, forme farmaceutice şi grade de
diluţie care urmează să fie autorizate;
- un dosar care să descrie modul de obţinere şi
control al suşelor homeopate şi justificarea utilizării homeopate a acestora,
pe baza unei bibliografii adecvate;
- dosarul de fabricaţie şi control al fiecărei forme
farmaceutice şi o descriere a metodei de diluare şi dinamizare;
- autorizaţia de fabricaţie a medicamentelor
respective;
- copii ale eventualelor autorizaţii sau certificate
de înregistrare obţinute pentru aceste medicamente în statele membre ale
Uniunii Europene;
- una sau mai multe machete ori mostre ale
ambalajelor primare şi secundare ale medicamentelor ce
urmează să fie autorizate;
- date privind stabilitatea medicamentului.
Art. 713. - (1) Medicamentele homeopate, altele decât
cele prevăzute la art. 711 alin. (1), sunt autorizate şi etichetate conform
prevederilor art. 702 şi 704-708.
(2) Dispoziţiile cap. X sunt aplicabile medicamentelor homeopate, cu excepţia celor
prevăzute la art. 711 alin. (1).
SECŢIUNEA a 3-a
Prevederi speciale aplicabile medicamentelor din
plante medicinale cu utilizare tradiţională
Art. 714. - (1) Se stabileşte o
procedură simplificată de autorizare, denumită în continuare autorizare
pentru utilizare tradiţională, pentru medicamente din plante medicinale cu
utilizare tradiţională ce îndeplinesc în mod cumulativ următoarele criterii:
a) au indicaţii adecvate
exclusiv medicamentelor din plante medicinale cu utilizare tradiţională care,
datorită compoziţiei şi scopului lor, sunt concepute şi destinate a fi
utilizate fără supravegherea unui medic în ceea ce priveşte stabilirea
diagnosticului, prescrierea şi monitorizarea tratamentului;
b) se administrează exclusiv în conformitate cu o
concentraţie şi o posologie specificate;
c) sunt preparate de uz oral, extern şi/sau pentru
inhalaţii;
d) perioada de utilizare tradiţională prevăzută la
art. 716 alin. (1) lit. c) s-a încheiat;
e) informaţiile referitoare la utilizarea
tradiţională a medicamentului sunt suficiente; în mod deosebit, informaţiile
trebuie să dovedească faptul că medicamentul nu este dăunător în condiţiile de
utilizare specificate sau că efectele farmacologice şi eficacitatea
medicamentului sunt plauzibile pe baza utilizării îndelungate şi experienţei.
(2) Prin derogare de la prevederile art. 695 pct. 31,
prezenţa în medicamentele din plante a vitaminelor sau mineralelor, pentru
siguranţa cărora există dovezi bine documentate, nu împiedică produsul de a fi
eligibil pentru autorizare în conformitate cu prevederile alin. (1), cu
condiţia ca acţiunea vitaminelor şi mineralelor să fie auxiliară faţă de aceea a ingredientelor
active din plante, raportat la indicaţia/indicaţiile revendicată/revendicate.
(3) Totuşi, în cazul în care Agenţia Naţională a
Medicamentului consideră că un medicament din plante îndeplineşte criteriile
pentru autorizare conform art. 700 sau 711, prevederile prezentei secţiuni nu
se aplică.
Art. 715. - (1) Solicitantul şi deţinătorul
autorizaţiei de punere pe piaţă trebuie să fie stabiliţi în România sau într-un
stat membru al Uniunii Europene.
(2) Pentru a obţine o autorizare pentru utilizare
tradiţională, solicitantul depune o cerere la Agenţia Naţională a
Medicamentului.
Art. 716. - (1) Cererea trebuie să fie însoţită de:
a) informaţiile şi documentele următoare:
(i) cele prevăzute la art. 702 alin. (4) lit. a) -i),
m) şi n);
(ii) rezultatele testelor farmaceutice la care se face referire la art. 702 alin. (4) lit. j) prima
liniuţă;
(iii) rezumatul caracteristicilor produsului fără
datele specificate la art. 708 pct. 4;
(iv) în cazul combinaţiilor prevăzute la art. 695 pct.
31 sau art. 714 alin. (2), informaţiile la care face referire art. 714 alin.
(1) lit. e) referitoare la combinaţii ca atare; dacă ingredientele active
individuale nu sunt suficient cunoscute, datele se referă şi la acestea;
b) orice autorizaţie de punere pe piaţă obţinută de
solicitant într-un alt stat şi informaţiile privind orice decizie de a refuza
autorizarea de punere pe piaţă în Uniunea Europeană sau într-o ţară terţă,
precum şi motivele pentru o asemenea decizie;
c) dovezile bibliografice sau opinia unui expert
privind faptul că medicamentul respectiv sau un medicament corespondent a fost
utilizat timp de cel puţin 30 de ani înainte de data depunerii cererii, dintre
care cel puţin 15 ani în Uniunea Europeană; Agenţia Naţională a Medicamentului
poate cere Comitetului pentru medicamente pe bază de plante din structura
Agenţiei Europene a Medicamentelor să elaboreze o opinie privind corectitudinea
dovezilor referitoare la utilizarea îndelungată a produsului în discuţie sau a
unui produs corespondent, In acest scop, Agenţia Naţională a Medicamentului
trimite documentaţia relevantă pentru dosarul transmis Comitetului;
d) un studiu al datelor bibliografice privind
siguranţa, împreună cu un raport al expertului şi, atunci când se solicită de
Agenţia Naţională a Medicamentului, date necesare pentru evaluarea siguranţei
medicamentului. Normele şi protocoalele analitice, farmacotoxicologice şi
clinice referitoare la testarea medicamentelor, aprobate prin ordin al
ministrului sănătăţii publice, se aplică prin analogie informaţiilor şi
documentelor prevăzute la lit. a).
(2) Produsul corespondent, în sensul alin. (1) lit. c), este un produs care conţine aceleaşi
ingrediente active indiferent de excipienţii utilizaţi şi este identic sau
similar în ceea ce priveşte indicaţia, concentraţia, posologia şi calea de administrare cu medicamentul pentru care s-a depus cererea.
(3) Cerinţa de a demonstra utilizarea medicală pe o
perioadă de 30 de ani, la care se face referire în alin. (1) lit. c), este
îndeplinită chiar şi atunci când comercializarea produsului nu s-a bazat pe o
autorizaţie specifică; este, de asemenea, îndeplinită cerinţa respectivă dacă
numărul sau cantitatea ingredientelor medicamentului s-a redus în această
perioadă.
(4) Dacă produsul a fost folosit în România sau în
Uniunea Europeană mai puţin de 15 ani, dar sub celelalte aspecte este eligibil
pentru autorizare simplificată, Agenţia Naţională a Medicamentului, primind o
cerere pentru o asemenea
autorizare, se adresează Comitetului pentru medicamente pe bază de plante care
funcţionează în cadrul Agenţiei Europene a Medicamentelor. In acest scop,
Agenţia Naţională a Medicamentului trimite documentaţia relevantă pentru
susţinerea procedurii de arbitraj. Dacă Comitetul elaborează o monografie
comunitară, aceasta trebuie să fie luată în considerare de către Agenţia
Naţională a Medicamentului atunci când ia decizia sa finală.
Art. 717. - (1) Fără a contraveni prevederilor art. 721
alin. (1), secţiunea a 5-a a cap. III se aplică prin analogie autorizaţiilor
eliberate în conformitate cu art. 714, cu condiţia ca:
a) să fi fost elaborată o monografie comunitară pentru
planta respectivă în conformitate cu prevederile art. 721 alin. (3); sau
b) medicamentul din plante să fie constituit din
substanţe vegetale, preparate pe bază de plante sau combinaţii ale acestora,
conţinute în lista la care se face referire la art. 719.
(2) Pentru alte medicamente din plante la care se face
referire la art. 714, atunci când Agenţia Naţională a Medicamentului evaluează
o cerere de autorizare pentru utilizare tradiţională trebuie să ţină seama de
autorizaţiile sau certificatele de înregistrare eliberate de un stat membru al
Uniunii Europene în concordanţă cu prevederile cap. 2a al Directivei
2001/83/CE.
Art. 718. - (1) Autorizarea pentru utilizare
tradiţională este refuzată dacă cererea nu este conformă cu prevederile art.
714, 715 sau 716 ori dacă cel puţin una dintre următoarele condiţii este
îndeplinită:
a) compoziţia calitativă şi cantitativă nu este
conformă cu cea declarată;
b) indicaţiile nu sunt conforme cu condiţiile
prevăzute la art. 714;
c) produsul poate fi dăunător în condiţii normale de
utilizare;
d) datele referitoare la utilizarea tradiţională sunt
insuficiente, în special dacă efectele farmacologice sau eficacitatea nu sunt
plauzibile ţinând cont de vechimea utilizării şi de experienţă;
e) calitatea farmaceutică nu este demonstrată
satisfăcător.
(2) Agenţia Naţională a Medicamentului trebuie să
anunţe solicitantul, Comisia Europeană şi orice autoritate competentă care
solicită aceasta despre orice decizie de a respinge autorizarea pentru
utilizare tradiţională şi motivele deciziei.
Art. 719. - (1) Agenţia Naţională a Medicamentului
preia lista substanţelor vegetale, preparatelor şi combinaţiilor din acestea,
care se folosesc în medicamente din plante cu utilizare tradiţională, elaborată
de Comisia Europeană. Lista conţine, pentru fiecare substanţă vegetală,
indicaţia, concetraţia specificată şi modul de administrare, calea de
administrare şi orice altă informaţie necesară pentru utilizarea în siguranţă a
substanţelor vegetale ca medicamente cu utilizare tradiţională.
(2) Până la momentul aderării sunt aplicabile
reglementările Agenţiei Naţionale a Medicamentului referitoare la medicamentele
din plante cu utilizare tradiţională, precum şi lista substanţelor vegetale,
preparatelor şi combinaţiilor din acestea care se folosesc în medicamente din
plante cu utilizare tradiţională, inclusă în aceste reglementări.
(3) Dacă o cerere de autorizare pentru utilizare
tradiţională este în legătură cu o substanţă vegetală, un preparat pe bază de
plante sau o combinaţie a acestora prevăzută în lista la care se face referire
la alin. (1), respectiv alin. (2), informaţiile prevăzute la art. 716 alin. (1) lit. b), c) şi d) nu trebuie să fie
furnizate; prevederile art. 718 alin. (1) lit. c) şi d) nu se aplică.
(4) Dacă o substanţă vegetală, un preparat pe bază de
plante sau o combinaţie a acestora nu mai este inclusă în lista la care se face
referire la alin. (1), respectiv alin. (2), autorizaţiile eliberate în
conformitate cu prevederile alin. (3) pentru medicamente din plante conţinând
această substanţă, preparat pe bază de plante sau combinaţie a acestora se
retrag, dacă informaţiile şi documentele la care se face referire la art. 716
alin. (1) nu sunt trimise în interval de 3 luni.
Art. 720. - (1) Art. 697 lit. a) si b), art. 700 alin.
(1), art. 709, art. 722 alin. (1), art. 724, 725, 728, 730, 731, 748-761,
780-796, 812-820, art. 823 alin. (1) si (3), art. 824, 828-830, 839, 840, 842,
art. 843 alin. (2) şi art. 846 ale prezentului titlu, precum şi Principiile şi
ghidurile de bună practică de fabricaţie pentru medicamentele de uz uman şi
medicamentele investigaţionale de uz uman, aprobate prin ordin al ministrului
sănătăţii publice, se aplică prin analogie autorizaţiilor pentru utilizare
tradiţională eliberate în baza prevederilor prezentei secţiuni.
(2) In plus faţă de cerinţele prevăzute la art.
763-775, orice etichetare şi prospect trebuie să conţină o precizare
referitoare la faptul că:
a) produsul este un medicament
din plante medicinale cu utilizare tradiţională care se foloseşte pentru
indicaţia specificată, exclusiv pe baza utilizării îndelungate; şi
b) utilizatorul trebuie să consulte un medic sau alt
profesionist din domeniul sănătăţii dacă simptomele persistă în timpul
utilizării medicamentului sau dacă apar reacţii adverse care nu sunt menţionate
în prospect.
(3) In plus faţă de prevederile art. 797-810, orice
material publicitar pentru un medicament autorizat în conformitate cu
prevederile prezentei secţiuni trebuie să conţină următoarea atenţionare:
„Acest medicament din plante medicinale cu utilizare tradiţională se foloseşte
pentru indicaţia/indicaţiile specificată/specificate, exclusiv pe baza
utilizării îndelungate".
Art. 721. - (1) Agenţia Naţională a Medicamentului
desemnează, pentru un mandat de 3 ani ce poate fi reînnoit, un membru şi un
înlocuitor în Comitetul pentru medicamente din plante. Inlocuitorii îi
reprezintă pe membri şi votează în locul acestora atunci când ei lipsesc.
Membrii şi înlocuitorii acestora sunt aleşi în funcţie pentru rolul şi
experienţa lor în evaluarea medicamentelor din plante şi reprezintă Agenţia
Naţională a Medicamentului.
(2) Până la momentul aderării României la Uniunea
Europeană, reprezentanţii Agenţiei Naţionale a Medicamentului participă la
activităţile Comitetului pentru medicamente din plante în calitate de
observatori activi.
(3) La examinarea unei cereri de autorizare de punere
pe piaţă, Agenţia Naţională a Medicamentului trebuie să ia în considerare
monografiile comunitare pentru plante, elaborate şi publicate de Comitetul
pentru medicamente din plante al Agenţiei Europene a Medicamentelor. In cazul
în care nu a fost încă elaborată nici o asemenea monografie comunitară pentru
plante, se poate face referire la alte monografii, publicaţii sau informaţii
adecvate.
Când sunt elaborate noi monografii comunitare de
plante, deţinătorul autorizaţiei de punere pe piaţă apreciază dacă este
necesară modificarea documentaţiei de autorizare în conformitate cu monografia
respectivă. Deţinătorul autorizaţiei de punere pe piaţă informează Agenţia
Naţională a Medicamentului în legătură cu modificarea respectivă.
SECŢIUNEA a 4-a
Proceduri privind autorizarea de punere pe piaţă
Art. 722. - (1) Agenţia Naţională a Medicamentului ia
toate măsurile pentru a se asigura că procedura de eliberare a autorizaţiei de
punere pe piaţă este finalizată în maximum 210 zile de la depunerea unei cereri
valide; cererile pentru autorizare de punere pe piaţă în România în încă în
unul sau mai multe state membre ale Uniunii Europene privind acelaşi medicament
se depun în concordanţă cu prevederile art. 735-747.
(2) Dacă Agenţia Naţională a Medicamentului constată că
o altă cerere de autorizare de punere pe piaţă pentru acelaşi medicament este
examinată în alt stat membru al Uniunii Europene, Agenţia Naţională a Medicamentului
refuză evaluarea cererii şi îi comunică solicitantului că în acest caz se
aplică prevederile art. 735-747.
Art. 723. - Când Agenţia Naţională a Medicamentului
este informată, în conformitate cu prevederile art. 702 alin. (4) lit. o), că
un alt stat membru al Uniunii Europene a autorizat un medicament pentru care se
solicită autorizarea în România, Agenţia Naţională a Medicamentului respinge
solicitarea, dacă aceasta nu a fost depusă în conformitate cu prevederile art.
735-747.
Art. 724. - Pentru a examina cererea depusă în
conformitate cu prevederile art. 702 şi 704-707, Agenţia Naţională a
Medicamentului:
a) trebuie să verifice dacă dosarul prezentat în
susţinerea cererii este în concordanţă cu art. 702 şi 704-707 şi să examineze
dacă toate condiţiile pentru eliberarea unei autorizaţii de punere pe piaţă a
medicamentelor sunt respectate;
b) poate supune medicamentul, materiile prime şi, dacă
este necesar, produşii intermediari sau alte componente, testării în
laboratoarele de control proprii sau în laboratoare autorizate/recunoscute de
Agenţia Naţională a Medicamentului în acest scop şi se asigură că metodele de
control utilizate de fabricant şi descrise în specificaţiile ce însoţesc
cererea, conform art. 702 alin. (4) lit. i), sunt corespunzătoare;
c) poate cere, dacă este cazul, ca solicitantul să
completeze dosarul ce însoţeşte cererea cu elementele prevăzute la art. 702
alin. (4) şi la art. 704-707; dacă Agenţia Naţională a Medicamentului se
prevalează de această opţiune, intervalul de timp prevăzut la art. 722 alin.
(1) se suspendă până când informaţiile suplimentare cerute sunt furnizate;
intervalul de timp se suspendă şi în situaţia în care se permite solicitantului
să furnizeze explicaţii orale sau scrise, până la furnizarea acestora;
d) poate efectua inspecţii în anumite situaţii, atunci
când consideră că există motive pentru a suspecta nerespectarea principiilor şi
ghidurilor de bună practică de fabricaţie menţionate la
art. 756.
Art. 725. - Ministerul Sănătăţii Publice ia toate măsurile
necesare pentru a se asigura că:
a) Agenţia Naţională a Medicamentului verifică faptul
că fabricanţii şi importatorii de medicamente provenind din ţări terţe pot
desfăşura producţia conform specificaţiilor furnizate în aplicarea art. 702
alin. (4) lit. e) şi/sau să efectueze controale în conformitate cu metodele
descrise în dosarul care însoţeşte cererea făcută potrivit prevederilor art.
702 alin. (4) lit. i);
b) Agenţia Naţională a Medicamentului autorizează
fabricanţii şi importatorii de medicamente provenind din ţări terţe, în cazuri
justificate, să delege efectuarea anumitor faze ale producţiei şi/sau
controalelor prevăzute la lit. a) unor terţi; în acest caz, verificările
Agenţiei Naţionale a Medicamentului
se realizează şi în localurile terţilor desemnaţi.
Art. 726. - (1) La emiterea autorizaţiei de punere pe
piaţă deţinătorul este informat de către Agenţia Naţională a Medicamentului
privind rezumatul caracteristicilor produsului, aşa cum a fost el aprobat.
(2) Agenţia Naţională a Medicamentului ia toate
măsurile necesare pentru a se asigura că informaţiile conţinute în rezumatul
caracteristicilor produsului sunt în conformitate cu cele acceptate la emiterea
autorizaţiei de punere pe piaţă sau ulterior.
(3) Agenţia Naţională a Medicamentului face publică
fără întârziere autorizaţia de punere pe piaţă împreună cu rezumatul
caracteristicilor produsului, pentru fiecare medicament autorizat.
(4) Agenţia Naţională a Medicamentului întocmeşte un
raport de evaluare şi comentarii asupra documentaţiei în ceea ce priveşte
rezultatele testelor farmaceutice şi preclinice şi ale studiilor clinice ale
medicamentului în cauză; raportul de evaluare este actualizat ori de câte ori
devin disponibile informaţii noi, importante pentru evaluarea calităţii,
siguranţei şi eficacităţii medicamentului în cauză. Agenţia Naţională a
Medicamentului pune fără întârziere la dispoziţie publicului raportul de
evaluare şi motivele care au stat la baza deciziei sale, cu excepţia
informaţiilor comerciale confidenţiale. Motivele sunt furnizate separat pentru
fiecare indicaţie terapeutică solicitată.
(5) In termen de 5 zile de la validarea autorizaţiei
de punere pe piaţă de către Ministerul Sănătăţii Publice, conform Ordonanţei
Guvernului nr. 125/1998, aprobată cu modificări şi completări prin Legea nr.
594/2002, cu modificările şi completările ulterioare, Agenţia Naţională a
Medicamentului publică pe pagina de Internet informaţia privind autorizarea
pentru fiecare medicament autorizat.
Art. 727. - (1) In situaţii excepţionale şi ca urmare a
consultării cu solicitantul, autorizaţia poate fi acordată sub rezerva asumării
de către acesta a obligaţiei de a îndeplini anumite condiţii privind mai ales
siguranţa medicamentului, informarea Agenţiei Naţionale a Medicamentului asupra
oricărui incident legat de utilizarea acestuia şi măsurile care se impun.
(2) Această autorizaţie poate fi acordată numai
pentru motive obiective, verificabile şi trebuie să se bazeze pe una dintre
premisele prevăzute în Normele şi protocoalele analitice, farmacotoxicologice
şi clinice referitoare la testarea medicamentelor, aprobate prin ordin al
ministrului sănătăţii publice; menţinerea autorizaţiei se face în baza
reevaluării anuale a acestor condiţii.
(3) Lista acestor condiţii trebuie să fie făcută
publică fără întârziere, împreună cu termenele limită şi cu datele de
îndeplinire.
Art. 728. - (1) După emiterea unei autorizaţii de
punere pe piaţă, deţinătorul autorizaţiei trebuie, în ceea ce priveşte metodele
de fabricaţie şi control prevăzute la art. 702 alin. (4) lit. e) şi i), să ţină
seama de progresul ştiinţific şi tehnic şi să introducă orice schimbare
necesară pentru a permite fabricarea şi verificarea medicamentului prin
mijloace ştiinţifice generai acceptate; aceste schimbări trebuie aprobate de
către Agenţia Naţională a Medicamentului.
(2) Deţinătorul autorizaţiei de punere pe piaţă trebuie
să furnizeze imediat Agenţiei Naţionale a Medicamentului orice informaţie nouă
care ar atrage modificarea informaţiilor sau documentelor prevăzute la art. 702
alin. (4), art. 704-706 şi 708 sau 740 ori în Normele şi protocoalele
analitice, farmacotoxicologice şi clinice referitoare la testarea
medicamentelor, aprobate prin ordin al ministrului sănătăţii publice.
(3) Deţinătorul autorizaţiei de punere pe piaţă
trebuie să informeze Agenţia Naţională a Medicamentului în special privind
orice interdicţie sau restricţie impusă de autorităţile competente din orice
ţară unde medicamentul este pus pe piaţă şi orice informaţie ce poate influenţa
evaluarea riscurilor şi beneficiilor medicamentului de uz uman în cauză.
(4) Pentru ca raportul risc-beneficiu să fie evaluat
în mod continuu, Agenţia Naţională a Medicamentului poate solicita în orice
moment deţinătorului autorizaţiei de punere pe piaţă să furnizeze date ce
demonstrează că raportul risc-beneficiu rămâne favorabil.
Art. 729. - (1) După acordarea unei autorizaţii de
punere pe piaţă, deţinătorul trebuie să informeze Agenţia Naţională a
Medicamentului asupra datei de punere efectivă pe piaţă a medicamentului de uz
uman în România, luând în considerare diferitele forme de prezentare
autorizate.
(2) Deţinătorul trebuie, de asemenea, să anunţe
Agenţia Naţională a Medicamentului dacă produsul încetează să fie pus pe piaţă
fie temporar, fie permanent; o astfel de notificare trebuie să fie făcută cu
cel puţin două luni înainte de întreruperea punerii pe piaţă a medicamentului,
cu excepţia situaţiilor excepţionale.
(3) Pe baza solicitării Ministerului Sănătăţii
Publice, în special în contextul farmacovigilenţei, deţinătorul autorizaţiei de
punere pe piaţă trebuie să furnizeze Ministerului Sănătăţii Publice toate
datele privind volumul de vânzări al medicamentului şi orice date aflate în
posesia acestuia privind volumul de prescrieri.
Art. 730. - (1) Fără a aduce atingere prevederilor
alin. (5) şi (6), o autorizaţie de punere pe piaţă este valabilă 5 ani.
(2) Autorizaţia de punere pe piaţă poate fi reînnoită
după 5 ani pe baza unei reevaluări a raportului risc - beneficiu de către
Agenţia Naţională a Medicamentului, dacă această autoritate a eliberat
autorizaţia; în acest scop, cu cel puţin 6 luni înainte de expirarea
autorizaţiei de punere pe piaţă, în conformitate cu prevederile alin. (1),
deţinătorul acesteia trebuie să depună la Agenţia Naţională a Medicamentului o
versiune consolidată a dosarului cu privire la calitate, siguranţă şi
eficacitate, inclusiv orice variaţie survenită de la acordarea autorizaţiei.
(3) Valabilitatea autorizaţiei de punere pe piaţă
reînnoite conform alin. (2) este de 5 ani.
(4) Medicamentele pentru care s-au depus cereri de
reînnoire a autorizaţiei de punere pe piaţă pot fi menţinute în circuitul
terapeutic până la soluţionarea cererii de reînnoire a autorizaţiei.
(5) O dată reînnoită,
autorizaţia de punere pe piaţă este valabilă pe o perioadă nelimitată, cu
excepţia situaţiei în care Agenţia Naţională a Medicamentului decide, pe baza
unor motive justificate privind farmacovigilenţa, să procedeze la o altă
reînnoire a autorizaţiei după 5 ani, în conformitate cu prevederile alin. (2).
(6) Orice autorizaţie de punere pe piaţă, care în
primii 3 ani de la emitere nu a fost urmată de punerea efectivă a
medicamentului pe piaţă în România, îşi încetează valabilitatea.
(7) Dacă un medicament
autorizat, pus pe piaţă anterior, nu mai este prezent timp de 3 ani consecutivi
în România, autorizaţia îşi încetează valabilitatea.
(8) Agenţia Naţională a Medicamentului poate, în
situaţii excepţionale şi ţinând cont de interesul sănătăţii publice, să acorde
derogări de la prevederile alin. (6) şi (7); astfel de excepţii trebuie riguros
justificate.
(9) Dacă pentru un medicament nu se solicită
reînnoirea autorizaţiei de punere pe piaţă în termenul
prevăzut la alin. (2), medicamentul poate fi menţinut
în circuitul terapeutic până la epuizarea cantităţilor distribuite în reţeaua
farmaceutică, dar nu mai mult de un an de la expirarea autorizaţiei de punere
pe piaţă.
(10) Procedura de autorizare de punere pe piaţă a unui
medicament poate fi întreruptă ca urmare a retragerii cererii solicitantului.
Art. 731. - Autorizarea de punere pe piaţă nu înlătură
răspunderea civilă şi penală a fabricantului şi, după caz, a deţinătorului
autorizaţiei de punere pe piaţă.
Art. 732. - (1) Autorizarea de punere pe piaţă este refuzată dacă, după verificarea specificaţiilor
şi documentelor prevăzute la art. 702 şi 704 - 707, se constată că:
a) raportul risc -beneficiu nu este considerat a fi
favorabil; sau
b) eficacitatea terapeutică este insuficient
fundamentată de către solicitant; sau
c) compoziţia calitativă şi cantitativă nu este
conformă cu declaraţia.
(2) Autorizarea este refuzată, de asemenea, dacă orice
informaţie sau document depus în susţinerea cererii nu este conform cu
prevederile art. 702 şi 704-707.
(3) Solicitantul sau deţinătorul autorizaţiei de
punere pe piaţă este responsabil de acurateţea documentelor şi datelor depuse.
Art. 733. - Medicamentele autorizate în vederea punerii
pe piaţă în Uniunea Europeană, prin procedura centralizată, recunoaştere
mutuală sau descentralizată, se autorizează în România conform unor proceduri
simplificate prezentate în reglementările Agenţiei Naţionale a Medicamentului.
Art. 734. - Medicamentele realizate în România prin
cooperare sunt supuse procedurii de autorizare de
punere pe piaţă în funcţie de natura cooperării, conform reglementărilor
Agenţiei Naţionale a Medicamentului.
SECŢIUNEA a 5-a
Procedura de recunoaştere mutuală şi procedura
descentralizată
Art. 735. - (1) Agenţia Naţională a Medicamentului
desemnează pentru un mandat de 3 ani, ce se poate reînnoi, un reprezentant în
Grupul de coordonare a procedurilor descrise în prezenta secţiune;
reprezentantul Agenţiei Naţionale a Medicamentului în Grupul de coordonare
poate fi însoţit de experţi.
(2) Până la momentul aderării
României la Uniunea Europeană, reprezentantul Agenţiei Naţionale a
Medicamentului participă la activităţile Grupului de coordonare în calitate de
observator activ.
Art. 736. - (1) In scopul obţinerii autorizaţiei de
punere pe piaţă în România şi în încă unul sau mai multe state membre ale Uniunii
Europene, un solicitant depune cereri însoţite de dosare identice la Agenţia
Naţională a Medicamentului şi la autorităţile competente din aceste state.
Dosarul conţine informaţiile şi documentele prevăzute la art. 702 şi 704-708.
Documentele depuse trebuie să includă o listă a statelor membre ale Uniunii
Europene unde a fost depusă cererea.
Solicitantul cere ca România sau alt stat membru al
Uniunii Europene să acţioneze ca „stat membru de referinţă" şi să
elaboreze un raport de evaluare a medicamentului în acord cu prevederile alin.
(2) sau (3).
(2) Dacă medicamentul a primit deja o autorizaţie de
punere pe piaţă la momentul depunerii cererii, România acţionează ca stat
membru interesat şi Agenţia Naţională a Medicamentului recunoaşte autorizaţia
de punere pe piaţă acordată de statul membru de referinţă. In acest scop, deţinătorul autorizaţiei de punere pe
piaţă cere statului membru de referinţă fie să elaboreze un raport de evaluare
privind medicamentul, fie, dacă este cazul, să actualizeze raportul de evaluare
existent. In cazul în care România este statul membru de referinţă, Agenţia
Naţională a Medicamentului trebuie să elaboreze/actualizeze raportul de
evaluare în cel mult 90 de zile de la primirea unei
cereri valide.
Raportul de evaluare împreună cu rezumatul
caracteristicilor produsului, etichetarea şi prospectul aprobate sunt trimise
statelor membre interesate şi solicitantului.
(3) Dacă medicamentul nu a primit autorizaţie de
punere pe piaţă la momentul depunerii cererii la Agenţia Naţională a Medicamentului,
în cazul în care România este statul membru de referinţă, solicitantul îi cere
Agenţiei Naţionale a Medicamentului să pregătească un proiect de raport de
evaluare, un proiect al rezumatului caracteristicilor produsului şi un proiect
al etichetării şi prospectului; Agenţia Naţională a Medicamentului pregăteşte
aceste proiecte în maximum 120 de zile după primirea unei cereri valide şi le
trimite statelor membre interesate şi solicitantului. La înregistrarea
acordului tuturor părţilor, Agenţia Naţională a Medicamentului închide
procedura şi îl informează pe solicitant în consecinţă.
(4) In cazul în care România acţionează ca stat
membru interesat, în termen de 90 de zile de la primirea documentelor la care
se face referire în alin. (2) şi (3), Agenţia Naţională a Medicamentului aprobă
raportul de evaluare, rezumatul caracteristicilor produsului, etichetarea şi
prospectul şi informează statul membru de referinţă în consecinţă.
(5) Dacă a fost depusă o
cerere potrivit prevederilor alin. (1), Agenţia Naţională a Medicamentului
adoptă o decizie în conformitate cu raportul de evaluare, rezumatul
caracteristicilor produsului, etichetarea şi prospectul, aşa cum au fost
aprobate, în termen de 30 de zile de la înştiinţarea privind acordul.
Art. 737. - (1) Dacă, în perioada prevăzută la art. 736
alin. (4), Agenţia Naţională a Medicamentului nu poate aproba raportul de
evaluare, rezumatul caracteristicilor produsului, etichetarea şi prospectul,
datorită unui risc potenţial grav pentru sănătatea publică, trebuie să expună
detaliat motivele şi să le comunice statului membru de referinţă, celorlalte
state membre interesate şi solicitantului; punctele de dezacord sunt transmise
imediat Grupului de coordonare.
(2) Agenţia Naţională a Medicamentului aplică prevederile
ghidurilor adoptate de Comisia Europeană, care definesc riscul potenţial grav
pentru sănătatea publică.
(3) In cadrul Grupului de coordonare, România, prin
intermediul reprezentanţilor desemnaţi de Agenţia Naţională a Medicamentului,
împreună cu reprezentanţii celorlalte state membre menţionate la alin. (1),
trebuie să depună toate eforturile pentru ajungerea la un acord privind
măsurile ce trebuie luate. Ei trebuie să acorde solicitantului posibilitatea de
a-şi susţine punctul de vedere oral sau în scris. Dacă în 60 de zile de la
comunicarea punctelor de dezacord se ajunge la un acord, România, dacă este
stat de referinţă, înregistrează acordul, închide procedura şi îl informează pe
solicitant în consecinţă; în acest caz se aplică prevederile art. 736 alin.
(5).
(4) Dacă nu se ajunge la un acord în perioada de 60
de zile prevăzută la alin (3), Agenţia Europeană a Medicamentelor este
informată imediat, în vederea aplicării procedurii prevăzute la art. 32, 33 şi
34 din Directiva 2001/83/CE. Informaţiile transmise trebuie să definească
detaliat obiectul dezacordului dintre statele membre si
motivele acestuia. O copie a informării este
trimisă solicitantului.
(5) Imediat ce solicitantul
este informat că problema a fost transmisă Agenţiei Europene a Medicamentelor,
el trebuie să transmită acesteia o copie a informaţiilor şi documentelor
prevăzute la art. 736 alin. (1).
(6) In situaţiile prevăzute la alin. (3), dacă
Agenţia Naţională a Medicamentului a aprobat raportul de evaluare, proiectul
rezumatului caracteristicilor produsului, etichetarea şi prospectul statului
membru de referinţă, poate, la cererea solicitantului, să autorizeze
medicamentul fără a aştepta rezultatul procedurii prevăzute la art. 32 din
Directiva 2001/83/CE; în această situaţie, autorizaţia este acordată fără a
prejudicia rezultatul acelei proceduri.
Art. 738. - (1) In cazul în care au fost depuse două
sau mai multe solicitări potrivit prevederilor art. 702 şi 704-708 pentru
autorizarea de punere pe piaţă a unui anume medicament şi dacă Agenţia
Naţională a Medicamentului şi alte autorităţi competente ale statelor membre au
adoptat decizii divergente privind autorizarea medicamentului sau suspendarea
ori retragerea acestuia, Agenţia Naţională a Medicamentului sau autoritatea competentă
a altui stat membru al Uniunii Europene, Comisia Europeană ori solicitantul sau
deţinătorul autorizaţiei de punere pe piaţă se poate adresa Comitetului pentru
Medicamente de Uz Uman al Agenţiei Europene a Medicamentelor, denumit în
continuare Comitetul, pentru
aplicarea procedurii prevăzute la art. 32, 33 şi 34 din Directiva 2001/83/CE.
(2) Pentru a promova armonizarea autorizaţiilor de
punere pe piaţă a medicamentelor în Uniunea Europeană, Agenţia Naţională a
Medicamentului transmite anual Grupului de coordonare o listă de medicamente
pentru care trebuie alcătuit un rezumat armonizat al caracteristicilor
produsului.
Art. 739. - (1) Inainte să fie luată o decizie privind
o cerere de autorizare de punere pe piaţă sau de suspendare ori de retragere a
unei autorizaţii sau de modificare a termenilor unei autorizaţii de punere pe
piaţă considerate necesară, în cazuri speciale, unde sunt implicate interesele
Uniunii Europene, în special când este vorba de informaţiile colectate conform
cap. X din prezentul titlu,
Agenţia Naţională a Medicamentului, statele membre ale Uniunii Europene sau
Comisia Europeană ori solicitantul sau deţinătorul autorizaţiei de punere pe
piaţă se adresează Comitetului pentru aplicarea procedurii prevăzute la art.
32, 33 şi 34 din Directiva 2001/83/CE.
Agenţia Naţională a Medicamentului, autoritatea
competentă a altui stat membru interesat sau Comisia Europeană trebuie să
identifice clar problema care este adresată Comitetului spre evaluare şi să
informeze solicitantul sau deţinătorul autorizaţiei de punere pe piaţă.
Agenţia Naţională a Medicamentului şi solicitantul sau
deţinătorul autorizaţiei de punere pe piaţă trebuie să furnizeze Comitetului
toate informaţiile disponibile despre problema în discuţie.
(2) In cazul în care solicitarea de arbitraj adresată
Comitetului se referă la o gamă de medicamente sau la o clasă terapeutică,
procedura poate fi limitată la anumite părţi ale autorizaţiei; în acest caz,
acelor medicamente li se aplică prevederile art. 743 numai dacă au fost
folosite procedurile de autorizare prevăzute în prezenta secţiune.
Art. 740. - Agenţia Naţională a Medicamentului, precum
şi solicitantul sau deţinătorul autorizaţiei de punere pe piaţă primesc de ia
Agenţia Europeană a Medicamentelor, în 15 zile de la adoptare, opinia finală a
Comitetului împreună cu un raport care prezintă evaluarea medicamentului şi
indică motivele pentru concluziile rezultate.
In cazul unei opinii favorabile acordării sau
menţinerii unei autorizaţii de punere pe piaţă a medicamentului în cauză, sunt
anexate opiniei următoarele documente:
a) un proiect al rezumatului caracteristicilor
produsului, conform prevederilor art. 708;
b) orice condiţii ce afectează autorizaţia, în
înţelesul art. 32 alin. (4) lit. c) din Directiva 2001/83/CE;
c) detalii ale condiţiilor recomandate sau
restricţiilor privind siguranţa şi utilizarea efectivă a medicamentului;
d) textul propus pentru etichetare şi prospect.
Art. 741. - Agenţia Naţională a Medicamentului, precum
şi solicitantul sau deţinătorul autorizaţiei de punere pe piaţă primesc un
proiect de decizie însoţit de documentele prevăzute la art. 740 în cazul în
care decizia Comisiei Europene este de a elibera autorizaţia de punere pe
piaţă; în cazul în care, în mod excepţional, decizia Comisiei Europene nu este
în concordanţă cu opinia Agenţiei Europene a Medicamentelor, proiectul de
decizie trebuie să fie însoţit şi de o explicaţie detaliată a motivelor pentru
concluziile rezultate.
Art. 742. - (1) Agenţia
Naţională a Medicamentului trebuie să formuleze observaţiile scrise privind
proiectul de decizie în termen de 22 de zile de la primirea acestuia şi să le
transmită la Comisia Europeană. In cazul în care trebuie luată urgent o decizie
de către Comisia Europeană, răspunsul trebuie trimis într-un termen mai scurt,
stabilit în funcţie de gradul de urgenţă identificat.
(2) Agenţia Naţională a Medicamentului are
posibilitatea să depună o cerere în scris pentru ca proiectul de decizie să fie
discutat într-o întâlnire plenară a Comitetului permanent al Comisiei Europene.
(3) Agenţia Naţională a Medicamentului acordă sau
retrage autorizaţia de punere pe piaţă ori modifică termenii acesteia după cum
este necesar pentru a fi în acord cu decizia Comisiei Europene, în termen de 30
de zile după notificare, făcând referire la această decizie. Agenţia Naţională
a Medicamentului informează Comisia Europeană şi Agenţia Europeană a
Medicamentelor în consecinţă.
Art. 743. - Orice cerere din partea deţinătorului
autorizaţiei de punere pe piaţă pentru modificarea unei autorizaţii de punere
pe piaţă care a fost acordată conform prevederilor prezentei secţiuni trebuie
să fie depusă la Agenţia Naţională a Medicamentului şi la toate statele membre
ale Uniunii Europene care au autorizat anterior medicamentul în cauză.
Art. 744. - (1) Dacă Agenţia Naţională a Medicamentului
consideră că, pentru protecţia sănătăţii publice, este necesară modificarea,
suspendarea sau retragerea unei autorizaţii de punere pe piaţă care a fost
acordată conform prevederilor prezentei secţiuni, Agenţia Naţională a
Medicamentului transmite propunerea către Agenţia Europeană a Medicamentelor
pentru aplicarea procedurilor prevăzute la art. 32, 33 si 34 din Directiva
2001/83/CE.
(2) Fără a contraveni prevederilor art. 739, în cazuri
excepţionale, unde acţionarea de urgenţă este esenţială pentru protecţia
sănătăţii publice, până la adoptarea unei decizii definitive, Agenţia Naţională
a Medicamentului poate suspenda punerea pe piaţă şi utilizarea medicamentului
în cauză pe teritoriul României.
Agenţia Naţională a Medicamentului informează Comisia
Europeană şi celelalte state membre ale Uniunii Europene nu mai târziu de
următoarea zi lucrătoare asupra motivelor pentru acţiunea sa.
Art. 745. - Agenţia Naţională a Medicamentului
transmite Agenţiei Europene a Medicamentelor informaţiile necesare pentru
elaborarea şi publicarea unui raport anual privind utilizarea procedurilor
prevăzute în prezenta secţiune.
Art. 746. - Agenţia Naţională a Medicamentului
transmite Comisiei Europene informaţiile necesare elaborării unui raport
privind experienţa acumulată pe baza procedurilor descrise în prezenta
secţiune.
Art. 747. - (1) Prevederile art. 737 alin. (4) -(6) şi
ale art. 738-742 nu se aplică medicamentelor homeopate prevăzute la art. 711.
(2) Prevederile art. 736 - 742 nu se aplică
medicamentelor homeopate prevăzute la art. 713 alin. (2).
CAPITOLUL IV
Fabricaţie şi import
Art. 748. - (1) Agenţia Naţională a Medicamentului ia
toate măsurile necesare pentru a se asigura că fabricaţia medicamentelor pe
teritoriul României se efectuează numai de către deţinătorii unei autorizaţii
de fabricaţie; această autorizaţie este necesară chiar dacă medicamentele
fabricate sunt destinate exclusiv exportului.
(2) Autorizaţia prevăzută la alin. (1) este necesară
atât pentru fabricaţia parţială, cât şi totală şi pentru diferite procese de
divizare, ambalare sau schimbare a formei de prezentare; cu toate acestea, o
astfel de autorizaţie nu este necesară pentru preparare, divizare, schimbare a
formei de ambalare sau prezentare atunci când aceste procese sunt efectuate în
scopul livrării cu amănuntul, de către farmaciştii din farmacii sau de persoane
legal autorizate în România să efectueze astfel de procese.
(3) Autorizaţia prevăzută la alin. (1) este necesară
şi pentru importuri provenite din ţări terţe în România; prevederile
prezentului capitol şi ale art. 830 se aplică în acelaşi mod pentru astfel de
importuri, ca şi pentru fabricaţie.
(4) Agenţia Naţională a Medicamentului înaintează la
Agenţia Europeană a Medicamentelor o copie a autorizaţiei prevăzute la alin.
(1), care este introdusă în baza de date a Uniunii Europene prevăzută la art.
823 alin. (6).
Art. 749. - (1) Pentru obţinerea autorizaţiei de
fabricaţie, solicitantul trebuie să îndeplinească cel puţin următoarele cerinţe
cumulative:
a) să specifice medicamentele şi formele farmaceutice
care sunt fabricate sau importate şi, de asemenea, locul unde ele sunt
fabricate şi/sau controlate;
b) să aibă la dispoziţie, pentru fabricaţia sau
importul medicamentelor prevăzute la lit. a), spaţii adecvate şi suficiente,
echipament tehnic şi posibilităţi de control în acord cu cerinţele legale ale
României în ceea ce priveşte atât fabricarea şi controlul, cât şi depozitarea
medicamentelor, conform prevederilor art. 725;
c) pentru testări speciale, controlul calităţii
medicamentului poate fi realizat pe bază de contract încheiat între unitatea de
producţie şi unitatea de control, în afara locului de producţie, în unităţi de
control autorizate/recunoscute de Agenţia Naţională a Medicamentului, în baza
reglementărilor emise de aceasta şi aprobate prin ordin al ministrului
sănătăţii publice;
d) să aibă la dispoziţie serviciile cel puţin ale
unei persoane calificate în sensul prevederilor art.
757.
(2) Solicitantul trebuie să furnizeze în cererea sa
precizări în susţinerea celor declarate potrivit alin. (1).
Art. 750. - (1) Agenţia Naţională a Medicamentului
emite autorizaţia de fabricaţie, care este valabilă 3 ani, numai după ce s-a
asigurat de acurateţea informaţiilor furnizate conform prevederilor art. 749
printr-o inspecţie efectuată de inspectorii săi.
(2) Pentru a se asigura că cerinţele prevăzute la art.
749 sunt respectate, autorizaţia poate fi condiţionată de îndeplinirea anumitor obligaţii impuse,
fie când este acordată autorizaţia, fie la o dată ulterioară.
(3) Autorizaţia se eliberează numai pentru spaţiile,
medicamentele şi formele farmaceutice specificate în cerere.
Art. 751. - Agenţia Naţională a Medicamentului ia
măsuri adecvate pentru a se asigura că timpul necesar pentru procedura de
acordare a autorizaţiei de fabricaţie nu depăşeşte 90 de zile de la data la
care Agenţia Naţională a Medicamentului a primit solicitarea.
Art. 752. - Dacă deţinătorul autorizaţiei de fabricaţie
cere o schimbare în oricare dintre informaţiile prevăzute la art. 749 alin. (1)
lit. a) şi b), timpul necesar pentru procedura în legătură cu această cerere nu
trebuie să depăşească 30 de zile; în situaţii excepţionale, această perioadă se
poate extinde până la 90 de zile.
Art. 753. - Agenţia Naţională a Medicamentului poate
cere solicitantului informaţii suplimentare în legătură cu datele furnizate
conform art. 749 şi privind persoana calificată prevăzută la art. 757; dacă
Agenţia Naţională a Medicamentului exercită acest drept, aplicarea termenelor
limită prevăzute la art. 751 şi 752 este suspendată până când informaţiile
cerute suplimentar sunt furnizate.
Art. 754. - Deţinătorul unei autorizaţii de fabricaţie
este obligat cel puţin:
a) să aibă la dispoziţie serviciile unui personal care
să corespundă cerinţelor legale existente în România atât în ceea ce priveşte
fabricaţia, cât şi controlul;
b) să elimine medicamentele autorizate numai în acord
cu legislaţia din România;
c) să anunţe în prealabil Agenţia Naţională a
Medicamentului despre orice schimbări doreşte să facă în datele furnizate
conform art. 749; în orice situaţie, Agenţia Naţională a Medicamentului va fi
imediat informată dacă persoana calificată prevăzută la art. 757 este înlocuită
neaşteptat;
d) să permită inspectorilor Agenţiei Naţionale a
Medicamentului accesul în orice moment în unităţile sale;
e) să permită persoanei calificate prevăzute la art.
757 să îşi exercite sarcinile sale, de exemplu prin punerea la dispoziţia sa a
mijloacelor necesare;
f) să respecte principiile şi ghidurile de bună
practică de fabricaţie pentru medicamente şi să folosească ca materii prime
numai substanţe active care au fost fabricate conform ghidurilor detaliate de
bună practică de fabricaţie pentru materiile prime; Agenţia Naţională a
Medicamentului aplică aceste prevederi şi anumitor excipienţi, a căror listă,
împreună cu condiţiile de aplicare, se transpune prin ordin al ministrului
sănătăţii publice după adoptarea unei directive europene.
Art. 755. - (1) In înţelesul
prezentului titlu, fabricarea substanţelor active utilizate ca materii prime
include atât fabricarea parţială şi totală sau importul substanţelor active
folosite ca materii prime conform părţii I pct. 3.2.1.1 lit. b) din Normele şi protocoalele analitice, farmacotoxicologice
şi clinice referitoare la testarea medicamentelor, aprobate prin ordin al
ministrului sănătăţii publice, cât şi diferitele procese de divizare, ambalare
sau prezentare ce preced încorporarea într-un medicament, inclusiv reambalarea
sau reetichetarea, aşa cum sunt efectuate de un distribuitor de materii prime.
(2) Agenţia Naţională a Medicamentului preia orice
amendamente necesare pentru a adapta alin. (1) la noile dezvoltări ştiinţifice
şi tehnice identificate şi comunicate de Comitetul permanent
al Comisiei Europene.
Art. 756. - Agenţia Naţională a Medicamentului aplică
prevederile ghidurilor publicate de Comisia Europeană privind forma şi
conţinutul autorizaţiei prevăzute la art. 748
alin. (1), ale rapoartelor prevăzute
la art. 823 alin. (3), forma şi conţinutul certificatului de bună practică de
fabricaţie prevăzut la art. 823 alin. (5).
Art. 757. - (1) Agenţia Naţională a Medicamentului ia
toate măsurile necesare pentru a se asigura că deţinătorul autorizaţiei de
fabricaţie are permanent şi continuu la îndemână serviciile cel puţin ale unei
persoane calificate conform condiţiilor prevăzute la art. 758, responsabilă în
particular de îndeplinirea sarcinilor prevăzute la art. 760.
(2) Dacă deţinătorul autorizaţiei de fabricaţie
îndeplineşte personal condiţiile prevăzute la art. 758, acesta poate să îşi
asume responsabilitatea prevăzută la alin. (1).
Art. 758. - (1) Agenţia Naţională a Medicamentului se
asigură că persoana calificată prevăzută la art. 757 îndeplineşte condiţiile de
calificare prevăzute la alin. (2)-(8).
(2) O persoană calificată trebuie să deţină o
diplomă, certificat sau altă dovadă de calificare oficială dobândită la
terminarea unor studii universitare ori a unui curs recunoscut ca echivalent de
către România, pe o perioadă de cel puţin 4 ani de studii teoretice şi practice
în una dintre următoarele discipline ştiinţifice: farmacie, medicină, medicină
veterinară, chimie, chimie şi tehnologie farmaceutică, biologie.
(3) Prin excepţie de la prevederile alin. (2), durata
minimă a cursurilor universitare poate fi de 3 ani şi jumătate acolo unde
cursul este urmat de o perioadă de formare teoretică şi practică de cel puţin
un an şi incluzând o perioadă de practică într-o farmacie de circuit deschis de
cel puţin 6 luni, coroborate cu un examen de nivel universitar.
(4) Dacă două cursuri universitare sau două cursuri
recunoscute de România ca fiind echivalente coexistă în România şi dacă unul
dintre acestea se extinde pe mai mult de 4 ani, iar celălalt peste 3 ani,
cursul de 3 ani finalizat cu o diplomă, certificat sau alte dovezi de
calificare oficiale dobândite la terminarea unui curs universitar ori a unui
curs echivalent recunoscut se consideră că îndeplineşte condiţia de durată
prevăzută la alin. (3), în condiţiile în care diplomele, certificatele sau alte
dovezi de calificare oficiale dobândite la completarea ambelor cursuri sunt
recunoscute ca şi cursuri echivalente de către România.
(5) Cursul trebuie să includă studii teoretice şi
practice în cel puţin următoarele domenii de bază:
a) fizică experimentală;
b) chimie generală şi anorganică;
c) chimie organică;
d) chimie analitică;
e) chimie farmaceutică, inclusiv analiza
medicamentelor;
f) biochimie generală şi aplicată (medicală);
g) fiziologie;
h) microbiologie;
i) farmacologie;
j) tehnologie farmaceutică;
k) toxicologie;
l) farmacognozie (studiul
compoziţiei şi efectelor substanţelor active naturale de origine vegetală şi
animală).
Studiile în aceste domenii trebuie să fie echilibrate
şi să permită persoanei în cauză să îndeplinească obligaţiile specificate la
art. 760.
(6) In ceea ce priveşte anumite diplome, certificate
sau alte dovezi de calificare oficială prevăzute la alin. (2), care nu
îndeplinesc criteriile prevăzute la alin. (2) -(5), Agenţia Naţională a Medicamentului
se asigură că persoana în cauză produce dovezi de cunoştinţe adecvate ale
subiectelor în discuţie.
(7) Persoana calificată trebuie să aibă experienţă
practică timp de cel puţin 2 ani în una sau mai multe unităţi autorizate pentru fabricarea medicamentelor, în activităţi
de analiză calitativă a medicamentelor şi de analiză cantitativă a substanţelor
active, precum şi alte teste şi verificări necesare pentru asigurarea calităţii
medicamentelor.
(8) Durata experienţei practice poate fi redusă cu un
an dacă studiile universitare durează cel puţin 5 ani, şi cu un an şi jumătate
dacă studiile universitare durează cel puţin 6 ani.
Art. 759. - (1) O persoană angajată în activităţile
persoanei la care se face referire în art. 757 de la momentul aplicării Directivei
75/319/CEE privind armonizarea prevederilor legale, reglementărilor şi
măsurilor administrative cu privire la medicamentele brevetate, într-un stat
membru al Uniunii Europene, fără a îndeplini prevederile art. 758 poate
continua acele activităţi în cadrul Uniunii Europene.
(2) Deţinătorul unei diplome, certificat sau altă
dovadă de calificare oficială acordată la terminarea unui curs universitar ori
a unui curs recunoscut ca echivalent de România într-o disciplină ştiinţifică
care îi permite să se angajeze în activităţile persoanei la care se face
referire în art. 757, conform legilor statului respectiv poate, dacă a început
cursul înainte de 21 mai 1975, să fie considerat ca şi calificat să efectueze
în acel stat sarcinile persoanei la care se face referire în art. 757, cu
condiţia ca aceasta să fi fost anterior angajată în activităţile următoare, cu
cel puţin 2 ani înainte de 21 mai 1985, în una sau mai multe unităţi autorizate
pentru fabricaţie: supravegherea producţiei şi/sau analiza calitativă şi
cantitativă a substanţelor active şi teste sau verificări necesare pentru
asigurarea calităţii medicamentelor sub directa autoritate a persoanei la care
se face referire în art. 757.
(3) Dacă persoana în cauză a dobândit experienţa
practică menţionată la alin. (2) înainte de 21 mai 1965, încă un an de
experienţă practică conform condiţiilor prevăzute la alin. (2) trebuie să fie
completat imediat înainte de a se angaja în astfel de activităţi.
Art. 760. - (1) Agenţia Naţională a Medicamentului ia
toate măsurile necesare pentru a se asigura că persoana calificată la care se
face referire în art. 757, fără a prejudicia relaţia cu deţinătorul
autorizaţiei de fabricaţie, este responsabilă, în contextul procedurilor
prevăzute la art. 761, pentru următoarele:
a) în cazul medicamentelor fabricate în România, că
fiecare serie de medicament a fost fabricată şi verificată în acord cu legile
în vigoare în România şi în acord cu cerinţele autorizaţiei de punere pe piaţă;
b) în cazul medicamentelor
provenind din ţări terţe, indiferent dacă medicamentul a fost fabricat în
Uniunea Europeană, că fiecare serie de produs a fost supusă într-un stat membru
unei analize calitative complete, unei analize cantitative cel puţin a tuturor
substanţelor active şi a oricăror alte teste sau verificări necesare pentru
asigurarea calităţii medicamentelor conform cerinţelor autorizaţiei de punere
pe piaţă.
Seriile de medicamente care au fost supuse unor astfel
de controale într-un stat membru vor fi exceptate de
la controale dacă sunt puse pe piaţă în România, însoţite de rapoartele de
control semnate de persoana calificată.
(2) In cazul medicamentelor importate dintr-o ţară
terţă, dacă au fost făcute aranjamente adecvate de către Uniunea Europeană cu
ţara exportatoare pentru asigurarea că fabricantul medicamentului aplică
standarde de bună practică de fabricaţie cel puţin echivalente cu cele
stabilite de Uniunea Europeană şi controalele menţionate la alin. (1) lit. b)
au fost efectuate în ţara exportatoare, persoana calificată poate fi absolvită de responsabilitatea de a
efectua aceste controale.
(3) In toate cazurile şi în special dacă medicamentele
sunt puse pe piaţă, persoana calificată trebuie să certifice într-un registru
sau într-un document echivalent destinat acestui scop că fiecare serie de
produs satisface prevederile prezentului articol; registrul sau documentul
echivalent trebuie actualizat permanent cu operaţiunile efectuate, trebuie să
fie la dispoziţia inspectorilor Agenţiei Naţionale a Medicamentului şi trebuie
să fie păstrat o perioadă de cel puţin 5 ani.
Art. 761. - (1) Agenţia Naţională a Medicamentului
asigură, prin mijloace administrative adecvate, respectarea de către persoanele
calificate la care se face referire în art. 757 a obligaţiilor ce le revin.
(2) Agenţia Naţională a Medicamentului dispune
suspendarea temporară a unei astfel de persoane la începerea procedurilor
administrative sau disciplinare împotriva sa pentru neîndeplinirea obligaţiilor
sale.
Art. 762. - Prevederile prezentului capitol se aplică şi medicamentelor homeopate.
CAPITOLUL V
Etichetare şi
prospect
Art. 763. - Pe ambalajul secundar al medicamentului
sau, în cazul în care nu există ambalaj secundar, pe ambalajul primar trebuie
să apară următoarele informaţii:
a) denumirea medicamentului urmată
de concentraţie şi de forma farmaceutică şi, dacă este cazul, precizarea dacă
este destinat sugarilor, copiilor ori adulţilor; dacă produsul conţine până la
3 substanţe active, va fi inclusă denumirea comună internaţională (DCI) sau,
dacă nu există, denumirea comună;
b) substanţele active exprimate calitativ şi
cantitativ pe unitate de doză sau în funcţie de forma de administrare pentru un
volum sau o greutate dat/dată, folosind denumirile lor comune;
c) forma farmaceutică şi conţinutul pe masă, volum sau
pe numărul de doze al medicamentului;
d) o listă cu excipienţii cunoscuţi ca având
activitate sau efect propriu şi incluşi în ghidul detaliat publicat ca urmare a
prevederilor art. 775; în cazul medicamentelor injectabile, topice sau de uz
oftalmic, toţi excipienţii trebuie declaraţi;
e) modul de administrare şi, dacă este cazul, calea de
administrare; se lasă spaţiu pentru indicarea dozei prescrise;
f) o atenţionare specială privind faptul că
medicamentul nu trebuie păstrat la îndemâna şi vederea copiilor;
g) o atenţionare specială, dacă este necesară, pentru
medicament, alta decât cea menţionată la lit. f);
h) data de expirare în termeni clari (lună/an);
i) condiţii speciale de păstrare, dacă este cazul;
j) precauţii speciale privind eliminarea medicamentelor
neutilizate sau a reziduurilor provenite din medicamente, dacă este cazul,
precum şi referinţe la orice sistem adecvat de colectare existent;
k) numele şi adresa deţinătorului autorizaţiei de
punere pe piaţă şi, unde este cazul, numele reprezentantului desemnat de
deţinător să îl reprezinte;
l) numărul autorizaţiei de
punere pe piaţă a medicamentului;
m) numărul seriei de fabricaţie;
n) în cazul medicamentelor care se eliberează fără
prescripţie medicală, instrucţiunile de utilizare.
Art. 764. - (1) Informaţiile prevăzute la art. 763, cu
excepţia celor prevăzute la alin. (2) şi (3) ale prezentului articol, trebuie
să fie înscrise pe ambalajele primare.
(2) Cel puţin următoarele informaţii trebuie să apară
pe blisterele introduse într-un ambalaj secundar care corespunde cerinţelor
prevăzute la art. 763 şi 772:
- denumirea medicamentului conform art. 763 lit. a);
- numele deţinătorului autorizaţiei de punere pe
piaţă;
- data de expirare;
- numărul seriei de fabricaţie.
(3) Cel puţin următoarele informaţii trebuie să apară
pe ambalajele primare de mici dimensiuni, pe care informaţiile prevăzute la
art. 763 şi 772 nu pot fi prezentate:
- denumirea medicamentului conform art. 763 lit. a)
şi, dacă este necesar, calea de administrare;
- modul de administrare;
- data de expirare;
- numărul seriei de fabricaţie;
- conţinutul raportat la masă, volum sau la unitatea
de doză.
Art. 765. - Informaţiile prevăzute la art. 763, 764 şi
772 trebuie astfel inscripţionate încât să fie uşor de citit, clare şi să nu
poată fi şterse.
Art. 766. - (1) Denumirea medicamentului, conform art.
763 lit. a), trebuie inscripţionată pe ambalaj şi în format Braille.
(2) Deţinătorul autorizaţiei de punere pe piaţă trebuie
să se asigure că informaţiile din prospect sunt disponibile, la cererea
organizaţiilor pacienţilor, în formate adecvate pentru nevăzători şi pentru cei
cu deficit de vedere.
Art. 767. - (1) Cu respectarea prevederilor art. 770,
Agenţia Naţională a Medicamentului cere utilizarea unor
forme de etichetare a medicamentului care permit indicarea:
- statutului legal pentru eliberare către pacient,
conform prevederilor cap. VI;
- elementelor de identificare şi autentificare.
(2) Pentru medicamentele autorizate prin procedura
centralizată, în vederea aplicării prevederilor
prezentului articol, Agenţia Naţională a Medicamentului trebuie să aplice
ghidul detaliat la care se face referire în art. 775.
Art. 768. - Includerea în ambalajul tuturor
medicamentelor a unui prospect este obligatorie, cu
excepţia cazului în care toate informaţiile prevăzute la art. 769 şi 772 sunt
direct inscripţionate pe ambalajul secundar sau primar.
Art. 769. - (1) Prospectul este întocmit în acord cu
rezumatul caracteristicilor produsului şi include o serie de informaţii, în
următoarea ordine:
a) pentru identificarea medicamentului:
(i) denumirea medicamentului urmată de concentraţia şi
forma farmaceutică şi, dacă este cazul, menţiunea dacă este destinat sugarilor,
copiilor sau adulţilor; denumirea comună este inclusă dacă medicamentul conţine
o singură substanţă activă şi dacă denumirea este inventată;
(ii) grupa farmacoterapeutică sau tipul de activitate
farmacoterapeutică în termeni uşor de înţeles pentru pacient;
b) indicaţiile terapeutice;
c) o enumerare a
informaţiilor care sunt necesare înainte de administrarea medicamentului:
(i) contraindicaţii;
(ii) precauţii privind administrarea produsului;
(iii) interacţiuni cu alte medicamente sau alte
forme de interacţiuni (de exemplu: alcool, tutun, alimente) care pot influenţa acţiunea medicamentului;
(iv) atenţionări speciale;
d) instrucţiuni necesare şi uzuale pentru utilizarea
corectă a medicamentului, în special:
(i) doza recomandată;
(ii) modul şi, dacă este cazul, calea de administrare;
(iii) frecvenţa administrării, specificându-se, dacă este cazul, momentul potrivit la care medicamentul
poate sau trebuie să fie administrat;
şi, dacă este cazul, în funcţie de natura medicamentului:
(iv) durata tratamentului, dacă aceasta trebuie să
fie limitată;
(v) măsurile care trebuie luate în cazul unei supradoze (precum evaluarea simptomelor, proceduri de urgenţă);
(vi) măsurile care trebuie luate în cazul în care
una sau mai multe doze nu au fost administrate;
(vii) precauţii, dacă este
cazul, privind riscurile întreruperii tratamentului;
(viii) o recomandare specială de a consulta medicul
sau farmacistul, după caz, pentru orice clarificare a utilizării medicamentului;
e) o descriere a reacţiiilor adverse care pot să apară
în timpul utilizării normale a medicamentului şi, dacă este cazul, măsurile
care trebuie luate; pacientul este invitat în mod expres să comunice medicului
sau farmacistului orice reacţie adversă apărută, care nu este menţionată în
prospect;
f) o referire la data de
expirare înscrisă pe ambalaj, cu:
(i) o atenţionare privind utilizarea medicamentului
numai până la data de expirare;
(ii) precauţii speciale de păstrare, dacă este
cazul;
(iii) o atenţionare referitoare la modificările care
pot fi constatate de utilizator în situaţia deteriorării vizibile a produsului,
dacă este cazul;
(iv) compoziţia calitativă completă (substanţe active
şi excipienţi) şi compoziţia cantitativă în substanţe active, folosindu-se
denumiri comune, pentru fiecare formă de prezentare a
medicamentului;
(v) pentru fiecare formă de prezentare a produsului,
forma farmaceutică şi conţinutul în masă, volum sau unităţi de doză;
(vi) numele şi adresa deţinătorului autorizaţiei de
punere pe piaţă şi, unde este cazul, numele reprezentanţilor desemnaţi în
România;
(vii) numele şi adresa fabricantului;
g) în cazul în care medicamentul este autorizat
conform art. 736-747 sub denumiri diferite în statele membre interesate, o
listă a denumirilor autorizate în fiecare stat membru al Uniunii Europene;
h) data ultimei revizuiri a prospectului. (2)
Enumerarea stabilită la alin. (1) lit. c):
a) trebuie să ia în considerare situaţia particulară
a anumitor categorii de utilizatori (copii, femei gravide sau lăuze, bătrâni,
persoane cu condiţii patologice specifice);
b) trebuie să menţioneze, dacă este cazul, posibile
efecte asupra capacităţii de a conduce vehicule sau de a folosi utilaje;
c) trebuie să prevadă acei excipienţi a căror
cunoaştere este necesară pentru utilizarea eficientă şi în siguranţă a
medicamentului şi care sunt incluşi în ghidul detaliat publicat conform
prevederilor art. 775.
(3) Prospectul reflectă rezultatele consultărilor cu
grupuri-ţintă de pacienţi pentru a se asigura că este lizibil, clar şi uşor de
folosit.
Art. 770. - Agenţia Naţională a
Medicamentului nu poate interzice sau împiedica punerea pe piaţă a
medicamentelor pe teritoriul României pe motive legate de etichetare ori
prospect, dacă acestea corespund prevederilor prezentului capitol.
Art. 771. - (1) Odată cu
depunerea cererii pentru autorizarea de punere pe piaţă trebuie depuse la
Agenţia Naţională a Medicamentului una sau mai multe machete ale ambalajului
secundar şi ale ambalajului primar ale medicamentului, împreună cu proiectul
prospectului; rezultatele evaluărilor efectuate în cooperare cu grupul de
pacienţi-ţintă sunt, de asemenea, furnizate Agenţiei Naţionale a
Medicamentului.
(2) Agenţia Naţională a Medicamentului refuză
autorizarea de punere pe piaţă dacă etichetarea sau prospectul nu corespunde
prevederilor prezentului capitol sau nu corespunde informaţiilor enumerate în
rezumatul caracteristicilor produsului.
(3) Toate propunerile de modificare a etichetării sau
a prospectului prevăzute în prezentul capitol, care nu au legătură cu rezumatul
caracteristicilor produsului, sunt depuse la Agenţia Naţională a
Medicamentului; dacă Agenţia Naţională a Medicamentului nu s-a opus unei
propuneri de modificare în termen de 90 de zile de la depunerea cererii,
solicitantul poate opera modificarea.
(4) Faptul că Agenţia
Naţională a Medicamentului nu refuză o autorizare de punere pe piaţă în
situaţia descrisă la alin. (2) sau o modificare a etichetării conform alin. (3)
nu diminuează responsabilitatea generală a fabricantului şi a deţinătorului
autorizaţiei de punere pe piaţă.
Art. 772. - Ambalajul secundar şi ambalajul primar pot
include simboluri sau pictograme concepute pentru a clarifica anumite
informaţii menţionate la art. 763 şi la art. 769 alin. (1) şi alte informaţii
compatibile cu rezumatul caracteristicilor produsului care sunt utile pentru
pacient, cu excluderea oricărui element de natură publicitară.
Art. 773. - (1) Informaţiile conţinute în etichetare,
prevăzute la art. 763, 769 şi 772, trebuie să fie în limba română, ceea ce nu
împiedică inscripţionarea acestor informaţii în mai multe limbi, cu condiţia ca
în toate limbile folosite să apară aceleaşi informaţii.
In cazul anumitor medicamente orfane, informaţiile
enumerate la art. 763 pot, la o cerere justificată, să apară numai în una
dintre limbile oficiale ale Uniunii Europene.
(2) Prospectul trebuie să fie scris şi conceput spre
a fi clar şi uşor de înţeles, permiţând utilizatorilor să acţioneze
corespunzător, când este cazul, cu ajutorul profesioniştilor din domeniul
sănătăţii; prospectul trebuie să fie clar lizibil în limba română.
Prevederile primei teze nu împiedică prospectul să fie
inscripţionat în mai multe limbi, cu condiţia ca în toate limbile folosite să
apară aceleaşi informaţii.
(3) Dacă medicamentul nu este destinat eliberării directe
către pacient, Agenţia Naţională a Medicamentului poate acorda exceptarea de la
obligaţia prezenţei anumitor informaţii pe etichetă şi în prospect şi de la
obligaţia ca prospectul să fie în limba română.
Art. 774. - Dacă prevederile prezentului capitol nu
sunt respectate de deţinătorul autorizaţiei de punere pe piaţă şi notificarea
adresată de către Agenţia Naţională a Medicamentului acestuia a rămas fără
efect, Agenţia Naţională a Medicamentului poate suspenda autorizaţia de punere
pe piaţă până când etichetarea şi prospectul medicamentului în cauză se
conformează cerinţelor prezentului capitol.
Art. 775. - Agenţia Naţională a Medicamentului
participă la consultări organizate de Comisia Europeană cu statele membre ale
Uniunii Europene şi cu părţile interesate, în vederea
întocmirii unui ghid detaliat, privind în special:
a) formularea unor atenţionări speciale pentru
anumite categorii de medicamente;
b) informaţii speciale pentru medicamentele care se
eliberează fără prescripţie medicală;
c) lizibilitatea
informaţiilor de pe etichetă şi prospect;
d) metodele de identificare şi autentificare a
medicamentelor;
e) lista excipienţilor care trebuie să apară pe
eticheta medicamentului şi modul în care aceşti excipienţi trebuie să fie
indicaţi;
f) prevederile armonizate pentru implementarea art. 57
din Directiva 2001/83/CE.
Agenţia Naţională a Medicamentului aplică prevederile
acestui ghid detaliat.
Art. 776. - (1) Ambalajul secundar de carton şi
recipientul medicamentelor conţinând radionuclizi trebuie să fie etichetate
conform reglementărilor pentru transportul în siguranţă al materialelor
radioactive stabilite de Agenţia Internaţională pentru Energie Atomică; în
plus, eticheta trebuie să corespundă şi prevederilor alin. (2) şi (3).
(2) Eticheta de pe ecranul
protector trebuie să includă informaţiile menţionate la art. 763; în plus,
eticheta de pe ecranul protector trebuie să explice în amănunt codificările
utilizate pe flacon şi să indice, unde este cazul, pentru un moment şi o dată
anume, cantitatea de radioactivitate pe doză sau pe flacon şi numărul de
capsule sau, pentru lichide, numărul de mililitri din recipient.
(3) Flaconul este etichetat cu următoarele informaţii:
- numele sau codul medicamentului, inclusiv numele sau
simbolul chimic al radionuclidului;
- numărul de identificare al seriei şi data de
expirare;
- simbolul internaţional pentru radioactivitate;
- numele şi adresa fabricantului;
- cantitatea de radioactivitate conform prevederilor
alin. (2). Art. 777. - (1) Agenţia Naţională a Medicamentului trebuie să se asigure că în ambalajul
medicamentelor radiofarmaceutice, generatorilor de radionuclizi, kiturilor
(truselor) sau precursorilor radionuclidici este introdus un prospect amănunţit
incluzând instrucţiunile de utilizare.
(2) Textul prospectului menţionat la alin. (1) trebuie
să fie elaborat conform prevederilor art. 769; în plus, prospectul trebuie să
includă orice alte precauţii care trebuie luate de utilizator în timpul
preparării şi administrării medicamentului şi precauţii speciale pentru
eliminarea ambalajului şi a conţinutului neutilizat.
Art. 778. - Fără a contraveni prevederilor art. 779,
medicamentele homeopate trebuie să fie etichetate în acord cu prevederile
prezentului capitol şi să conţină o menţiune pe etichetă asupra naturii lor
homeopate, într-o formă clară şi lizibilă.
Art. 779. - In plus faţă de menţiunea clară a
cuvintelor „medicament homeopat", eticheta şi, unde este cazul, prospectul
pentru medicamentele prevăzute la art. 711 alin. (1) poartă exclusiv următoarele
informaţii:
- denumirea ştiinţifică a suşei sau a suşelor urmată
de gradul de diluţie, folosindu-se simbolurile farmacopeii utilizate conform
art. 695 pct. 4; dacă medicamentul homeopat este alcătuit din două sau mai
multe suşe, denumirea ştiinţifică a suşelor pe etichetă poate fi suplimentată
cu o denumire inventată;
- numele şi adresa deţinătorului autorizaţiei de
punere pe piaţă şi, după caz, numele fabricantului;
- modul de administrare şi, dacă este cazul, calea de
administrare;
- data de expirare, în termeni
clari (lună, an);
- forma farmaceutică;
- conţinutul formei de prezentare destinate vânzării;
- precauţii speciale de păstrare, dacă există;
- o atenţionare specială, dacă este necesară;
- numărul seriei de fabricaţie;
- numărul autorizaţiei de punere pe piaţă;
- „medicament homeopat fără indicaţii terapeutice
aprobate";
- o atenţionare care îl sfătuieşte pe utilizator să
consulte un medic dacă simptomele persistă.
CAPITOLUL VI
Clasificarea medicamentelor
Art. 780. - (1) La eliberarea
autorizaţiilor de punere pe piaţă, Agenţia Naţională a Medicamentului specifică
clasificarea medicamentelor în:
- medicamente care se eliberează cu prescripţie
medicală;
- medicamente care se eliberează fără prescripţie
medicală.
In acest scop, se aplică
criteriile prevăzute la art. 781 alin. (1).
(2) Agenţia Naţională a Medicamentului stabileşte
subcategorii pentru medicamentele eliberate numai cu prescripţie medicală, după
cum urmează:
a) medicamente care se eliberează cu prescripţie
medicală care se reţine în farmacie (nu se reînnoieşte) sau care nu se reţine
în farmacie (se poate reînnoi);
b) medicamente care se eliberează cu prescripţie
medicală specială;
c) medicamente care se eliberează cu prescripţie
medicală restrictivă, rezervate pentru utilizarea în
anumite domenii specializate.
Art. 781. - (1) Medicamentele se eliberează cu
prescripţie medicală dacă:
- prezintă un pericol direct ori indirect, chiar în
cazul utilizării corecte, dacă sunt folosite fără supraveghere medicală; sau
- sunt utilizate frecvent şi în mare măsură incorect
şi ca atare pot prezenta un pericol direct ori indirect pentru sănătatea umană;
sau
- conţin substanţe ori preparate ale acestora ale
căror activitate şi/sau reacţii adverse necesită investigaţii aprofundate; sau
- sunt prescrise în mod normal de medic pentru a fi
administrate parenteral.
(2) La stabilirea subcategoriilor se iau în
considerare următorii factori:
- medicamentul conţine, într-o cantitate care nu este
exceptată, o substanţă clasificată ca stupefiant sau psihotrop în înţelesul
convenţiilor internaţionale în vigoare, precum convenţiile Naţiunilor Unite din
1961 şi 1974; sau
- medicamentul poate, dacă este utilizat incorect, să
prezinte un risc de abuz medicamentos, să conducă la dependenţă ori să fie
utilizat în scopuri ilegale; sau
- medicamentul conţine o substanţă care, prin noutate
sau prin proprietăţile specifice, ca măsură de precauţie, poate fi considerată
că aparţine grupului prevăzut la punctul anterior.
(3) La stabilirea
subcategoriilor pentru medicamentele supuse prescrierii restrictive se iau în
considerare următorii factori:
- medicamentul, datorită caracteristicilor sale
farmaceutice sau noutăţii sale ori intereselor pentru sănătatea publică, poate
fi utilizat numai în spital;
- medicamentul este utilizat în tratamentul bolilor
care trebuie să fie diagnosticate în spital sau în instituţii care deţin
echipamente de diagnosticare adecvate, chiar dacă administrarea şi continuarea
tratamentului pot fi efectuate în altă parte; sau
- medicamentul este destinat utilizării în
ambulatoriu, dar utilizarea sa poate provoca reacţii adverse grave necesitând o
prescripţie medicală întocmită de un specialist şi o supraveghere specială de-a
lungul tratamentului.
(4) Agenţia Naţională a
Medicamentului poate renunţa la aplicarea alin. (1), (2) şi (3) ţinând cont de:
a) doza unică maximă, doza maximă zilnică,
concentraţia, forma farmaceutică, anumite tipuri de ambalaje; şi/sau
b) alte circumstanţe de utilizare specificate.
(5) Dacă Agenţia Naţională a Medicamentului nu
desemnează medicamente în subcategoriile menţionate la art. 780 alin. (2),
trebuie să ia în considerare criteriile prevăzute la alin. (2) şi (3) pentru a
stabili dacă un medicament este clasificat ca medicament eliberat numai cu
prescripţie medicală.
Art. 782. - Medicamentele care se eliberează fără
prescripţie medicală sunt acelea care nu se încadrează în criteriile stabilite
la art. 781.
Art. 783. - (1) Agenţia Naţională a Medicamentului
întocmeşte o listă a medicamentelor care se eliberează cu prescripţie medicală
pe teritoriul României specificând, dacă este cazul, categoria clasificării;
această listă se actualizează anual.
(2) Agenţia Naţională a Medicamentului elaborează anual
Nomenclatorul cuprinzând medicamentele autorizate de punere pe piaţă în
România, precizând pentru fiecare medicament clasificarea pentru eliberare.
Art. 784. - Agenţia Naţională a Medicamentului
analizează orice aspecte noi care îi sunt aduse la cunoştinţă şi, după caz,
modifică clasificarea unui medicament prin aplicarea criteriilor enumerate la
art. 781.
Art. 785. - Dacă a fost autorizată o schimbare a
clasificării unui medicament pe baza unor teste preclinice sau studii clinice
semnificative, Agenţia Naţională a Medicamentului nu trebuie să se refere la
rezultatele acestor teste sau studii în cazul evaluării unei cereri depuse de
către alt solicitant sau deţinător al autorizaţiei de punere pe piaţă pentru
schimbarea clasificării aceleiaşi substanţe, timp de un an de la autorizarea
modificării iniţiale.
Art. 786. - Anual, Agenţia Naţională a Medicamentului
comunică Comisiei Europene şi celorlalte state membre ale Uniunii Europene
schimbările ce au fost făcute în lista la care se face referire în art. 783.
CAPITOLUL VII
Distribuţia angro a
medicamentelor
Art. 787. - (1) Cu respectarea prevederilor art. 700,
Ministerul Sănătăţii Publice ia toate măsurile corespunzătoare pentru a se
asigura că numai medicamentele pentru care a fost acordată o autorizaţie de
punere pe piaţă conform prevederilor prezentului titlu
sunt distribuite pe teritoriul României.
(2) Cu respectarea prevederilor art. 700, Ministerul
Sănătăţii Publice ia toate măsurile corespunzătoare pentru a se asigura că
numai medicamentele pentru care a fost acordată o autorizaţie de punere pe
piaţă conform prevederilor
prezentului titlu şi prin procedura centralizată sunt distribuite pe teritoriul
României.
(3) Distribuţia angro şi depozitarea medicamentelor
se efectuează numai pentru medicamente care au autorizaţii de punere pe piaţă
eliberate:
a) de Comisia Europeană, conform procedurii
centralizate; sau
b) de Agenţia Naţională a Medicamentului, conform
prevederilor prezentului titlu.
(4) Orice distribuitor care nu este deţinătorul
autorizaţiei de punere pe piaţă şi care importă un medicament dintr-un stat
membru al Uniunii Europene trebuie să notifice intenţia sa deţinătorului
autorizaţiei de punere pe piaţă şi Agenţiei Naţionale a Medicamentului; pentru
medicamentele care nu au fost autorizate prin procedura centralizată,
notificarea Agenţiei Naţionale a Medicamentului se face fără a contraveni
procedurilor suplimentare prevăzute în legislaţia din România.
Art. 788. - (1) Ministerul Sănătăţii Publice ia toate
măsurile necesare pentru a se asigura că distribuţia angro de medicamente se
face de către posesorii unei autorizaţii pentru desfăşurarea activităţii de
distribuitor angro de medicamente, care precizează sediul pentru care este
valabilă.
(2) Dacă persoanele autorizate să elibereze medicamentele
către populaţie pot, conform legislaţiei naţionale, să se angajeze şi în
distribuţie angro, aceste persoane trebuie să fie autorizate conform alin. (1).
(3) Deţinerea unei autorizaţii de fabricaţie include
şi autorizarea pentru distribuţia angro a medicamentelor acoperite de acea
autorizaţie; deţinerea unei autorizaţii pentru desfăşurarea activităţii de
distribuţie angro de medicamente nu exceptează deţinătorul de la obligaţia de a
deţine o autorizaţie de fabricaţie şi de a se supune condiţiilor stabilite în
acest sens, chiar dacă activitatea de fabricaţie sau de import este secundară.
(4) La cererea Comisiei Europene sau a unui stat
membru al Uniunii Europene, Ministerul Sănătăţii Publice trebuie să furnizeze
toate informaţiile adecvate privind autorizaţiile individuale
pe care Ie-a eliberat conform alin. (1).
(5) Verificările persoanelor autorizate pentru
desfăşurarea activităţii de distribuţie angro de medicamente şi inspecţia
spaţiilor lor se efectuează sub responsabilitatea Ministerului Sănătăţii Publice.
(6) Ministerul Sănătăţii Publice suspendă sau retrage
autorizaţia prevăzută la alin. (1) dacă nu mai sunt îndeplinite condiţiile de
autorizare; Ministerul Sănătăţii Publice informează despre aceasta statele
membre ale Uniunii Europene şi Comisia Europeană.
(7) Dacă Ministerul Sănătăţii Publice consideră că
deţinătorul unei autorizaţii acordate de un stat membru al Uniunii Europene
conform prevederilor art. 77 alin. (1) din Directiva 2001/83/CE nu mai
îndeplineşte condiţiile de autorizare, informează despre aceasta Comisia
Europeană şi statul membru implicat; acesta din urmă ia toate măsurile necesare
şi informează Comisia Europeană şi Ministerul Sănătăţii Publice asupra
deciziilor luate şi a motivelor care stau la baza acestor decizii.
(8) Ministerul Sănătăţii
Publice, prin inspectorii direcţiei de specialitate, inspectează şi unităţile
de distribuţie en detail.
(9) Inspectorii direcţiei de specialitate din
Ministerul Sănătăţii Publice şi inspectorii Agenţiei Naţionale a Medicamentului
pot preleva probe de la unităţile de distribuţie în vederea efectuării de
analize de laborator.
(10) Contravaloarea probelor prelevate şi costul
analizelor efectuate se suportă conform art. 823 alin. (1) lit. b).
Art. 789. - (1) Ministerul Sănătăţii Publice se asigură
că timpul necesar pentru desfăşurarea procedurii de examinare a cererilor pentru autorizarea de distribuţie nu
depăşeşte 90 de zile de la data primirii cererii de către acesta.
(2) Ministerul Sănătăţii Publice poate cere
solicitantului, dacă este necesar, să furnizeze toate informaţiile privind
condiţiile de autorizare.
(3) Dacă Ministerul Sănătăţii Publice constată că nu
sunt furnizate toate informaţiile conform alin. (2), perioada prevăzută la
alin. (1) este suspendată până când datele cerute vor fi
furnizate.
Art. 790. - Pentru a obţine o autorizaţie de
distribuţie, solicitanţii trebuie să îndeplinească următoarele cerinţe minime:
a) trebuie să aibă spaţii, instalaţii şi echipamente
potrivite şi adecvate pentru asigurarea conservării şi distribuţiei medicamentelor;
b) trebuie să aibă personal şi, în particular, o
persoană calificată desemnată ca responsabil, îndeplinind condiţiile prevăzute
în legislaţia din România;
c) trebuie să poată îndeplini obligaţiile prevăzute
la art. 791.
Art. 791. - Deţinătorii
autorizaţiei de distribuţie trebuie să îndeplinească următoarele cerinţe
minime:
a) să permită accesul la spaţiile, instalaţiile şi
echipamentele prevăzute la art. 790 lit. a) persoanelor responsabile cu
inspecţia acestora;
b) să îşi constituie stocurile de medicamente numai de
la persoane care, la rândul lor, deţin o autorizaţie de distribuţie sau sunt
exceptate de la obţinerea unei astfel de autorizaţii conform prevederilor art.
788 alin. (3);
c) să furnizeze medicamentele numai persoanelor care,
la rândul lor, deţin o autorizaţie de distribuţie angro sau sunt autorizate de
Ministerul Sănătăţii Publice să furnizeze medicamente către populaţie în
România;
d) să aibă un plan de urgenţă care să asigure
implementarea efectivă a oricărei retrageri de pe piaţa ordonată de Agenţia
Naţională a Medicamentului sau efectuată în cooperare cu fabricantul ori cu
deţinătorul autorizaţiei de punere pe piaţă pentru medicamentul în cauză;
e) să păstreze evidenţa fie în forma facturilor de
vânzare/cumpărare, fie pe calculator, fie în orice formă, consemnând pentru
orice tranzacţie următoarele informaţii:
- data operaţiunii efectuate;
- denumirea medicamentului, numele şi ţara de origine
ale fabricantului;
- modul de prezentare, forma farmaceutică,
concentraţia substanţelor active, mărimea ambalajului;
- seria şi data expirării;
- certificatul de calitate şi/sau buletinul de
analiză, după caz;
- cantitatea primită sau furnizată;
- numele şi adresa furnizorului sau ale
destinatarului, după caz;
f) să ţină la dispoziţia
Ministerului Sănătăţii Publice evidenţa prevăzută la lit. e), în scopul
inspecţiilor, pentru o perioadă de 5 ani;
g) să respecte principiile şi ghidurile de bună
practică de distribuţie pentru medicamente, conform prevederilor art. 795.
Art. 792. - (1) In ceea ce priveşte furnizarea de
medicamente către farmacişti şi persoanele autorizate să elibereze medicamente
către populaţie, Ministerul Sănătăţii Publice nu trebuie să aplice unui
deţinător de autorizaţie de distribuţie acordată de alt stat membru al Uniunii
Europene nici o obligaţie, în special obligaţii de serviciu public, mai
restrictivă decât cele aplicate persoanelor autorizate să efectueze activităţi
echivalente în România.
(2) Deţinătorul unei autorizaţii de punere pe piaţă
pentru un medicament şi distribuitorii acelui medicament pus efectiv pe piaţă
în România asigură, în limitele responsabilităţilor lor, stocuri adecvate şi
continue din acel medicament către farmacii şi persoanele autorizate să
furnizeze medicamente, astfel încât nevoile pacienţilor din România să fie
acoperite.
(3) Măsurile pentru implementarea prevederilor
prezentului articol trebuie să fie justificate prin protecţia sănătăţii publice
şi să fie proporţionale cu obiectivele acestei protecţii, conform regulilor
Tratatului Uniunii Europene, în special cele privind libera circulaţie a
mărfurilor şi concurenţa.
Art. 793. - (1) Pentru toate furnizările de medicamente
către o persoană autorizată să furnizeze medicamente către populaţie în
România, distribuitorul angro autorizat trebuie să emită un document însoţitor
care indică:
- data;
- numele şi forma farmaceutică ale medicamentului;
- cantitatea furnizată;
- numele şi adresa furnizorului şi destinatarului.
(2) Ministerul Sănătăţii Publice ia toate măsurile
necesare pentru a se asigura că persoanele autorizate să furnizeze medicamente
către populaţie pot furniza informaţiile necesare pentru trasabilitatea căii de
distribuţie a fiecărui medicament.
Art. 794. - Prevederile prezentului capitol nu împiedică aplicarea unor cerinţe mai restrictive în legătură cu
distribuţia angro de:
- substanţe stupefiante şi psihotrope pe teritoriul
României;
- medicamente derivate din sânge;
- medicamente imunologice;
- medicamente radiofarmaceutice.
Art. 795. - Ministerul
Sănătăţii Publice are obligaţia de a urmări aplicarea ghidurilor de bună
practică de distribuţie publicate de Comisia Europeană.
Art. 796. - Prezentul capitol se aplică şi pentru
medicamentele homeopate.
CAPITOLUL VIII
Publicitatea
Art. 797. - (1) In înţelesul
prezentului capitol, publicitatea pentru medicamente
include orice mod de informare prin contact direct
(sistemul „door-to-door"), precum şi orice formă de promovare destinată să
stimuleze prescrierea, distribuirea, vânzarea sau consumul de medicamente; publicitatea pentru medicamente va include în special:
- publicitatea pentru medicamente destinată
publicului larg;
- publicitatea pentru medicamente destinată
persoanelor calificate să prescrie sau să distribuie medicamente;
- vizite ale reprezentanţilor
medicali la persoane calificate să prescrie medicamente;
- furnizarea de mostre;
- stimularea prescrierii sau distribuirii
medicamentelor prin oferirea, promiterea ori acordarea unor avantaje în bani
sau în natură, cu excepţia cazurilor în care acestea au o valoare simbolică;
- sponsorizarea întâlnirilor promoţionale la care
participă persoane calificate să prescrie sau să distribuie medicamente;
- sponsorizarea congreselor ştiinţifice la care
participă persoane calificate să prescrie sau să distribuie medicamente şi, în
special, plata cheltuielilor de transport şi cazare ocazionate de acestea.
(2) Nu fac obiectul prezentului capitol următoarele:
- etichetarea şi prospectul, care fac obiectul cap. V;
- corespondenţa, posibil însoţită de materiale de
natură nonpromoţională, necesare pentru a răspunde unei întrebări specifice în
legătură cu un anumit medicament;
- anunţuri cu caracter informativ şi materiale
referitoare, de exemplu, la modificări ale ambalajului, atenţionări despre
reacţii adverse care fac parte din precauţiile generale de administrare a
medicamentului, cataloage comerciale şi liste de preţuri, cu condiţia ca
acestea să nu includă nici un fel de afirmaţii cu caracter promoţional;
- informaţii privind sănătatea umană sau boli, cu
condiţia să nu existe referinţe, chiar indirecte, la medicamente.
Art. 798. - (1) Agenţia Naţională a Medicamentului
interzice publicitatea pentru un medicament care nu are autorizaţie de punere
pe piaţă valabilă în România.
(2) Toate informaţiile
conţinute în materialul publicitar pentru un medicament trebuie să corespundă
cu informaţiile enumerate în rezumatul caracteristicilor produsului.
(3) Publicitatea pentru un medicament:
- trebuie să încurajeze utilizarea raţională a
medicamentului, prin prezentarea lui obiectivă şi fără a-i exagera
proprietăţile;
- nu trebuie să fie înşelătoare.
Art. 799. - (1) Este interzisă publicitatea destinată
publicului larg pentru medicamente care:
a) se eliberează numai cu prescripţie, medicală, conform cap. VI;
b) conţin substanţe definite ca stupefiante sau
psihotrope de convenţii internaţionale, precum convenţiile Naţiunilor Unite
din 1961 şi 1971, şi legislaţia naţională.
(2) Este permisă publicitatea destinată publicului
larg doar pentru acele medicamente care, prin compoziţie şi scop, sunt
destinate a fi utilizate fără intervenţia unui medic, în scopul stabilirii
diagnosticului, prescrierii acestora sau pentru monitorizarea tratamentului,
fiind suficiente, la nevoie, sfaturile farmaciştilor.
(3) Este interzisă pe teritoriul României
publicitatea destinată publicului larg pentru medicamentele prescrise şi
eliberate în sistemul asigurărilor de sănătate.
(4) Interdicţia prevăzută la alin. (1) nu se aplică
campaniilor de vaccinare efectuate de industria farmaceutică şi aprobate de
Ministerul Sănătăţii Publice.
(5) Interdicţia la care se face referire la alin. (1)
se aplică fără a contraveni prevederilor din legislaţia naţională, Legii nr.
148/2000 privind publicitatea, cu modificările şi completările ulterioare, care
transpun art. 14 al Directivei 89/552/CEE privind coordonarea anumitor
prevederi stabilite prin legi, regulamente sau acţiuni administrative în
statele membre în cauză, referitoare la îndeletnicirea cu activităţi de transmitere TV.
(6) Este interzisă distribuţia directă a
medicamentelor către populaţie de către fabricanţi în scopuri promoţionale.
CAPITOLUL IX
Informarea publicului
Art. 800. - (1) Cu respectarea prevederilor art. 799,
orice material publicitar destinat publicului larg:
a) trebuie să fie conceput astfel încât să fie clar că
mesajul este de natură publicitară şi că produsul este clar identificat ca
medicament;
b) trebuie să includă cel puţin următoarele
informaţii:
- denumirea medicamentului, precum şi denumirea
comună dacă medicamentul conţine o singură substanţă activă;
- informaţiile necesare pentru utilizarea corectă a
medicamentului;
- o invitaţie expresă, lizibilă, de a citi cu atenţie
instrucţiunile din prospect sau de pe ambalaj, formulată după cum urmează:
„Acest medicament se poate elibera fără prescripţie medicală. Se recomandă
citirea cu atenţie a prospectului sau a informaţiilor de pe ambalaj. Dacă apar
manifestări neplăcute, adresaţi-vă medicului sau farmacistului."
(2) In cazul în care este vorba
despre o reclamă prescurtată (reminder) se acceptă ca publicitatea pentru
medicamente destinată publicului larg, prin excepţie de la prevederile alin.
(1), să includă numai denumirea medicamentului sau denumirea comună
internaţională, dacă aceasta există, ori marca medicamentului.
Art. 801. - Publicitatea pentru medicamente destinată
publicului larg nu trebuie să conţină nici un material care:
a) să dea impresia că o consultaţie medicală sau o
intervenţie chirurgicală nu este necesară, în special prin oferirea unor
sugestii de diagnostic sau de tratament la distanţă;
b) să sugereze că efectul tratamentului cu
medicamentul respectiv este garantat, nu este însoţit de reacţii adverse sau că
efectul este mai bun ori echivalent cu cel al altui tratament
sau medicament;
c) să sugereze că starea de sănătate a subiectului
poate fi îmbunătăţită prin utilizarea medicamentului respectiv;
d) să sugereze că starea de sănătate a subiectului
poate fi afectată dacă nu se utilizează medicamentul; această interdicţie nu se
aplică campaniilor de vaccinare prevăzute la art. 799 alin. (4);
e) să se adreseze exclusiv sau în special copiilor;
f) să facă referire la o recomandare a oamenilor de
ştiinţă, profesioniştilor din domeniul sănătăţii sau persoanelor care nu fac
parte din aceste categorii, dar a căror celebritate poate încuraja consumul de
medicamente;
g) să sugereze că medicamentul este un aliment,
produs cosmetic sau alt produs de consum;
h) să sugereze că siguranţa sau eficacitatea
medicamentului este datorată faptului că acesta este natural;
i) să poată, printr-o descriere sau reprezentare
detaliată a unui caz, să ducă la o autodiagnosticare eronată;
j) să ofere, în termeni inadecvati, alarmanţi sau
înşelători, asigurări privind vindecarea;
k) să folosească, în termeni inadecvati, alarmanţi sau
înşelători, reprezentări vizuale ale schimbărilor în organismul uman cauzate de
boli sau leziuni ori de acţiuni ale medicamentelor asupra organismului uman sau
a unei părţi a acestuia.
Art. 802. - (1) Orice material
publicitar pentru un medicament destinat persoanelor calificate să prescrie sau
să elibereze astfel de produse trebuie să includă:
- informaţii esenţiale compatibile cu rezumatul
caracteristicilor produsului;
- clasificarea pentru eliberare a medicamentului.
(2) In cazul în care este vorba despre o reclamă
prescurtată (reminder), publicitatea pentru un medicament destinată persoanelor
calificate să prescrie sau să elibereze astfel de produse poate, prin excepţie
de la prevederile alin. (1),
să includă numai denumirea medicamentului sau denumirea comună internaţională,
dacă aceasta există, ori marca.
Art. 803. - (1) Orice documentaţie referitoare la un
medicament care este transmisă ca parte a promovării acelui produs persoanelor
calificate să îl prescrie sau să îl elibereze include cel puţin informaţiile
prevăzute la art. 802 alin. (1) şi precizează data la care a fost întocmit sau revizuit
ultima dată.
(2) Toate informaţiile conţinute în documentaţia
menţionată la alin. (1) trebuie să fie corecte, actualizate, verificabile şi
suficient de complete pentru a permite beneficiarului să îşi formeze propria
opinie asupra valorii terapeutice a medicamentului în cauză.
(3) Citatele, precum şi tabelele şi alte materiale
ilustrative extrase din publicaţiile medicale sau alte lucrări ştiinţifice care
sunt utilizate în documentaţia prevăzută la alin. (1) trebuie să fie reproduse
fidel, cu indicarea precisă a sursei.
Art. 804. - (1) Reprezentanţii medicali trebuie să fie
instruiţi corespunzător de către firma la care sunt angajaţi şi trebuie să
posede suficiente cunoştinţe ştiinţifice pentru a putea furniza informaţii cât
mai precise şi complete despre medicamentele pe care le promovează.
(2) In timpul fiecărei vizite, reprezentanţii medicali
oferă persoanelor vizitate sau pun la dispoziţia acestora rezumatul
caracteristicilor produsului pentru fiecare medicament pe care îl prezintă,
împreună cu detalii despre preţul şi condiţiile de rambursare.
(3) Reprezentanţii medicali transmit serviciului
ştiinţific la care se face referire la art. 809 alin. (1) toate informaţiile
despre utilizarea medicamentelor pe care le promovează, cu referire în special
la reacţiile adverse raportate de către persoanele pe care le vizitează.
Art. 805. - (1) Când publicitatea pentru medicamente se adresează persoanelor calificate să prescrie sau să
elibereze astfel de produse, nu trebuie să li se ofere, să li se acorde sau să
li se promită cadouri, avantaje în bani sau natură, cu excepţia acelora care nu
sunt costisitoare şi care sunt relevante pentru practica medicală sau
farmaceutică.
(2) La evenimentele de promovare comercială,
ospitalitatea se limitează strict la scopul ei principal şi nu este extinsă la
alte persoane decât profesioniştii din domeniul sănătăţii.
(3) Persoanele calificate să
prescrie sau să distribuie astfel de medicamente nu trebuie să solicite ori să
accepte nici un stimulent interzis conform alin. (1) sau contrar prevederilor
alin. (2).
(4) Prevederile alin. (1) -(3) nu se aplică măsurilor
existente şi practicilor comerciale din România privind preţurile, adaosurile
comerciale şi rabaturile.
Art. 806. - Prevederile art. 805 alin. (1) nu împiedică
oferirea directă sau indirectă a ospitalităţii la evenimente profesionale şi
ştiinţifice; astfel de ospitalitate trebuie să fie întotdeauna strict limitată
la scopul principal al evenimentului; ea nu trebuie să fie extinsă asupra altor
persoane decât profesioniştii din domeniul sănătăţii.
Art. 807. - Mostrele gratuite se oferă, în mod
excepţional, numai persoanelor calificate să prescrie sau să distribuie astfel
de produse şi în următoarele condiţii:
a) numărul de mostre acordate anual pentru fiecare
medicament eliberat pe prescripţie medicală este limitat;
b) orice furnizare de mostre se face ca urmare a unei
solicitări în scris, semnată şi datată de medic;
c) cei care furnizează mostrele menţin un sistem
adecvat de control şi evidenţă;
d) fiecare mostră nu trebuie să fie mai mare decât cea
mai mică formă de prezentare de pe piaţă;
e) fiecare mostră este marcată cu menţiunea „mostră
medicală gratuită - nu este destinată vânzării" sau prezintă o menţiune cu
acelaşi înţeles;
f) fiecare mostră este însoţită de o copie a
rezumatului caracteristicilor produsului;
g) nu se furnizează mostre de medicamente conţinând
substanţe stupefiante şi psihotrope în înţelesul convenţiilor internaţionale,
precum convenţiile Naţiunilor Unite din 1961 şi 1971.
Art. 808. - (1) Agenţia Naţională a Medicamentului ia
măsuri adecvate şi eficiente pentru monitorizarea publicităţii la medicamente,
după cum urmează:
a) în cazul medicamentelor care se eliberează fără
prescripţie medicală, materialele publicitare destinate publicului larg se
supun aprobării prealabile a Agenţiei Naţionale a Medicamentului;
b) în cazul medicamentelor care se eliberează cu sau fără prescripţie medicală, materialele
publicitare destinate persoanelor calificate să prescrie sau să distribuie medicamente
sunt analizate de Agenţia Naţională a Medicamentului ulterior diseminării, prin
sondaj sau ca urmare a unor sesizări.
(2) Persoanele fizice sau juridice care au un interes
legitim în interzicerea oricărei publicităţi care contravine prevederilor
prezentului capitol pot sesiza Agenţia Naţională a Medicamentului în acest
sens; Agenţia Naţională a Medicamentului răspunde sesizărilor în termen de 60
de zile.
(3) Când constată că materialul publicitar încalcă
prevederile prezentului capitol, Agenţia Naţională a Medicamentului ia măsurile
necesare, ţinând seama de toate interesele implicate şi, în special, de interesul public:
a) dacă materialul publicitar a fost deja publicat,
dispune încetarea publicităţii înşelătoare; sau
b) dacă materialul publicitar înşelător nu a fost
încă publicat, dar publicarea este iminentă, dispune interzicerea acestei
publicităţi, chiar fără dovada pierderilor efective, prejudiciului de orice fel
sau a intenţiei ori culpei celui care face publicitatea.
(4) Măsura menţionată la alin. (3) lit. b) este luată
printr-o procedură accelerată şi poate avea caracter temporar sau definitiv.
(5) In scopul eliminării
efectelor publicităţii înşelătoare, a cărei încetare a fost dispusă de Agenţia
Naţională a Medicamentului, aceasta poate să ceară:
a) publicarea deciziei finale complet sau parţial în
forma considerată adecvată;
b) publicarea unei declaraţii
corective.
(6) Prevederile prezentului articol nu exclud
controlul voluntar al publicităţii pentru medicamente ori organisme de
autoreglementare şi recurgerea la astfel de organisme.
Art. 809. - (1) Deţinătorul autorizaţiei de punere pe
piaţă stabileşte, în cadrul structurilor sale, un serviciu ştiinţific
responsabil de informaţiile despre medicamentele pe care le pune pe piaţă.
(2) Deţinătorul autorizaţiei de punere pe piaţă:
a) păstrează disponibile sau comunică Agenţiei
Naţionale a Medicamentului o mostră a tuturor materialelor publicitare
elaborate din iniţiativa sa împreună cu o declaraţie indicând persoanele cărora
li se adresează, metoda de aducere la cunoştinţă şi data primei aduceri la
cunoştinţă;
b) asigură că materialele publicitare elaborate pentru medicamentele sale sunt conforme cu
prevederile prezentului capitol;
c) verifică faptul că reprezentanţii săi medicali au
fost instruiţi adecvat si îsi îndeplinesc obligaţiile prevăzute la art. 804
alin. (2) şi (3);
d) furnizează Agenţiei Naţionale a Medicamentului
informaţiile şi asistenţa necesare pentru îndeplinirea responsabilităţilor ei;
e) se asigură că deciziile luate de Agenţia Naţională
a Medicamentului sunt respectate imediat şi complet.
(3) Copromovarea unui medicament de către deţinătorul autorizaţiei de punere pe piaţă şi de una sau
mai multe companii desemnate de acesta este permisă.
Art. 810. - Agenţia Naţională a Medicamentului ia
măsuri adecvate pentru a asigura aplicarea prevederilor prezentului capitol şi
aplică, în cazul încălcării acestora, sancţiunile prevăzute în prezentul titlu.
Art. 811. - (1) Publicitatea pentru medicamentele
homeopate la care se face referire la art. 711 alin. (1) face obiectul
prevederilor prezentului capitol; în cazul acestor produse nu se aplică prevederile art. 798 alin. (1).
(2) Cu toate acestea, numai informaţiile specificate la
art. 779 pot fi utilizate pentru publicitatea la aceste medicamente.
CAPITOLUL X
Farmacovigilenta
Art. 812. - (1) Ministerul Sănătăţii Publice ia toate
măsurile adecvate pentru încurajarea medicilor şi profesioniştilor din domeniul
sănătăţii să raporteze la Agenţia Naţională a Medicamentului reacţii adverse
suspectate la medicamente.
(2) Ministerul Sănătăţii Publice poate impune cerinţe
specifice medicilor şi altor profesionişti din domeniul sănătăţii privind
raportarea reacţiilor adverse grave suspectate sau neaşteptate.
Art. 813. - (1) Pentru a se asigura adoptarea
deciziilor de reglementare adecvate şi armonizate privind medicamentele
autorizate în Uniunea Europeană, având în vedere informaţiile obţinute privind
reacţiile adverse apărute la medicamente în condiţii normale de utilizare, în
Agenţia Naţională a Medicamentului trebuie să funcţioneze un sistem de
farmacovigilenta; acest sistem trebuie să fie folosit pentru colectarea
informaţiilor utile în supravegherea medicamentelor, cu referire specială la
reacţiile adverse apărute la om şi pentru evaluarea ştiinţifică a acestora.
(2) Agenţia Naţională a Medicamentului ia măsurile
necesare pentru a se asigura că informaţiile adecvate colectate prin acest
sistem sunt comunicate statelor membre ale Uniunii Europene şi Agenţiei
Europene a Medicamentelor.
(3) Acest sistem trebuie să ia în considerare şi
orice informaţie disponibilă privind utilizarea greşită şi abuzul de
medicamente ce pot avea un impact asupra evaluării riscurilor şi beneficiilor.
Art. 814. - Administrarea fondurilor destinate
activităţilor legate de farmacovigilenta, operarea reţelelor de comunicare şi
supraveghere a pieţei se află sub controlul permanent al Agenţiei Naţionale a
Medicamentului pentru a le garanta independenţa.
Art. 815. - Deţinătorul autorizaţiei de punere pe piaţă
trebuie să aibă permanent şi continuu la dispoziţia sa o persoană calificată
corespunzător, responsabilă de activitatea de farmacovigilenta; această
persoană calificată trebuie să fie stabilită în România sau în Uniunea Europeană
şi trebuie să fie responsabilă de următoarele:
a) stabilirea şi menţinerea unui sistem care să asigure
că informaţiile despre toate reacţiile adverse suspectate ce sunt raportate
personalului companiei şi reprezentanţilor ei medicali sunt colectate pentru a fi accesibile cel puţin într-un loc
din Uniunea Europeană;
b) pregătirea pentru Agenţia Naţională a
Medicamentului a rapoartelor prevăzute la art. 816, în forma solicitată de
Agenţia Naţională a Medicamentului, conform ghidului menţionat la art. 818
alin. (1);
c) asigurarea că orice solicitare de la Agenţia
Naţională a Medicamentului pentru furnizarea de informaţii suplimentare
necesare pentru evaluarea beneficiilor şi riscurilor asociate unui medicament
primeşte un răspuns complet şi prompt, inclusiv furnizarea de informaţii despre
volumul vânzărilor sau prescrierilor medicamentului în cauză;
d) comunicarea la Agenţia Naţională a Medicamentului
a oricăror alte informaţii referitoare la evaluarea riscurilor şi beneficiilor
unui medicament, inclusiv informaţii corespunzătoare privind studiile de
siguranţă post-autorizare.
Art. 816. - (1) Deţinătorul autorizaţiei de punere pe
piaţă trebuie să păstreze înregistrări detaliate ale tuturor reacţiilor adverse
suspectate apărute în România, Uniunea Europeană sau într-o ţară terţă; în
afara situaţiilor excepţionale, aceste reacţii sunt comunicate electronic sub
forma unui raport prezentat conform prevederilor
ghidului la care se face referire la art. 818 alin. (1).
(2) Deţinătorul autorizaţiei de punere pe piaţă
înregistrează toate reacţiile adverse grave suspectate care îi sunt aduse la
cunoştinţă de către profesioniştii din domeniul sănătăţii şi le raportează
prompt la Agenţia Naţională a Medicamentului sau la autoritatea competentă din
statul membru al Uniunii Europene pe teritoriul căruia a avut loc incidentul,
în cel mult 15 zile de la primirea informaţiei.
(3) Deţinătorul autorizaţiei de punere pe piaţă
înregistrează toate celelalte reacţii adverse grave suspectate ce îndeplinesc
criteriile de notificare în acord cu ghidul menţionat la art. 818 alin. (1), de
a căror existenţă se presupune în mod rezonabil că are cunoştinţă, şi le
raportează la Agenţia Naţională a Medicamentului sau la autoritatea competentă
din statul membru al Uniunii Europene pe teritoriul căruia a avut loc
incidentul, în cel mult 15 zile de la primirea informaţiei.
(4) Deţinătorul autorizaţiei de punere pe piaţă se
asigură că toate reacţiile adverse grave suspectate şi neaşteptate şi orice
transmitere suspectată printr-un medicament a unui agent infecţios pe
teritoriul unei ţări terţe sunt raportate prompt în acord cu ghidul menţionat
la art. 818 alin. (1), astfel încât Agenţia Europeană a Medicamentelor, Agenţia
Naţională a Medicamentului şi autorităţile competente din statele membre ale
Uniunii Europene în care medicamentul este autorizat să fie informate despre
aceasta, în cel mult 15 zile de la primirea informaţiei.
(5) Se vor face excepţii de la
prevederile alin. (2), (3) şi (4) în cazul medicamentelor care intră sub
incidenţa Directivei 87/22/CEE privind armonizarea măsurilor naţionale
referitoare la punerea pe piaţă a medicamentelor de înaltă tehnologie şi în
special a celor obţinute prin biotehnologie sau care îndeplinesc criteriile
pentru procedurile prevăzute la art. 736 şi 737 sau care au fost supuse
procedurilor prevăzute la art. 32, 33 şi 34 din Directiva 2001/83/CE;
deţinătorul autorizaţiei de punere pe piaţă trebuie să se asigure de asemenea
că toate reacţiile adverse grave suspectate apărute în România şi în
Uniunea Europeană sunt astfel raportate încât sunt
accesibile statului membru de referinţă sau oricărei autorităţi competente
acţionând ca stat membru de referinţă; statul membru de referinţă îşi asumă
responsabilitatea analizei şi monitorizării acestor reacţii adverse.
(6) Dacă nu se stabilesc alte cerinţe pentru
eliberarea autorizaţiei de punere pe piaţă sau ulterior, conform ghidului
menţionat la art. 818 alin. (1), raportările tuturor reacţiilor adverse trebuie
să fie depuse la Agenţia Naţională a Medicamentului în forma unui raport
periodic actualizat referitor la siguranţă, la cerere sau cel puţin o dată la 6
luni după autorizare şi până la punerea pe piaţă. Rapoartele periodice
actualizate referitoare la siguranţă sunt de asemenea depuse la cerere sau cel
puţin o dată la 6 luni în timpul primilor 2 ani de la punerea pe piaţă iniţială
şi o dată pe an în următorii 2 ani. După acest interval, rapoartele se depun la intervale de 3 ani sau la cerere.
Raportul periodic actualizat referitor la siguranţă
include o evaluare ştiinţifică a raportului risc-beneficiu al medicamentului.
(7) După eliberarea unei autorizaţii de punere pe
piaţă, deţinătorul acesteia poate cere modificarea perioadelor prevăzute la
alin. (6) în acord cu procedura prevăzută de Regulamentul Comisiei nr.
1.084/2003 referitor la examinarea variaţiilor la termenii unei autorizaţii de
punere pe piaţă pentru medicamente de uz uman şi veterinar, eliberată de
autoritatea competentă a unui stat membru, şi cu prevederile Ordinului ministrului
sănătăţii nr. 1.127/2003 pentru aprobarea Ghidului referitor la conţinutul
dosarului pentru notificările de tip IA şi IB.
(8) Deţinătorul unei autorizaţii de punere pe piaţă
nu poate comunica informaţii de farmacovigilenţă publicului larg în legătură cu
medicamentul său autorizat, fără notificarea anterioară sau simultană către
Agenţia Naţională a Medicamentului; în orice caz, deţinătorul autorizaţiei de
punere pe piaţă trebuie să se asigure că informaţiile sunt prezentate obiectiv
şi nu sunt înşelătoare.
Art. 817. - (1) Prin utilizarea reţelei de procesare a
datelor pentru facilitarea schimbului de informaţii de farmacovigilenţă privind
medicamentele comercializate în Uniunea Europeană, Agenţia Naţională a
Medicamentului se asigură că rapoartele de reacţii adverse grave suspectate
care au avut loc pe teritoriul României sunt disponibile prompt Agenţiei
Europene a Medicamentelor şi celorlalte state membre ale Uniunii Europene şi,
în orice caz, în cel mult 15 zile de la notificarea lor.
(2) Agenţia Naţională a Medicamentului se asigură că
rapoartele de reacţii adverse grave suspectate care au avut loc pe teritoriul
României sunt imediat disponibile deţinătorului autorizaţiei de punere pe piaţă
şi, în orice caz, în cel mult 15 zile de la notificarea lor.
Art. 818. - (1) Agenţia Naţională a Medicamentului
aplică prevederile ghidurilor privind colectarea, verificarea şi prezentarea
rapoartelor referitoare la reacţiile adverse, cerinţele tehnice pentru schimbul
electronic al informaţiilor de farmacovigilenţă conform formatelor
internaţionale acceptate, elaborate şi publicate de Comisia Europeană, şi
comunică terminologia medicală internaţional acceptată la care se va face
referire; acţionând conform ghidurilor, deţinătorul autorizaţiei de punere pe
piaţă trebuie să folosească terminologia medicală internaţional acceptată
pentru raportarea reacţiilor adverse.
(2) Pentru interpretarea definiţiilor la care se face
referire la pct. 11-16 ale art. 695 şi a principiilor definite în prezentul
capitol, deţinătorul autorizaţiei de punere pe piaţă şi Agenţia Naţională a
Medicamentului trebuie să urmeze ghidurile menţionate la alin. (1).
Art. 819. - (1) Dacă, în urma evaluării datelor de
farmacovigilentă, Agenţia Naţională a Medicamentului consideră că o autorizaţie
de punere pe piaţă trebuie să fie suspendată, retrasă sau modificată conform
ghidurilor menţionate la art. 818 alin. (1), informează imediat Agenţia
Europeană a Medicamentelor, statele membre ale Uniunii Europene şi deţinătorul
autorizaţiei de punere pe piaţă.
(2) Dacă sunt necesare acţiuni urgente pentru
protecţia sănătăţii publice, Agenţia Naţională a Medicamentului poate suspenda
autorizaţia de punere pe piaţă a medicamentului, cu condiţia ca Agenţia
Europeană a Medicamentelor, Comisia Europeană şi statele membre ale Uniunii
Europene să fie informate nu mai târziu de următoarea zi lucrătoare.
(3) Dacă Agenţia Europeană a Medicamentelor este
informată conform alin. (1) în legătură cu suspendările şi retragerile sau
conform alin. (2), Comitetul pentru medicamente de uz uman trebuie să
pregătească o opinie într-un interval de timp depinzând de urgenţa problemei;
în legătură cu variaţiile, Comitetul pentru medicamente de uz uman poate, pe
baza solicitării Agenţiei Naţionale a Medicamentului, să pregătească o opinie.
(4) Acţionând pe baza acestei opinii, Comisia
Europeană poate cere tuturor statelor membre ale Uniunii Europene unde produsul
este pus pe piaţă să ia imediat măsuri temporare; măsurile finale vor fi
adoptate conform procedurilor europene.
Art. 820. - Agenţia Naţională a Medicamentului aplică
orice modificări care pot apărea ca fiind necesare pentru actualizarea
prevederilor art. 812-819, pentru a lua în considerare progresul ştiinţific şi
tehnic, după adoptarea acestora de Comisia Europeană.
CAPITOLUL XI
Prevederi speciale pentru medicamentele derivate din
sânge uman şi plasmă umană
Art. 821.- Pentru colectarea şi testarea sângelui uman
şi a plasmei umane se aplică prevederile legislaţiei naţionale care transpune
prevederile Directivei 2002/98/CE a Parlamentului şi Consiliului din 27
ianuarie 2003 privind stabilirea standardelor de calitate şi siguranţă pentru
colectarea, testarea, procesarea, depozitarea şi distribuirea sângelui uman şi
a componentelor sângelui şi care modifică Directiva 2001/83/CE.
Art. 822. - Ministerul Sănătăţii Publice trebuie să ia
măsurile necesare pentru promovarea autosuficienţei sângelui uman sau a plasmei
umane în România; în acest scop, trebuie să încurajeze donările voluntare
neplătite de sânge şi plasmă şi să ia măsurile necesare pentru dezvoltarea
fabricaţiei şi utilizării produselor derivate din sânge uman sau plasmă umană
provenind din donări neplătite; Ministerul Sănătăţii Publice notifică Comisiei
Europene astfel de măsuri.
CAPITOLUL XII
Supraveghere şi sancţiuni
Art. 823. - (1) Agenţia Naţională a Medicamentului se
asigură că cerinţele legale privind medicamentele sunt respectate, prin
inspecţii repetate şi, dacă este cazul, inspecţii neanunţate; după caz, Agenţia
Naţională a Medicamentului cere laboratoarelor proprii de control sau unui
laborator certificat/recunoscut de Agenţia Naţională a
Medicamentului în acest scop să efectueze teste asupra
probelor de medicamente.
Agenţia Naţională a Medicamentului poate, de asemenea,
să efectueze inspecţii neanunţate la localurile fabricanţilor de substanţe
active folosite ca materii prime sau la localurile deţinătorilor autorizaţiei
de punere pe piaţă, ori de câte ori consideră că există motive pentru a
suspecta nerespectarea principiilor şi ghidurilor de bună practică de
fabricaţie menţionate la art. 756.
Agenţia Naţională a Medicamentului poate efectua
inspecţii la fabricanţii de materii prime şi la cererea specială a acestora.
Astfel de inspecţii sunt
efectuate de inspectori ai Agenţiei Naţionale a Medicamentului, care sunt
împuterniciţi:
a) să inspecteze localurile de fabricaţie sau
comerciale ale fabricanţilor de medicamente ori de substanţe active folosite ca
materii prime şi orice laboratoare folosite de deţinătorul autorizaţiei de
fabricaţie, pentru a efectua verificări conform art. 725;
b) să ia probe inclusiv în scopul unor teste
independente efectuate de un laborator al Agenţiei Naţionale a Medicamentului
sau de un laborator certificat/recunoscut de Agenţia Naţională a
Medicamentului; contravaloarea probelor prelevate în cadrul activităţii de
supraveghere se suportă, după caz, de către fabricant sau unitatea de
distribuţie; costul analizelor efectuate de Agenţia Naţională a Medicamentului
sau de laboratoare recunoscute de Agenţia Naţională a Medicamentului se suportă
din bugetul Agenţiei Naţionale a Medicamentului, dacă produsul este
corespunzător calitativ, şi de către fabricantul sau distribuitorul în culpă,
dacă produsul este necorespunzător calitativ;
c) să examineze orice document care are legătură cu obiectul
inspecţiei, respectând prevederile naţionale în vigoare care stabilesc
restricţii asupra acestor puteri în ceea ce priveşte descrierea metodei de
fabricaţie;
d) să inspecteze localurile, înregistrările şi
documentele deţinătorilor autorizaţiei de punere pe piaţă sau ale oricăror
firme folosite de către deţinătorul autorizaţiei de punere pe piaţă pentru
efectuarea activităţilor prevăzute la cap. X al
prezentului titlu şi în special la art. 815 şi 816.
(2) Agenţia Naţională a Medicamentului acţionează
pentru a se asigura că procesele de fabricaţie utilizate la fabricarea
produselor imunologice sunt corect validate şi că se obţine aceeaşi consistenţă
de la serie la serie.
(3) După fiecare inspecţie menţionată la alin. (1),
inspectorii Agenţiei Naţionale a Medicamentului raportează dacă fabricantul
respectă principiile şi ghidurile de bună practică de fabricaţie stabilite la
art. 756 sau, după caz, cerinţele stabilite la art. 812 - 820; conţinutul
acestor rapoarte este comunicat fabricantului sau deţinătorului autorizaţiei de
punere pe piaţă la care s-a efectuat inspecţia.
(4) Fără a contraveni altor acorduri care au fost
încheiate între Uniunea Europeană şi ţări terţe, Agenţia Naţională a
Medicamentului poate cere unui producător stabilit într-o ţară terţă să se
supună unei inspecţii conform cu prevederile alin. (1).
(5) In termen de 90 de zile de la inspecţia efectuată
în conformitate cu prevederile alin. (1), se emite un certificat de bună
practică de fabricaţie, dacă inspecţia demonstrează că fabricantul respectă
principiile şi ghidurile de bună practică de fabricaţie conform legislaţiei
naţionale; dacă inspecţiile sunt efectuate ca parte a procedurii de certificare
pentru monografiile Farmacopeii Europene, se întocmeşte un certificat de bună practică
de fabricaţie.
(6) Agenţia Naţională a Medicamentului introduce
certificatele de bună practică de fabricaţie pe care le eliberează într-o bază
de date a Uniunii Europene, administrată
de Agenţia Europeană a Medicamentelor în numele Uniunii Europene.
(7) Dacă rezultatul inspecţiei conform alin. (1)
indică faptul că fabricantul nu respectă principiile şi ghidurile de bună
practică de fabricaţie conform legislaţiei naţionale, informaţiile se introduc
în baza de date a Uniunii Europene menţionată la alin. (6).
(8) Inspecţiile prevăzute la alin. (1) pot fi de
asemenea efectuate la cererea unui stat membru al Uniunii Europene, a Comisiei
Europene sau a Agenţiei Europene a Medicamentelor.
Art. 824. - Agenţia Naţională a Medicamentului ia toate
măsurile necesare pentru a se asigura că deţinătorul autorizaţiei de punere pe
piaţă pentru un medicament şi, după caz, deţinătorul autorizaţiei de fabricaţie
fac dovada controalelor efectuate privind medicamentul şi/sau ingredientele şi
a controalelor efectuate în stadii intermediare ale procesului de fabricaţie,
conform metodelor stabilite la art. 702 alin. (4) lit. i).
Art. 825. - In scopul implementării prevederilor art.
824, Agenţia Naţională a Medicamentului poate cere fabricanţilor de produse
imunologice să depună la Agenţia Naţională a Medicamentului copiile tuturor
rapoartelor de control semnate de persoana calificată conform art. 760.
Art. 826. - (1) Dacă Agenţia Naţională a Medicamentului
consideră că este necesar în interesul sănătăţii publice, poate cere
deţinătorului autorizaţiei de punere pe piaţă pentru:
- vaccinuri vii;
- medicamente imunologice utilizate în imunizarea
primară a copiilor sau altor grupe de risc;
- medicamente imunologice utilizate în programele de
imunizare pentru sănătatea publică;
- medicamente imunologice noi sau medicamente
imonologice fabricate folosind tehnici noi ori tehnologii modificate sau noi
pentru un anume fabricant, în timpul unei perioade de
tranziţie în mod normal specificate în autorizaţia de punere pe piaţă, să depună probe pentru fiecare serie de
producţie pentru examinare de către un laborator propriu sau un laborator
certificat/recunoscut de Agenţia Naţională a Medicamentului în acest scop,
înainte de punerea pe piaţă, dacă, în cazul unei serii fabricate într-un stat
membru al Uniunii Europene, autoritatea competentă a acelui stat membru nu a
examinat seria respectivă şi nu a declarat-o a fi în conformitate cu specificaţiile aprobate.
Agenţia Naţională a Medicamentului se asigură că orice
astfel de examinare este finalizată în termen de 60 de zile de la recepţia
probelor.
(2) In interesul sănătăţii publice, Agenţia Naţională a
Medicamentului poate cere deţinătorului autorizaţiei de punere pe piaţă pentru
medicamente derivate din sânge uman sau plasmă umană să depună probe din
fiecare serie de fabricaţie a produsului vrac pentru testarea de către un
laborator propriu sau un laborator certificat/recunoscut de Agenţia Naţională a
Medicamentului în acest scop, înainte de intrarea în circuitul terapeutic, dacă
autoritatea competentă a unui stat membru al Uniunii Europene nu a examinat
anterior seria respectivă şi nu a declarat-o a fi în conformitate cu
specificaţiile aprobate. Agenţia Naţională a Medicamentului se asigură că orice
astfel de examinare este completată în termen de 60 de zile de la recepţia
probelor.
Art. 827. - (1) Agenţia Naţională a Medicamentului ia
toate măsurile necesare pentru a se asigura că procesele de fabricaţie şi
purificare utilizate în prepararea medicamentelor derivate din sânge uman sau plasmă
umană sunt validate corespunzător, ating aceeaşi consistenţă de la serie la serie şi
garantează, conform stadiului tehnologic actual, absenţa contaminării virale
specifice.
(2) In acest scop, fabricanţii notifică Agenţiei
Naţionale a Medicamentului metoda utilizată pentru a reduce sau a elimina
virusurile patogene ce pot fi transmise de medicamente derivate din sânge uman
sau din plasmă umană.
(3) Agenţia Naţională a
Medicamentului poate depune probe din seria respectivă pentru testare de către
un laborator propriu sau un laborator certificat/recunoscut de Agenţia
Naţională a Medicamentului în acest scop, fie în timpul examinării cererii
conform art. 724, fie după ce a fost acordată o autorizaţie de punere pe piaţă.
Art. 828. - (1) Agenţia Naţională a Medicamentului
suspendă, retrage sau modifică o autorizaţie de punere pe piaţă dacă se
dovedeşte că produsul este periculos în condiţii normale de folosire sau dacă
este lipsit de eficacitate terapeutică ori dacă raportul risc-beneficiu nu este
pozitiv în condiţii normale de utilizare sau dacă compoziţia calitativă ori
cantitativă nu este conformă cu aceea declarată; eficacitatea terapeutică este
absentă dacă se ajunge la concluzia că nu pot fi obţinute rezultate terapeutice
cu medicamentul respectiv.
(2) Autorizaţia este de asemenea suspendată, retrasă
sau modificată dacă datele de susţinere a cererii prevăzute la art. 702 sau
art. 704, 705, 706, 707 şi 708 sunt incorecte ori nu au fost modificate conform
prevederilor art. 728 sau dacă nu au fost efectuate controalele menţionate la
art. 824.
Art. 829. - (1) Cu respectarea măsurilor prevăzute la
art. 828, Agenţia Naţională a Medicamentului ia toate măsurile necesare pentru
a se asigura că furnizarea medicamentului este interzisă şi medicamentul este
retras de pe piaţă dacă se observă că:
a) medicamentul este periculos în condiţii normale de
utilizare; sau
b) nu are eficacitate terapeutică; sau
c) raportul risc-beneficiu nu
este favorabil în condiţiile de utilizare autorizate; sau
d) compoziţia calitativă şi cantitativă nu este
conformă cu aceea declarată; sau
e) controalele medicamentului şi/sau ale
ingredientelor şi controalele în stadiile intermediare de fabricaţie nu au fost
efectuate sau alte cerinţe ori obligaţii necesare acordării autorizaţiei de
fabricaţie nu au fost îndeplinite.
(2) Agenţia Naţională a Medicamentului poate limita
interdicţia de furnizare a medicamentului sau de retragere de pe piaţă la acele
serii care fac obiectul disputei.
Art. 830. - (1) Agenţia Naţională a Medicamentului
suspendă sau retrage autorizaţia de punere pe piaţă pentru o categorie de
medicamente sau pentru toate medicamentele dacă una dintre cerinţele prevăzute
la art. 749 nu mai este îndeplinită.
(2) In plus faţă de măsurile prevăzute la art. 829,
Agenţia Naţională a Medicamentului poate suspenda fabricaţia sau importurile de
medicamente provenind din ţări terţe sau suspendă ori retrage autorizaţia de
fabricaţie pentru o categorie de medicamente sau pentru toate medicamentele
dacă prevederile art. 750, 754, 760 şi 824 nu mai sunt respectate.
Art. 831. - Prevederile prezentului capitol se aplică
şi pentru medicamentele homeopate.
Art. 832. - (1) Unităţile de distribuţie angro şi en
detail au obligaţia de a informa Agenţia Naţională a Medicamentului despre deficienţele
de calitate semnalate în legătură cu medicamentele.
(2) Agenţia Naţională a Medicamentului analizează
reclamaţiile privind deficienţele de calitate şi propune măsurile
administrative necesare.
(3) Unităţile farmaceutice au obligaţia să respecte
prevederile legale privind retragerea din consum a medicamentelor
necorespunzătoare.
(4) Orice unitate de producţie sau de distribuţie a
medicamentelor procedează la distrugerea medicamentelor necorespunzătoare
calitativ sau expirate, în acord cu reglementările în vigoare; medicamentele
stupefiante şi psihotrope sunt distruse în conformitate cu legislaţia în
vigoare.
(5) Orice persoană care utilizează medicamente poate
să informeze Agenţia Naţională a Medicamentului despre deficienţele de calitate
sesizate în legătură cu medicamentele utilizate.
Art. 833. - Nerespectarea prevederilor prezentului
titlu atrage răspunderea disciplinară, civilă, contravenţională sau penală,
după caz.
Art. 834. - (1) Contrafacerea sau punerea în circulaţie
de medicamente fără respectarea prevederilor prezentului titlu constituie
infracţiune şi se pedepseşte cu închisoare de la 3 luni la 3 ani.
(2) Dacă medicamentele contrafăcute sau puse în
circulaţie fără respectarea prevederilor prezentului titlu sunt vătămătoare
sănătăţii, fapta se pedepseşte cu închisoare de la un an la 8 ani.
(3) Dacă faptele prevăzute la alin. (1) sau (2) au
avut ca urmare îmbolnăvirea sau agravarea bolii unei persoane, pedeapsa este
închisoarea de la 2 ani la 8 ani, iar dacă a avut ca urmare decesul, pedeapsa
este închisoarea de la 5 ani la 15 ani.
Art. 835. - (1) Nerespectarea de către personalul
calificat în studiul clinic al medicamentelor a Regulilor de bună practică în
studiul clinic constituie infracţiune şi se pedepseşte cu închisoare de la 3
luni la 6 luni sau cu amendă de la 10.000 lei (RON) la 20.000 lei (RON).
(2) Efectuarea de către personal necalificat în
studiul clinic al medicamentelor a unor studii care necesită aprobarea Agenţiei
Naţionale a Medicamentului, precum şi nerespetarea Regulilor de bună practică
în studiul clinic atrag răspunderea penală a acestuia şi se pedepsesc cu
închisoare de la un an la 2 ani.
(3) Dacă fapta prevăzută la alin. (1) sau (2) a avut
ca urmare decesul, îmbolnăvirea sau agravarea bolii ori vătămarea integrităţii
corporale a unei persoane, pedeapsa este închisoarea de la 2 ani la 5 ani.
Art. 836. - (1) Constituie contravenţii următoarele
fapte şi se sancţionează de către inspectorii din Agenţia Naţională a
Medicamentului şi, după caz, din Ministerul Sănătăţii Publice, astfel:
a) cu amendă de la 10.000 lei (RON) la 30.000 lei
(RON) aplicată fabricantului şi cu închiderea unităţii, în cazul funcţionării
unităţii de producţie de medicamente fără autorizaţie de fabricaţie emisă de
Agenţia Naţională a Medicamentului; se sancţionează cu aceeaşi amendă
distribuitorul şi cu închiderea unităţii de distribuţie angro a medicamentelor,
care funcţionează fără autorizaţie emisă de Ministerul Sănătăţii Publice;
b) cu amendă de la 5.000 lei (RON) la 10.000 lei
(RON), în cazul nerespectării Regulilor de bună practică de laborator de către
laboratoarele care efectuează teste farmacotoxicologice în vederea întocmirii
documentaţiei de autorizare de punere pe piaţă a medicamentelor de uz uman;
c) cu amendă de la 5.000 lei (RON) la 10.000 lei
(RON), aplicată fabricantului sau distribuitorului, după caz, pentru
practicarea în cadrul unităţii de producţie sau de distribuţie a medicamentelor
a altor activităţi decât a celor pentru care au fost autorizate, distribuţia de
la fabricant sau din depozitele de medicamente a medicamentelor către unităţi
neautorizate de Ministerul Sănătăţii Publice în condiţiile legii, participarea persoanelor necalificate la
operaţiuni tehnice care necesită calificare de specialitate în procesul de
fabricaţie şi în cel de distribuţie, precum şi nerespectarea prevederilor
referitoare la clasificarea pentru eliberarea, inscripţionarea şi prospectul
medicamentelor, publicitatea medicamentelor, raportarea schimbărilor survenite
în activitatea de producţie sau de distribuţie, retrageri, nerespectarea
Regulilor de bună practică în activitatea de farmacovigilenţă desfăşurată de
deţinătorul autorizaţiei de punere pe piaţă;
d) cu amendă de la 5.000 lei (RON) la 10.000 lei
(RON) aplicată fabricantului în cazul nerespectării condiţiilor de funcţionare
a unităţii de producţie de medicamente pentru care a fost autorizat sau în
cazul nerespectării Regulilor de bună practică de fabricaţie;
e) cu amendă de la 10.000 lei (RON la 20.000 lei (RON), în cazul
fabricării şi distribuţiei medicamentelor fără documente care să ateste
provenienţa şi/sau calitatea acestora, în cazul nerespectării prevederilor
privind procedura de retragere a medicamentelor de către fabricanţi şi
distribuitori, precum şi în cazul deţinerii şi distribuirii medicamentelor cu
termen de valabilitate depăşit sau cu buletin de analiză necorespunzător;
f) cu amendă de la 5.000 lei (RON) la 10.000 lei
(RON), lipsa din unităţile de distribuţie a farmacistului-şef sau a
înlocuitorului acestuia pe perioada în care unitatea funcţionează, precum şi
împiedicarea exercitării activităţii de inspecţie;
g) cu amendă de la 10.000 lei (RON) la 30.000 lei
(RON) şi suspendarea autorizaţiei de funcţionare a unităţii de distribuţie pe o
durată de un an în cazul repetării într-o perioadă de 3 luni a uneia dintre
contravenţiile constatate, prevăzute la lit. c) şi e);
h) cu amendă de la 5.000 lei (RON) la 20.000 lei (RON)
şi suspendarea autorizaţiei de funcţionare a unităţii de distribuţie, în cazul
nerespectării Regulilor de distribuţie angro, până la remedierea deficienţelor
constatate;
i) cu amendă de la 2.000 lei (RON) la 5.000 lei (RON),
în cazul în care deţinătorul autorizaţiei de punere pe piaţă nu raportează la
Agenţia Naţională a Medicamentului reacţiile adverse care i-au fost aduse la
cunoştinţă.
(2) Limitele amenzilor prevăzute la alin. (1) pot fi
modificate periodic prin hotărâre a Guvernului.
Art. 837. - Dispoziţiile art. 836 se completează cu
prevederile Ordonanţei Guvernului nr. 2/2001 privind regimul juridic al
contravenţiilor, aprobată cu modificări şi completări prin Legea nr. 180/2002,
cu modificările şi completările ulterioare.
Art. 838. - Incălcarea prevederilor legale privind
regimul medicamentelor stupefiante şi psihotrope se sancţionează potrivit
legislaţiei în vigoare.
CAPITOLUL XIII
Dispoziţii generale
Art. 839. - (1) Ministerul Sănătăţii Publice ia toate
măsurile necesare pentru a se asigura că Agenţia Naţională a Medicamentului
transmite celorlalte autorităţi competente din statele membre ale Uniunii
Europene informaţiile corespunzătoare pentru a garanta că cerinţele conţinute
în autorizaţiile menţionate la art. 748 şi 788, în certificatele menţionate la
art. 823 alin. (5) sau în autorizaţiile de punere pe piaţă sunt îndeplinite.
(2) In urma unor solicitări justificate, Agenţia
Naţională a Medicamentului comunică de îndată rapoartele menţionate la art. 823
alin. (3) autorităţii competente din alt stat membru al
Uniunii Europene.
(3) Concluziile obţinute conform art. 823 alin. (1)
sunt valabile pe tot teritoriul Uniunii Europene. Totuşi, în cazuri excepţionale, dacă Agenţia Naţională a
Medicamentului nu poate să accepte, din motive de sănătate publică, concluziile
rezultate dintr-o inspecţie efectuată în conformitate cu art. 823 alin. (1),
trebuie să informeze despre aceasta Comisia Europeană şi Agenţia Europeană a
Medicamentelor.
Art. 840. - (1) Agenţia Naţională a Medicamentului ia
toate măsurile necesare pentru a se asigura că deciziile de autorizare de
punere pe piaţă, refuzare sau retragere a unei autorizaţii de punere pe piaţă,
anularea unei decizii de refuzare sau de retragere a unei autorizaţii de punere
pe piaţă, de interzicere a furnizării sau retragerii unui produs de pe piaţă,
împreună cu motivele care au determinat astfel de decizii, sunt aduse imediat
la cunoştinţă Agenţiei Europene a Medicamentelor.
(2) Deţinătorul autorizaţiei de punere pe piaţă este
obligat să notifice imediat Agenţiei Naţionale a Medicamentului, precum şi
autorităţilor competente din alte state membre interesate ale Uniunii Europene
în legătură cu orice acţiune pe care a iniţiat-o pentru suspendarea punerii pe
piaţă a unui medicament sau pentru retragerea unui medicament de pe piaţă,
împreună cu motivele care au determinat această acţiune, dacă aceasta are
legătură cu eficacitatea medicamentului sau cu protecţia sănătăţii publice;
Agenţia Naţională a Medicamentului se asigură că această informaţie este adusă
la cunoştinţă Agenţiei Europene a Medicamentelor.
(3) Agenţia Naţională a Medicamentului se asigură că
informaţiile corespunzătoare despre acţiunile menţionate la alin. (1) şi (2),
care pot afecta protecţia sănătăţii publice în ţări terţe, sunt transmise
imediat în atenţia Organizaţiei Mondiale a Sănătăţii, cu o copie la Agenţia
Europeană a Medicamentelor.
(4) Agenţia Naţională a Medicamentului ia în
considerare lista medicamentelor interzise în Uniunea Europeană, publicată
anual de Comisia Europeană.
Art. 841. - Agenţia Naţională a
Medicamentului comunică cu statele membre ale Uniunii Europene şi primeşte de
la acestea informaţii necesare pentru a garanta calitatea şi siguranţa
medicamentelor homeopate fabricate şi comercializate pe teritoriul României şi
al Uniunii Europene şi, în special, informaţiile menţionate la art. 839 şi 840.
Art. 842. - (1) Orice decizie menţionată în prezentul
titlu, care este luată de Agenţia Naţională a Medicamentului, trebuie să
menţioneze în detaliu motivele pe care se bazează.
(2) O astfel de decizie este
notificată părţii interesate, împreună cu informaţii privind calea de atac
conform legislaţiei în vigoare şi termenul limită pentru accesul la aceasta.
(3) Deciziile de acordare sau de retragere a unei
autorizaţii de punere pe piaţă sunt făcute publice.
Art. 843. - (1) O autorizaţie de punere pe piaţă a unui
medicament nu este refuzată, suspendată sau retrasă decât pentru motivele
stabilite în prezentul titlu.
(2) Nu se poate lua o decizie privind suspendarea
fabricaţiei sau importului de medicamente din ţări terţe, interzicerea de
furnizare sau retragerea de pe piaţă decât pe baza condiţiilor prevăzute la
art. 829 şi 830.
Art. 844. - (1) In absenţa unei autorizaţii de punere
pe piaţă sau a unei cereri de autorizare depuse pentru un medicament autorizat
în alt stat membru al Uniunii Europene conform Directivei 2001/83/CE, Agenţia
Naţională a Medicamentului poate, pe motive de sănătate publică, să autorizeze
punerea pe piaţă a medicamentului respectiv.
(2) Dacă Agenţia Naţională a Medicamentului foloseşte
această posibilitate, adoptă toate măsurile necesare pentru a se asigura că cerinţele prezentului
titlu sunt respectate, în special cele menţionate în cap. V, VI, VIII, X şi XII din prezentul titlu.
(3) Inainte de acordarea unei astfel de autorizaţii, Agenţia Naţională a Medicamentului:
a) notifică deţinătorului autorizaţiei de punere pe
piaţă din statul membru al Uniunii Europene în care medicamentul în cauză este
autorizat despre propunerea de acordare a unei autorizaţii conform prezentului
articol; şi
b) cere autorităţii competente din acel stat membru
al Uniunii Europene să furnizeze o copie a raportului de evaluare menţionat la
art. 21 alin. 4 din Directiva 2001/83/CE şi a autorizaţiei de punere pe piaţă
în vigoare a medicamentului în cauză.
(4) Agenţia Naţională a Medicamentului notifică
Comisiei Europene dacă un medicament este autorizat sau încetează să mai fie
autorizat, conform alin. (1), inclusiv numele sau denumirea şi adresa
permanentă ale deţinătorului autorizaţiei de punere pe piaţă.
Art. 845. - (1) Pentru a garanta independenţa şi
transparenţa, Agenţia Naţională a Medicamentului se asigură că personalul său
responsabil cu acordarea autorizaţiilor, raportorii şi experţii implicaţi în
autorizarea şi supravegherea medicamentelor nu au nici un interes financiar sau
alte interese în industria farmaceutică, care le-ar putea afecta
imparţialitatea; aceste persoane vor face o declaraţie anuală de interese.
(2) In plus, Agenţia Naţională a Medicamentului face
publice regulile proprii de procedură şi pe acelea ale consiliilor şi
comisiilor sale, agendele şi rapoartele întâlnirilor, însoţite de deciziile
luate, detalii despre voturi şi explicaţii ale voturilor, inclusiv opiniile
minoritare.
Art. 846. - (1) La cererea fabricantului, exportatorului sau a autorităţilor dintr-o ţară importatoare
terţă, Agenţia Naţională a Medicamentului certifică faptul că un fabricant de
medicamente deţine o autorizaţie de fabricaţie; la eliberarea acestui fel de
certificate, Agenţia Naţională a Medicamentului trebuie să se conformeze următoarelor
condiţii:
a) să ţină seama de recomandările Organizaţiei
Mondiale a Sănătăţii;
b) pentru medicamentele destinate exportului, deja
autorizate în România, să furnizeze rezumatul caracteristicilor produsului aprobat conform art. 726.
(2) Dacă fabricantul nu deţine o autorizaţie de punere
pe piaţă, acesta furnizează Agenţiei Naţionale a Medicamentului o declaraţie în
care explică de ce nu este disponibilă o autorizaţie de punere pe piaţă.
Art. 847. - In cazul
medicamentelor autorizate prin procedura centralizată, Agenţia Naţională a
Medicamentului implementează condiţiile sau restricţiile referitoare la
siguranţa şi utilizarea eficace a medicamentelor, prevăzute în opinia
Comitetului pentru medicamente de uz uman al Agenţiei Europene a Medicamentelor.
Art. 848. - Ministerul Sănătăţii Publice se asigură că
există sisteme adecvate de colectare a medicamentelor nefolosite sau expirate.
Art. 849. - Dispoziţiile prezentului titlu se aplică şi
medicamentelor cu conţinut stupefiant şi psihotrop, precum şi medicamentelor
conţinând substanţe chimice periculoase, reglementate prin Legea nr. 360/2003
privind regimul substanţelor şi preparatelor chimice periculoase, cu
modificările şi completările ulterioare.
Art. 850. - Guvernul, la
propunerea Ministerului Sănătăţii Publice, pe motive legate de interesul
sănătăţii publice, poate să limiteze sau să interzică pentru anumite perioade
de timp exportul unor medicamente de uz uman.
Art. 851. - Ministerul Sănătăţii Publice stabileşte şi
avizează preţurile medicamentelor din import şi din ţară, cu excepţia
medicamentelor care se eliberează fără prescripţie medicală (OTC).
CAPITOLUL XIV
Dispoziţii finale şi tranzitorii
Art. 852. - (1) Pentru medicamentele de referinţă
autorizate de punere pe piaţă sau pentru care au fost depuse cereri de
autorizare în România ori în statele membre ale Uniunii Europene înainte de
data de 30 octombrie 2005, respectiv la Agenţia Europeană a Medicamentelor
pentru autorizare prin procedura centralizată înainte de data de 20 noiembrie
2005, se aplică prevederile alin. (2)-(9).
(2) Ca excepţie de la prevederile art. 702 alin. (4)
lit. j), cu respectarea legislaţiei privind protecţia proprietăţii industriale
şi comerciale, solicitantul nu trebuie să furnizeze rezultatele testelor
preclinice şi ale studiilor clinice, dacă poate demonstra că medicamentul este
un generic al unui medicament de referinţă care este ori a fost autorizat în
România, într-un stat membru al Uniunii Europene sau în Uniunea Europeană prin
procedura centralizată.
(3) Solicitantul se poate prevala de dreptul prevăzut
la alin. (2) numai după trecerea a cel puţin 6 ani de la autorizarea
medicamentului de referinţă în România sau în unul dintre statele membre ale
Uniunii Europene, respectiv cel puţin 10 ani de la autorizare pentru
medicamentele de înaltă tehnologie autorizate în Uniunea Europeană prin
procedura centralizată (perioadă de exclusivitate a datelor).
(4) Perioada de exclusivitate a datelor se calculează
de la data autorizării medicamentului de referinţă în România, în unul dintre
statele membre ale Uniunii Europene sau în Uniunea Europeană prin procedura
centralizată, oricare dintre aceste autorizări a survenit mai întâi.
(5) In cazul în care medicamentul de referinţă nu a
fost autorizat în România, solicitantul trebuie să indice în documentaţia
depusă numele statului membru al Uniunii Europene în care medicamentul de
referinţă este sau a fost autorizat ori faptul că medicamentul a fost autorizat
în Uniunea Europeană prin procedura centralizată. Agenţia Naţională a
Medicamentului solicită autorităţii competente din statul membru al Uniunii
Europene indicat de solicitant, respectiv Agenţiei Europene a Medicamentelor,
confirmarea faptului că medicamentul de referinţă este sau a fost autorizat,
compoziţia completă a medicamentului de referinţă şi, dacă este cazul, altă
documentaţie relevantă.
(6) In înţelesul prezentului articol, medicamente
de înaltă tehnologie înseamnă orice medicament care se încadrează în una
dintre categoriile de mai jos şi care a fost autorizat prin procedura
centralizată:
a) medicamentele obţinute prin unul dintre
următoarele procese biotehnologice:
- tehnologia ADN recombinat;
- expresia controlată a genelor care codifică
proteine biologic active în celulele procariote şi eucariote, inclusiv în
celulele transformate de mamifere;
- metodele cu hibridomi şi anticorpi monoclonali;
b) medicamentele obţinute prin alte procese
biotehnologice decât cele menţionate la lit. a) şi care constituie o inovaţie
semnificativă;
c) medicamentele administrate cu ajutorul unor
sisteme de eliberare noi şi care constituie o inovaţie semnificativă;
d) medicamentele pentru o indicaţie terapeutică
complet nouă şi care prezintă un interes terapeutic important;
e) medicamentele bazate pe izotopi
radioactivi şi care prezintă un interes terapeutic important;
f) medicamentele derivate din sânge şi plasmă umană;
g) medicamentele pentru a căror fabricaţie se
folosesc procese tehnologice avansate, cum ar fi electroforeza bidimensională
sub microgravitaţie;
h) medicamentele conţinând o substanţă activă nouă care
nu a fost autorizată pentru utilizare în medicamente de uz uman în nici unul
dintre statele membre ale Uniunii Europene înainte de data de 1 ianuarie 1995.
(7) Cu toate acestea, în cazul
în care se intenţionează ca medicamentul să fie folosit pentru o altă indicaţie
terapeutică decât aceea a celorlalte medicamente aflate pe piaţă sau să fie
administrat pe căi diferite ori în doze diferite, este necesar să fie transmise
rezultatele testelor toxicologice şi farmacologice şi/sau ale studiilor clinice
adecvate.
(8) Agenţia Naţională a Medicamentului poate primi
cereri de autorizare pentru medicamente generice numai după expirarea perioadei
de exclusivitate a datelor, acordată în România pentru un medicament de
referinţă.
(9) In înţelesul prezentului articol, termenii medicament
de referinţă şi medicament generic vor avea acelaşi înţeles ca în art. 704 alin. (2).
Art. 853. - In privinţa procedurii de autorizare de
punere pe piaţă, pentru cererile depuse la Agenţia Naţională a Medicamentului
până la data intrării în vigoare a prezentului titlu, se respectă prevederile
legale în vigoare la momentul depunerii cererii.
Art. 854. - La depunerea documentaţiei în vederea
obţinerii autorizaţiei de punere pe piaţă, solicitanţii plătesc la Agenţia
Naţională a Medicamentului o taxă de autorizare de punere pe piaţă de 100 euro
sau echivalentul în lei la cursul Băncii Naţionale a României, care se virează
la bugetul de stat.
Art. 855. - Autorizarea de punere
pe piaţă a medicamentelor nu se supune reglementărilor privind procedura
aprobării tacite, cu excepţia prevederilor art. 771 alin. (3).
Art. 856. - (1) La depunerea documentaţiei pentru
autorizarea de funcţionare, depozitele farmaceutice plătesc în contul
Ministerul Sănătăţii Publice suma de 4.000 lei (RON).
(2) Sumele încasate potrivit alin. (1) de către
Ministerul Sănătăţii Publice se virează la bugetul de stat, potrivit
dispoziţiilor legale.
Art. 857. - Tarifele propuse de Agenţia Naţională a
Medicamentului pentru activităţile desfăşurate de aceasta se aprobă prin ordin
al ministrului sănătăţii publice, care se publică în Monitorul Oficial al
României, Partea I.
Art. 858. - Cheltuielile necesare pentru efectuarea de
către salariaţii Ministerului Sănătăţii Publice a inspecţiilor în vederea
acordării autorizaţiei de funcţionare pentru depozite farmaceutice sau a altor
tipuri de inspecţii sunt asigurate din bugetul acestui minister.
Art. 859. - Perioada de exclusivitate a datelor
prevăzută la art. 704 alin. (1) se aplică medicamentelor de referinţă pentru
care au fost depuse cereri de autorizare la Agenţia Naţională a Medicamentului
sau în statele membre ale Uniunii Europene după data de 30 octombrie 2005,
respectiv la Agenţia Europeană a Medicamentelor pentru autorizare prin
procedura centralizată după data de 20 noiembrie 2005.
Art. 860. - Pentru medicamentele din plante medicinale
tradiţionale care sunt deja pe piaţă la momentul intrării în vigoare a
prezentului titlu, Agenţia Naţională a Medicamentului aplică prevederile
acestui titlu pe un termen de 7 ani de la intrarea în vigoare a prezentului
titlu.
Art. 861. - (1) La data intrării în vigoare a
prevederilor prezentului titlu se abrogă Ordonanţa de urgenţă a Guvernului nr.
152/1999 privind produsele medicamentoase de uz uman, publicată în Monitorul
Oficial al României, Partea I, nr. 508 din 20 octombrie 1999, aprobată cu modificări şi completări
prin Legea nr. 336/2002, cu modificările şi completările ulterioare, cu
excepţia art. 109 alin. (11), precum şi orice alte dispoziţii contrare prevederilor prezentei
legi.
(2) Legislaţia secundară elaborată în baza Ordonanţei
de urgenţă a Guvernului nr. 152/1999, aprobată cu modificări şi completări prin
Legea nr. 336/2002, cu modificările şi completările ulterioare, rămâne în
vigoare în măsura în care nu contravine prezentului titlu.
(3) Prin excepţie de la prevederile alin. (1),
următoarele prevederi se abrogă la 3 zile de la data publicării prezentei legi:
a) art. 231 din
Ordonanţa de urgenţă a Guvernului nr. 152/1999, aprobată cu modificări şi
completări de Legea nr. 336/2002, cu modificările şi completările ulterioare;
b) art. 9 pct. 2 lit. a) subpct. (iii) din anexa nr.
1 „Reglementări privind autorizarea de punere pe piaţă şi supravegherea
produselor medicamentoase de uz uman" la Ordinul ministrului sănătăţii şi
familiei nr. 263/2003 pentru aprobarea Reglementărilor privind autorizarea de
punere pe piaţă, supravegherea, publicitatea, etichetarea şi prospectul
produselor medicamentoase de uz uman, publicat în
Monitorul Oficial al României, Partea I, nr. 336 şi
nr. 336 bis din 19 mai 2003;
c) Ordinul ministrului sănătăţii nr. 1.443/2004
privind aprobarea Normelor de aplicare a prevederilor Ordonanţei de urgenţă a
Guvernului nr. 152/1999 privind produsele medicamentoase de uz uman, aprobată
cu modificări şi completări prin Legea nr. 336/2002, cu modificările şi
completările ulterioare, referitoare la exclusivitatea datelor, publicat în
Monitorul Oficial al României, Partea I, nr. 1.077 din
19 noiembrie 2004.
Art. 862. - Următoarele prevederi ale prezentului titlu
se abrogă la data aderării României la Uniunea Europeană;
- art. 700 alin. (2);
- art. 730 alin. (3);
- art. 733;
- art. 735 alin. (2);
- art. 787 alin. (1).
Prezentul titlu transpune
Directiva 2001/83/CE din 6 noiembrie 2001 instituind codul comunitar al
medicamentelor de uz uman, publicată în J.O. nr. L 311 din 28 noiembrie 2001,
cu excepţia anexei, amendată prin: Directiva 2002/98/CE din 27 ianuarie 2003
care stabileşte standardele de calitate şi siguranţă pentru colectarea,
testarea, procesarea, depozitarea şi distribuirea sângelui uman şi
componentelor din sânge, care modifică Directiva 2001/83/CE, publicată în J.O. nr. L 33 din 8 februarie 2003,
Directiva 2004/24/CE din 31 martie 2004 care modifică Directiva 2001/83/CE în
ceea ce priveşte medicamentele din plante medicinale tradiţionale, publicată în
J.O. nr. L 136 din 30 aprilie 2004, şi Directiva 2004/27/CE din 31 martie 2004
care modifică Directiva 2001/83/CE, publicată în J.O. nr. L 136 din 30 aprilie
2004.
Art. 863. - Prezenta lege intră în vigoare astfel:
a) la 3 zile de la publicare: titlul XI „Finanţarea unor cheltuieli de sănătate", titlul XII
„Exercitarea profesiei de medic. Organizarea şi funcţionarea Colegiului
Medicilor din România", titlul XIII „Exercitarea profesiei de medic
dentist. Organizarea şi funcţionarea Colegiului Medicilor Dentişti din
România", titlul XIV „Exercitarea profesiei de farmacist. Organizarea şi
funcţionarea Colegiului Farmaciştilor din România", precum şi art. 704
alin. (2) şi art. 852;
b) la 30 de zile de la publicare: titlul I „Sănătatea publică", titlul II „Programele naţionale de sănătate", titlul V „Asistenţa medicală comunitară",
titlul VII „Spitalele", titlul VIII „Asigurările sociale de
sănătate", titlul XVI „Infiinţarea, organizarea şi funcţionarea Şcolii
Naţionale de Sănătate Publică şi Management Sanitar";
c) la 90 de zile de la publicare: titlul III
„Asistenţa medicală primară", titlul IV „Sistemul naţional de asistenţă medicală de urgenţă şi de prim
ajutor calificat", titlul VI „Efectuarea prelevării şi transplantului de organe, ţesuturi şi
celule de origine umană în scop terapeutic", titlul IX „Cardul european şi cardul naţional de
asigurări sociale de sănătate", titlul X „Asigurările voluntare de sănătate", titlul XV „Răspunderea civilă a personalului
medical şi a furnizorului de produse şi servicii medicale, sanitare şi
farmaceutice", titlul XVII „Medicamentul";
d) de la data aderării României la Uniunea Europeană:
art. 700 alin. (1), art. 702 alin. (2), art. 704 alin. (5), art. 710 alin. (2),
art. 716 alin. (1) lit. c), art. 716 alin. (4), art. 717 alin. (2), art. 718
alin. (2), art. 719 alin. (1), art. 721 alin. (1) şi (3), art. 722 alin. (1)
teza a doua, art. 722 alin. (2), art. 723, art. 726
alin. (3), art. 726 alin. (4) teza a doua, art. 727 alin. (3), art. 730 alin.
(5)-(8), art. 735 alin. (1), art. 736-747, art. 748 alin. (4), art. 749 alin.
(1) lit. b), art. 759 alin. (1), art. 767, art. 768, art. 769 alin. (1) lif. f)
pct. (vi), art. 769 alin. (1) lit. g), art. 769 alin. (3), art. 771 alin. (3),
art. 775, art. 785, art. 786, art. 787 alin. (3) lit. a), art. 787 alin. (4),
art. 788 alin. (4), art. 788 alin. (6) teza a doua, art. 788 alin. (7), art.
791 lit. g), art. 792 alin. (1), art. 792 alin. (3),
art. 813, art. 814, art. 816 alin. (6) teza a doua, art. 817, art. 822, art.
823 alin. (4), art. 823 alin. (6)-(8), art. 839, art. 840 alin. (2)-(4), art.
844, art. 845 alin. (2) şi art. 848;
e) la 6 luni de la data aderării
României la Uniunea Europeană: art. 320-329;
f) la un an de la data aderării României la Uniunea
Europeană: art. 766.
Această lege a fost adoptată în temeiul prevederilor
art. 114 alin. (3) din Constituţia României, republicată, în urma angajării răspunderii
Guvernului în faţa Camerei Deputaţilor şi a Senatului, în şedinţa comună din
data de 21 februarie 2006.
PREŞEDINTELE CAMEREI
DEPUTAŢILOR
ADRIAN
NĂSTASE
PREŞEDINTELE SENATULUI
NICOLAE VĂCĂROIU
ANEXA Nr. 1
DECLARAŢIE
Subsemnatul (subsemnata)
.................................................., informat (informată) şi
conştient (conştientă) asupra riscurilor donării de organe şi/sau ţesuturi şi/sau celule, în
concordanţă cu dispoziţiile legale în vigoare, declar că sunt de acord cu donarea următoarelor organe
şi/sau ţesuturi şi/sau celule: ......................... pentru efectuarea
procedurilor de transplant
către ........................................., care
este ................................... (gradul de rudenie DA/NU).
Inţeleg gestul meu ca fiind un act profund umanitar.
Asupra mea nu au fost făcute nici un fel de presiuni. Nu condiţionez această
donare de obţinerea vreunei recompense materiale pentru mine, familia mea sau
terţe persoane.
Data..............................................................................
Donatorul
....................................................................
Primitorul ....................................................................
Comisia de avizare a donării de la donatorul viu -
membri:
1............................................................................
2.............................................................................
3...........................................................................
ANEXA Nr. 2
DECLARAŢIE
Subsemnatul (subsemnata)
..................................................................... (tatăl,
mama, reprezentantul legal) al
numitului (numitei)
.........................................................., minor (minoră),
informat (informată) şi conştient (conştientă) asupra riscurilor prelevării de celule suşe (stern) hematopoietice
medulare sau periferice, în concordanţă cu dispoziţiile legale în vigoare
referitoare la prelevarea şi transplantul de organe, ţesuturi şi celule umane,
declar că sunt de acord cu recoltarea şi donarea de celule suşe (stern)
hematopoietice medulare sau periferice în beneficiul ..........................................................
Inţeleg gestul meu ca fiind un act profund umanitar.
Asupra mea nu au fost făcute nici un fel de presiuni.
Data
............................................................................
Tatăl ............................................................................
Mama
...........................................................................
Reprezentantul legal
..................................................
Preşedintele Tribunalului ............................................
ANEXA Nr. 3*)
CRITERII DE DIAGNOSTIC pentru confirmarea morţii
cerebrale
Datele pe care trebuie sa le conţină actul constatator
I. Diagnosticul
morţii cerebrale se stabileşte pe baza următoarelor criterii:
1. Examen clinic:
- starea de comă profundă,
flască, reactivă;
- absenţa reflexelor de trunchi cerebral.
2. Absenţa ventilaţiei spontane, confirmată de testul
de apnee (la un Pa C02 de 60 mm Hg).
3. Traseu electroencefalografic care să ateste lipsa
electrogenezei corticale.
Cele 3 examene care confirmă
moartea cerebrală se repetă la un interval de cel puţin 6 ore pentru adulţi.
Pentru copii, intervalul este de 48 ore pentru nou-născutul cu vârsta intre 7
zile-2 luni, 24 de ore pentru copilul cu vârsta intre 2 luni -2 ani si 12 ore
pentru copilul cu vârsta intre 2-7 ani. Pentru copiii cu vârsta peste 7 ani,
intervalul este acelaşi ca la adulţi. La nou-născutul cu vârsta mai mică de 7
zile nu se declară moartea cerebrală.
II. Cauza care a
determinat moartea cerebrală trebuie sa fie clar stabilită.
III. Excluderea altor cauze reversibile care ar
putea produce un tablou clinic şi un traseu EEG, asemănătoare cu cele din
moartea cerebrală (hipotermia, mai mică de 35
grade C, medicamente depresoare ale sistemului nervos central, hipotensiune
arterială - presiune arterială medie mai mică de 55 mm Hg).
IV. Diagnosticul de
moarte cerebrală va fi stabilit de doi anestezişti
reanimatori diferiţi sau de un anestezist reanimator şi un neurolog sau
neurochirurg.
*) Anexa nr. 3 este reprodusă în facsimil.
V. Diagnosticul de moarte cerebrală
va fi înregistrat în următorul protocol.
PROTOCOL DE DECLARARE A MORŢII CEREBRALE
Numele
donatorului:________________________________________vârsta:__________
F.O. nr.___________Cauza morţii cerebrale:__________________________________
_____________________________________________________________________
Debutul comei: Data:_____________ Ora:_________
Criterii de diagnosticare a morţii cerebrale:
|
EXAMEN NEUROLOGIC
Ziua
Ora
|
Evaluare
|
|
I
|
II
|
|
|
|
|
|
|
|
1) Reflex pupilar fotomotor (a se folosi lumina puternică)
|
|
|
|
2) Reflex cornean
|
|
|
|
3) Reflex de vomă
|
|
|
|
4) Relex de tuse
|
|
|
|
5) Răspuns motor în aria nervilor cranieni {a se apăsa patul
unghial, şanţul nazo-genian şi zona supraciliară)
|
|
|
|
6) Reflex oculo-cefalic (deviaţie conjugată a privirii la
mişcarea bruscă a capului în plan orizontal şi
vertical)
|
|
|
|
7) Reflex oculo-vestibular (deviaţia conjugată a privirii când se
irigă conductul auditiv extern cu 50 ml. apă la 4°C. Trebuie să te asiguri în
prealabil de integritatea timpanului)
|
|
|
|
8) Evaluarea respiraţiei spontane:
|
|
|
- prezenţa mişcărilor respiratorii
spontane
|
|
|
|
- testul de apnee:
1. se preoxigenează pacientul timp de 10 min cu oxigen 100%
2. se realizează gazometria:PaC02 bazai trebuie să fie 36-40
mmHg.
3. se deconectează pacientul de la ventilator timp de 10 min.
Se menţine sonda de oxigen cu un debit de 6-12 l/min pe sondă endotraheală
4. se realizează din nou gazometria: PaC02 trebuie să fie minim
60 mmHg la sfârşitul perioadei de deconectare
|
|
PaC02
|
pH
|
Pa02
|
|
0'
|
I
|
|
|
|
|
II
|
|
|
|
|
5'
|
I
|
|
|
|
|
II
|
|
|
|
|
10'
|
I
|
|
|
|
|
II
|
|
|
|
|
15'
|
I
|
|
|
|
|
II
|
|
|
|
|
- prezenţa mişcărilor respiratorii spontane
|
|
|
Electroencefalograma:
A = Medic Primar ATI B = Medic Primar
Neurolog, Neurochirurg sau ATI
ANEXA Nr. 4
DECLARAŢIE
Subsemnatul (subsemnata) ...................................................................., în calitate de
soţ/soţie, părinte, copil major, frate, soră a numitului (numitei)
.................................................., decedat (decedată), declar
că sunt de acord cu recoltarea şi cu donarea următoarelor organe şi/sau ţesuturi şi/sau celule:
...........................................................................................
Declar că înţeleg gestul meu ca fiind un act profund
umanitar şi nu am nici un fel de pretenţii materiale sau de altă natură.
Data ........................................
Reprezentantul donatorului
....................................... (gradul de rudenie)
ANEXA Nr. 5
DECLAR AŢIE-DECIZIE
Subsemnatul (subsemnata)
......................................................................,
informat (informată) şi conştient (conştientă) asupra riscurilor şi beneficiului transplantului de organe,
ţesuturi şi celule umane, în concordanţă cu dispoziţiile legale în vigoare
referitoare la prelevarea şi transplantul de organe, ţesuturi şi celule umane,
declar că sunt de acord cu înscrierea mea ca donator voluntar post-mortem
pentru următoarele organe, ţesuturi şi celule:
........................................................
Sunt de acord cu investigarea mea periodică şi gratuită
privind starea mea de sănătate.
Potrivit legii, asupra hotărârii mele pot reveni
oricând, cu condiţia ca actul scris de revenire să fie semnat şi de doi
martori.
Data...............................................................................
Semnătura
...................................................................
Notar
............................................................................
ANEXA Nr. 6*)
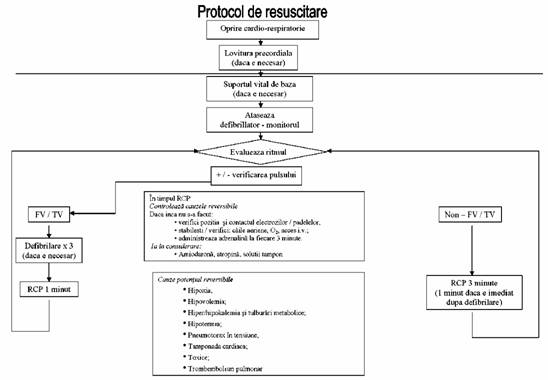
Anexa nr. 6 este reprodusă în facsimil.
ANEXA Nr. 7
ROMÂNIA
MINISTERUL SĂNĂTĂŢII PUBLICE
AGENŢIA NAŢIONALĂ DE TRANSPLANT
Nr............................/Data
.........................
AUTORIZAŢIE DE EXPORT
Având în vedere faptul că pe teritoriul României nu
există nici un primitor compatibil pentru următoarele organe şi/sau ţesuturi
şi/sau celule de origine umană şi/sau alte elemente ori produse ale corpului
uman ......................... în baza art. 3 lit. k) din Ordonanţa Guvernului nr. 79/2004 pentru
înfiinţarea Agenţiei Naţionale de Transplant, aprobată cu modificări şi completări
prin Legea nr. 588/2004, şi în baza art. 12 lit. k) şi art. 21 lit. j) din
Ordinul ministrului sănătăţii nr. 183/2005 privind aprobarea Regulamentului de
organizare şi funcţionare, a organigramei şi a componenţei Consiliului
ştiinţific al Agenţiei Naţionale de Transplant, cu modificările şi completările
ulterioare,
se autorizează echipa de transplant
...................................... condusă de prof.
dr...................................., legitimat cu paşaport nr............................., pentru prelevarea şi
transportul către ........................................ a următoarelor
organe şi/sau ţesuturi şi/sau
celule umane
.......................................................................,
recoltate de la un donator decedat la
Spitalul
......................................................., pentru utilizare
terapeutică.
Preşedintele Consiliului ştiinţific al Agenţiei
Naţionale de Transplant,
......................................................................................................................
Directorul executiv al Agenţiei Naţionale de
Transplant,
.........................................................................................
Jurist al Agenţiei Naţionale de Transplant,
............................................................................................
ANEXA Nr. 8
DECIZIE
Prelevarea în scop terapeutic de la cadavrul
............................................ din spaţiul
........................................... a următoarelor organe .......................................................,
ţesuturi ........................................... şi celule
......................................, în vederea efectuării procedurilor de transplant, nu afectează
rezultatele autopsiei medico-legale.
Data şi ora
.................................................................
Medic legist
................................................................
ANEXA Nr. 9
ROMÂNIA
MINISTERUL SĂNĂTĂŢII PUBLICE
AGENŢIA NAŢIONALĂ DE TRANSPLANT
Nr............................/Data
.........................
AUTORIZAŢIE DE IMPORT
Având în vedere faptul că pe teritoriul României nu
există nici un organ şi/sau ţesut şi/sau celulă şi/sau alt element sau produs al corpului uman ....................................................................... compatibile şi disponibile
pentru pacientul
.................................................... cu diagnosticul
........................................................................................................,
în baza art. 3 lit. k) din Ordonanţa Guvernului nr.
79/2004 pentru înfiinţarea Agenţiei Naţionale de Transplant, aprobată cu
modificări şi completări prin Legea nr. 588/2004, şi în baza art. 12 lit. k) şi
art. 21 lit. j) din Ordinul ministrului sănătăţii nr. 183/2005 privind
aprobarea Regulamentului de organizare şi funcţionare, a organigramei şi a
componenţei Consiliului ştiinţific al Agenţiei Naţionale de Transplant, cu
modificările şi completările ulterioare,
se autorizează importul (organ, ţesut, celulă, alte
elemente sau produse ale corpului uman) .................................. de la
...................................... din ţara
....................................... pentru a fi utilizat în scop terapeutic
în (secţia/spitalul) Autorizaţia
s-a eliberat ca urmare a cererii înaintate de către (secţia, spitalul)
................................................., înregistrată cu nr................................................
la data de ..........................................
Preşedintele Consiliului ştiinţific al Agenţiei
Naţionale de Transplant,
.............................................................................................................
Directorul executiv al Agenţiei Naţionale de
Transplant,
......................................................................................
Jurist al Agenţiei Naţionale de Transplant,
………………………………………..
ANEXA Nr. 10*)
Fişă prelevare organe şi ţesuturi
|
Evaluare renală
|
Evaluare pulmonară
|
Evaluare hepatică
|
|
|
|
La internare Actual
Uree Creatinină
Sediment urinar
Urocultura
Diureză
ultima ora
ultimele 24 ore
Diabet insipid (DA/NU)
Tratament
Tipizare HLA
|
Zile de intubare
Secreţii
Traumatism toracic (DA/NU)
Caracteristici
|
Bilirubina directa
|
|
|
|
Bilirubina totală
|
|
|
|
Colesterol
|
|
|
|
Tric-liceride
|
|
|
|
TGO
|
|
|
|
LDH
|
|
|
|
TGP
|
|
|
|
Fibrinogen
|
|
|
|
Albumine
|
|
|
|
Proteine totale
|
|
|
|
Evaluare pancreatică
Amilaze
Lipaze
Glicemie
|
|
|
Gazometrle Data/ora
|
|
|
Fi02
|
|
|
p02
|
|
|
pC02
|
|
|
PH
|
Evaluare cardiacă şi ci rculatorie
Prelevare Ora;
Minut:
TA
Sist Diast
Frecvenţa cardiacă
Hipolensiune (DA/NU)
Caracteristici
Stop cardiac (DA/NU)
Durata
Resuscitare
CPK CPK-MB
PVC
|
|
|
HC03
|
|
|
Prelevare plete
Suprafaţa
Ora
Prelevare cornee
Ora
|
Sat 02
|
|
|
Măsurători pe Rx toracic
De la sinusul costofrenic drept la cel
stâng
cm:
De la sinusul costofrenlc la apexul
pulmonar
drept cm:
stâng cm:
|
|
|
Prelevare oase/tendoane
Ora
Enumerare
Prelevare alte ţesuturi
Ora
|
|
|
|
Medic coordonator transplant
|
|
FIŞA PENTRU DECLARAREA DONATORULUI
|
Numele donatorului
|
Grup
|
Vârstă
|
Sex
|
Greutate
|
Inălţime
|
Perimetre
|
Data
|
|
Ora
|
|
Ora clamparii aortei
|
|
|
Rh
|
|
|
|
|
Toracic
|
|
Centrul
|
|
|
CNP
|
|
|
Abdominal
|
|
Telefoane de contact
|
|
|
Prima declarare a A doua
declarare a morţii cerebrale morţii cerebrale
Consimţământul familiei
|
Diagnostic
|
Organe oferite
|
|
|
|
|
|
Organe prelevate
|
|
|
Depistare maladii transmisibile
AgHBs HCV Ag HIV
Ac HIV
CMV Lues Test sarcina
Toxoplasmozâ Epstein-Barr
|
Ţesuturi/celule prelevate
|
|
|
Antecedente
|
lonogramă
Na+ K+
CI+ Ca+
|
|
|
Medicaţie
Dopamină
Din data de
Noradrenalină
Din data de
Antibiotice
Din data de
Altele
Din data de
|
|
|
Coagulare
Timpul Quick
Trombocite Fibrinogen
|
Hemogramă
Hb
Ht
Hematii
Transfuzii
|
|
|
Examene Complementare
Rx toracic
EKG
Ecografie
Tomografie computerizata
Altele
|
|
|
Leucogramă
Neutrofile
segmentate
nesegmentate Limfocile
Monocite
Eazinofile
Bazofile
|
|
|
|
Temperatura
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
*) Anexa nr. 10 este reprodusă în facsimil.
ANEXA Nr. 11
DECLARAŢIE
Subsemnatul (subsemnata)
.......................................... informat (informată) şi conştient
(conştientă) asupra riscurilor şi beneficiului transplantului de organe, ţesuturi şi celule umane,
în concordanţă cu dispoziţiile legale în vigoare referitoare la prelevarea şi
transplantul de organe, ţesuturi şi celule umane, declar că sunt de acord cu
primirea următoarelor organe şi/sau ţesuturi şi/sau celule umane:
.................................................
Data ............................................................................
Semnătura reprezentantului legal .............................
ANEXA Nr. 12
DECLAR AŢIE-DECIZIE
Conducerea secţiei
......................................................... din spitalul
............................................. a
încercat prin toate mijloacele uzuale să ia legătura
cu familia (urmaşii, reprezentanţii legali) numitului (numitei)
.........................................., aflat (aflată) pe lista de aşteptare în vederea transplantului de
................................................................................................
Intrucât acest lucru nu a fost posibil în intervalul de timp avut
la dispoziţie, pentru evitarea decesului primitorului, s-a hotărât începerea
transplantului în ziua de ............, ora ..........
Data
............................................................................
Medic şef de secţie
...................................................
Medic curant
...............................................................
ANEXA Nr. 13
DECLARAŢIE
Subsemnatul (subsemnaţii)
.................................................................., părinţi
(copil major, frate, soră, reprezentanţi legali) ai
numitului (numitei) ................................................................., minor (minoră) [handicapat (handicapată) mintal], informat (informaţi) şi conştient
(conştienţi) asupra riscurilor şi beneficiului transplantului de organe,
ţesuturi şi celule umane, în concordanţă cu dispoziţiile legale în vigoare
referitoare la prelevarea şi transplantul de organe, ţesuturi şi celule umane,
declar (declarăm) că sunt (suntem) de acord cu primirea următoarelor organe
şi/sau ţesuturi şi/sau celule umane:
............................................................... pentru ...................................
Data
.............................................................................
Semnătura reprezentantului legal ..............................
Medic sef de secţie
...................................................