Ordinul Nr.1508 din 19.12.2016privind modificarea şi completarea Normelor de aplicare a prevederilor art. 699 alin. (1) şi (2) din Legea nr. 95/2006 privind reforma în domeniul sănătăţii referitoare la medicamentele utilizate pentru rezolvarea unor nevoi speciale, aprobate prin Ordinul ministrului sănătăţii nr. 85/2013
ACT EMIS DE: Ministerul Sanatatii
ACT PUBLICAT ÎN MONITORUL OFICIAL NR. 13 din 06 ianuarie 2017
Văzând Referatul de aprobare al Direcţiei politica medicamentului şi a dispozitivelor medicale din cadrul Ministerului Sănătăţii nr. V.V.V. 7.262 din 2016,având în vedere prevederile art. 703 din Legea nr. 95/2006 privind reforma în domeniul sănătăţii, republicată, cu modificările şi completările ulterioare,în temeiul art. 7 alin. (4) din Hotărârea Guvernului nr. 144/2010 privind organizarea şi funcţionarea Ministerului Sănătăţii, cu modificările şi completările ulterioare,ministrul sănătăţii emite următorul ordin: Articolul INormele de aplicare a prevederilor art. 699 alin. (1) şi (2) din Legea nr. 95/2006 privind reforma în domeniul sănătăţii referitoare la medicamentele utilizate pentru rezolvarea unor nevoi speciale, aprobate prin Ordinul ministrului sănătăţii nr. 85/2013, publicat în Monitorul Oficial al României, Partea I, nr. 93 din 14 februarie 2013, se modifică şi se completează după cum urmează: 1. Articolul 18 se abrogă. 2. După articolul 18 se introduce un nou capitol, capitolul III, cuprinzând articolele 19-34, cu următorul cuprins: Capitolul IIIModalităţile de stabilire a preţului medicamentelor utilizate pentru rezolvarea unor nevoi speciale Articolul 19(1) În sensul prezentelor norme, termenii şi expresiile de mai jos au următoarele semnificaţii:a)codul de identificare a medicamentului, denumit în continuare CIM - cod alfa-numeric generat automat la introducerea autorizaţiei privind furnizarea de medicamente pentru nevoi speciale (denumită în continuare ANS) în Nomenclatorul medicamentelor de uz uman de către Agenţia Naţională a Medicamentelor şi a Dispozitivelor Medicale (denumită în continuare ANMDM); b)minister - Ministerul Sănătăţii; c)preţ supus aprobării ministerului - preţul de producător, adică preţul CIP (Carriage and Insurance Paid to - transport şi asigurare plătite până la [locul de destinaţie convenit]) conform clauzelor internaţionale de comerţ INCOTERMS 2000; d)reprezentant - persoana fizică sau juridică desemnată de către deţinătorul ANS să îl reprezinte în relaţia cu ministerul în legătură cu oricare dintre aspectele privind stabilirea preţurilor la medicamentele de uz uman; e)ţară de origine - ţara de producţie care eliberează seria de produs finit pentru un medicament de uz uman, aşa cum rezultă din cuprinsul ANS. (2) Referirile la deţinătorul ANS în cuprinsul prezentei metodologii sunt aplicabile în mod corespunzător şi reprezentantului acestuia, cu excepţia prevederilor art. 24 alin. (2). Articolul 20(1) Prezentele norme reglementează preţurile maximale de producător, cu ridicata şi cu amănuntul, ale medicamentelor de uz uman pentru care s-a emis ANS.(2) Deţinătorul ANS solicită aprobarea preţului de producător maximal, iar ministerul aprobă preţul de producător maximal, precum şi preţul cu ridicata maximal şi preţul cu amănuntul maximal, cu aplicarea cotelor de adaos prevăzute de prezentele norme.(3) Ordinul privind aprobarea preţului medicamentului sau notificarea de respingere a propunerii de preţ la care se face referire în cuprinsul prezentelor norme se emite având la bază un document intern de avizare a preţului respectivului medicament emis la nivelul ministerului.(4) Pentru efectuarea oricărei analize comparative de preţ, transformarea preţurilor de producător din alte valute în lei se face luându-se în considerare cel mai recent curs mediu de schimb valutar al Băncii Naţionale a României stabilit pentru trimestrul al treilea.(5) Pe pagina de internet a ministerului vor fi publicate cursurile de schimb necesare în vederea efectuării analizei comparative de preţ.(6) Cu excepţia cazului în care se prevede altfel în prezenta metodologie, în scopul aplicării prezentei metodologii, preţurile, atât cele propuse, cât şi cele aprobate, vor fi exprimate prin două zecimale, fără rotunjire, iar valoarea cursului de schimb valutar utilizat în vederea calculării preţului va fi exprimat prin patru zecimale. Articolul 21(1) Deţinătorii ANS ai medicamentelor utilizate pentru rezolvarea unor nevoi speciale vor solicita Ministerului Sănătăţii aprobarea preţului, depunând următoarele documente, cu respectarea prezentelor norme:a)cerere-tip, conform anexei nr. 5, în original, prin care deţinătorul ANS solicită aprobarea nivelului de preţ de producător propus în lei, cu respectarea prezentelor norme; b)copie a ANS; c)extrasul «Detalii medicament» de pe pagina de internet a ANMDM, inclusiv CIM; d)comparaţia cu preţul de producător autorizat în:
|
|
(i) |
Republica Cehă; |
|
|
(ii) |
Republica Bulgaria; |
|
|
(iii) |
Republica Ungară; |
|
|
(iv) |
Republica Polonă; |
|
|
(v) |
Republica Slovacă; |
|
|
(vi) |
Republica Austria; |
|
|
(vii) |
Regatul Belgiei; |
|
|
(viii) |
Republica Italiană; |
|
|
(ix) |
Lituania; |
|
|
(x) |
Spania; |
|
|
(xi) |
Grecia; |
|
|
(xii) |
Germania, |
cu prezentarea de către deţinătorul ANS de copii de pe toate cataloagele existente pe pieţele respective, în vigoare la data depunerii documentaţiei; e)declaraţie pe propria răspundere a deţinătorului ANS, conform anexei nr. 6, în original; f)pentru situaţia prevăzută la art. 22 alin. (3), documentaţia depusă include şi o copie de pe catalogul de preţuri din ţara de origine, însoţită de o traducere autorizată în limba română a metodologiei de calcul al preţului, care va include formula de calcul al preţului de producător în ţara de origine, dacă există. (2) Documentaţia prevăzută la alin. (1) se va depune în format letric şi electronic.(3) În vederea aprobării preţului, deţinătorul ANS va identifica medicamentul în conformitate cu ANS eliberată de ANMDM.(4) Fără a aduce atingere obligaţiei deţinătorului ANS prevăzute la alin. (1) lit. d), pe pagina de internet a ministerului se publică cataloagele de preţ sau, dacă nu este posibil, sursele pentru cataloagele de preţ sau bazele de date, precum şi metodologia privind calculul preţului, existente pe pieţele din ţările de comparaţie prevăzute la alin. (1) lit. d), necesare în vederea efectuării analizei comparative a preţurilor medicamentelor, precum şi actualizarea preţurilor. Articolul 22(1) Deţinătorul ANS propune spre aprobare ministerului preţul de producător maximal, exprimat în lei.(2) Preţul de producător propus de către deţinătorul ANS trebuie să fie mai mic sau cel mult egal cu cel mai mic preţ al aceluiaşi medicament din lista ţărilor cu care se efectuează comparaţia, prevăzută la art. 21 alin. (1) lit. d).(3) Dacă medicamentul nu are preţ în niciuna dintre ţările prevăzute la art. 21 alin. (1) lit. d), preţul se compară cu cel din ţara de origine, trebuind să fie mai mic sau cel mult egal cu preţul aceluiaşi medicament din ţara de origine.(4) Dacă medicamentul nu are preţ înregistrat în ţările de comparaţie prevăzute la alin. (3) şi art. 21 alin. (1) lit. d), se aprobă preţul propus. Articolul 23În vederea realizării comparaţiei de preţ conform art. 21, se va lua în considerare preţul medicamentului pentru aceeaşi concentraţie şi formă farmaceutică, având în vedere următoarele criterii alternative, aşa cum rezultă din extrasul «Detalii medicament» de pe pagina de internet a ANMDM, care vor fi aplicate în următoarea ordine: a)denumirea comercială şi producătorul; b)denumirea comună internaţională şi producătorul; c)denumirea comercială şi denumirea comună internaţională; d)sistemul de clasificare anatomică, terapeutică şi chimică (nivelul de cod ATC 5) şi producătorul. Articolul 24(1) În situaţia în care preţul medicamentului în ţările de comparaţie este înregistrat la aceeaşi concentraţie, dar la altă mărime de ambalare, se va lua în comparaţie mărimea de ambalare care este cel mult de 2,5 ori mai mică sau mai mare faţă de mărimea de ambalare pentru care se solicită aprobarea preţului în România. Preţul va fi stabilit în mod direct proporţional cu preţul medicamentului a cărui mărime de ambalare este luată în comparaţie.(2) În cazul medicamentelor cu aceeaşi concentraţie ale aceluiaşi deţinător ANS pentru care există deja forme de ambalare cu preţ aprobat în Canamed şi pentru care se solicită preţ pentru alte forme de ambalare, preţul propus pentru noua formă de ambalare se stabileşte având în vedere regula conform căreia preţul pentru forma de ambalare mai mică trebuie să fie inferior preţului pentru forma de ambalare mai mare. Articolul 25(1) În termen de 45 de zile de la primirea documentaţiei prevăzute la art. 21 alin. (1) depuse de către deţinătorul ANS, ministerul va emite şi va comunica deţinătorului ANS ordinul privind aprobarea preţului medicamentului sau notificarea de respingere a propunerii de preţ.(2) Actele prevăzute la alin. (1) sunt motivate pe baza criteriilor obiective şi justificabile prevăzute de prezentele norme şi vor preciza căile de atac care pot fi exercitate împotriva acestora conform legislaţiei în vigoare, precum şi termenul în care acestea pot fi exercitate.(3) Dacă informaţiile din cadrul documentaţiei nu sunt adecvate în vederea aprobării preţului conform prezentelor norme, ministerul înştiinţează deţinătorul ANS asupra acestui aspect, în maximum 15 zile de la depunere, şi solicită completarea dosarului cu informaţiile detaliate suplimentare care sunt necesare, urmând a lua decizia finală în termen de 30 de zile de la primirea informaţiilor suplimentare solicitate. Completarea dosarului se realizează de către deţinătorul ANS în termen de maximum 15 zile de la comunicarea solicitării din partea ministerului.(4) În lipsa emiterii ordinului de aprobare a preţului sau a notificării privind respingerea propunerii de preţ, după caz, în cadrul perioadei mai sus menţionate, deţinătorul ANS are dreptul să comercializeze medicamentele la preţul propus, cu condiţia ca depăşirea termenului să nu fie imputabilă deţinătorului ANS. Articolul 26(1) În cazul în care preţul propus de către deţinătorul ANS nu este în conformitate cu prezentele norme, se comunică deţinătorului ANS o notificare de respingere a propunerii de preţ, cuprinzând motivele neaprobării preţului propus, precum şi nivelul preţului calculat de minister conform prezentelor norme, care poate fi contestată de către deţinătorul ANS în termen de 15 zile calendaristice de la data comunicării acesteia.(2) Contestaţiile se depun la minister şi se soluţionează prin emiterea unui act administrativ, comunicat contestatarului în termen de 15 zile de la data înregistrării contestaţiei.(3) În măsura în care deţinătorul ANS prezintă documente conţinând detalii suplimentare, justificabile privind nivelul preţului propus de acesta, ministerul poate aproba preţul propus.(4) În cazul în care deţinătorul ANS nu contestă în termen de 30 de zile notificarea de respingere a propunerii de preţ, preţul stabilit de minister şi comunicat conform alin. (1) se consideră acceptat de către deţinătorul ANS. Articolul 27(1) Preţul aprobat conform prevederilor prezentului capitol este valabil până la expirarea perioadei de valabilitate a ANS.(2) Preţul medicamentelor utilizate pentru rezolvarea unor nevoi speciale aprobate conform prezentelor norme se publică în Canamed. Articolul 28(1) Pentru calcularea preţului cu ridicata maximal se aplică următoarele formule de calcul:a)în cazul în care preţul de producător maximal este până la 300,00 lei, în conformitate cu grilele prezentate la art. 29 din prezentele norme, pe intervalele între 0-300,00 lei formula de calcul este: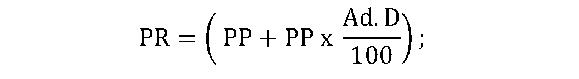 b)în cazul în care preţul de producător maximal este peste 300,00 lei, în conformitate cu grilele prezentate la art. 29 din prezentele norme, formula de calcul este:PR = PP + 30 lei, în care: – PP = preţul de producător maximal; – PR = preţul cu ridicata maximal; – Ad.D = cota maximă de adaos, utilizată în scopul calculării preţului cu ridicata maximal de distribuţie, conform art. 29. (2) Pentru calcularea preţului cu amănuntul maximal fără TVA se aplică următoarele formule de calcul:a)în cazul în care preţul cu ridicata maximal este până la 300,00 lei, în conformitate cu grilele prezentate la art. 30 din prezentele norme, pe intervalele între 0-300,00 lei formula de calcul este: b)în cazul în care preţul de producător maximal este peste 300,00 lei, în conformitate cu grilele prezentate la art. 29 din prezentele norme, formula de calcul este:PR = PP + 30 lei, în care: – PP = preţul de producător maximal; – PR = preţul cu ridicata maximal; – Ad.D = cota maximă de adaos, utilizată în scopul calculării preţului cu ridicata maximal de distribuţie, conform art. 29. (2) Pentru calcularea preţului cu amănuntul maximal fără TVA se aplică următoarele formule de calcul:a)în cazul în care preţul cu ridicata maximal este până la 300,00 lei, în conformitate cu grilele prezentate la art. 30 din prezentele norme, pe intervalele între 0-300,00 lei formula de calcul este: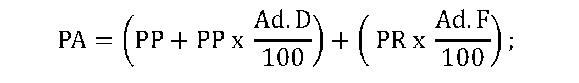 b)în cazul în care preţul cu ridicata maximal este peste 300,00 lei, în conformitate cu grilele prezentate la art. 30 din prezentele norme, formula de calcul este:PA = PR + 35 lei, în care: – PR = preţul cu ridicata maximal; – PA = preţul cu amănuntul maximal fără TVA; – Ad.F = cota maximă de adaos, utilizată în scopul calculării preţului cu amănuntul maximal de farmacie, conform art. 30. b)în cazul în care preţul cu ridicata maximal este peste 300,00 lei, în conformitate cu grilele prezentate la art. 30 din prezentele norme, formula de calcul este:PA = PR + 35 lei, în care: – PR = preţul cu ridicata maximal; – PA = preţul cu amănuntul maximal fără TVA; – Ad.F = cota maximă de adaos, utilizată în scopul calculării preţului cu amănuntul maximal de farmacie, conform art. 30.
(3) Modul de calcul al preţului cu amănuntul maximal va fi unitar pentru toate medicamentele de uz uman eliberate pe bază de prescripţie medicală, conform următoarei formule: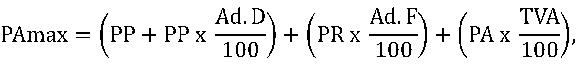 în care: – PAmax = preţul cu amănuntul maximal, inclusiv TVA; – PP = preţul de producător maximal; – PR = preţul cu ridicata maximal; – PA = preţul cu amănuntul maximal fără TVA; – Ad.D = cota maximă de adaos, utilizată în scopul calculării preţului cu ridicata maximal de distribuţie, conform art. 29; – Ad.F = cota maximă de adaos, utilizată în scopul calculării preţului cu amănuntul maximal de farmacie, conform art. 30; – TVA = nivelul cotei de TVA conform reglementărilor în vigoare. în care: – PAmax = preţul cu amănuntul maximal, inclusiv TVA; – PP = preţul de producător maximal; – PR = preţul cu ridicata maximal; – PA = preţul cu amănuntul maximal fără TVA; – Ad.D = cota maximă de adaos, utilizată în scopul calculării preţului cu ridicata maximal de distribuţie, conform art. 29; – Ad.F = cota maximă de adaos, utilizată în scopul calculării preţului cu amănuntul maximal de farmacie, conform art. 30; – TVA = nivelul cotei de TVA conform reglementărilor în vigoare.
(4) Preţurile cu amănuntul maximale se rotunjesc pe unităţi comerciale la moneda divizionară existentă în derulare pe piaţă, în favoarea sau în defavoarea preţului cu ridicata, în conformitate cu Legea nr. 348/2004 privind denominarea monedei naţionale, cu modificările şi completările ulterioare. Articolul 29Cota maximă de adaos, care se utilizează doar în scopul calculării preţului cu ridicata maximal de distribuţie, în vederea includerii în Canamed, în condiţiile prezentelor norme, se aplică preţului de producător maximal, după cum urmează: – lei -
|
Nivelul valoric al preţului de producător maximal |
Cota maximă de adaos |
|
0-49,99 |
14% |
|
50,00-99,99 |
12% |
|
100,00-299,99 |
10% |
|
peste 300,00 |
30,00 lei |
Articolul 30Cota maximă de adaos, care se utilizează doar în scopul calculării preţului cu amănuntul maximal de farmacie, în vederea includerii în Canamed, în condiţiile prezentelor norme, se aplică preţului cu ridicata maximal după cum urmează: – lei –
|
Nivelul valoric al preţului de producător maximal |
Cota maximă de adaos |
|
0-24,99 |
24% |
|
25,00-49,99 |
20% |
|
50,00-99,99 |
16% |
|
100,00-300,00 |
12% |
|
peste 300,00 |
35,00 lei |
Articolul 31În cazul prevăzut de art. 2 alin. (2) din prezentele norme, preţul medicamentului pentru nevoi speciale trebuie să fie cel mult egal cu preţul aprobat în Canamed al medicamentului autorizat de punere pe piaţă, dar care temporar nu poate fi obţinut prin canalele obişnuite de distribuţie. Articolul 32În cazul în care medicamentele utilizate pentru rezolvarea unor nevoi speciale fac obiectul unor acorduri internaţionale în baza cărora România poate realiza importurile din ţările semnatare, preţul aprobat trebuie să fie cel mult egal cu preţul de producător din ţara semnatară a acordului din care se realizează importul. Articolul 33Preţurile de producător, cu ridicata şi cu amănuntul, înscrise în Canamed, sunt preţuri maximale ale medicamentelor şi nu pot fi depăşite. Articolul 34Anexele nr. 1-6 fac parte integrantă din prezentele norme. 3 . Anexele nr. 1 - 4 se modifică şi se înlocuiesc cu anexele nr. 1, 2 , 3 și 4 la prezentul ordin. 4. După anexa nr. 4 se introduc două noi anexe, anexele nr. 5 şi 6 , având cuprinsul prevăzut în anexele nr. 5 şi 6 la prezentul ordin. Articolul IIÎn titlu şi în tot cuprinsul Ordinului ministrului sănătăţii nr. 85/2013, expresia „articolul 699 alin. (1) şi (2) din Legea nr. 95/2006 privind reforma în domeniul sănătăţii" se înlocuieşte cu expresia „articolul 703 alin. (1) şi (2) din Legea nr. 95/2006 privind reforma în domeniul sănătăţii". Articolul III În tot cuprinsul anexei la Ordinul ministrului sănătăţii nr. 85/2013, referirea la „articolul 700 din Legea nr. 95/2006 privind reforma în domeniul sănătăţii" se va citi ca referire la „articolul 704 din Legea nr. 95/2006 privind reforma în domeniul sănătăţii". Articolul IVPreţurile medicamentelor pentru nevoi speciale aprobate de Ministerul Sănătăţii anterior intrării în vigoare a prezentului ordin rămân valabile până la data expirării autorizaţiei privind furnizarea de medicamente pentru nevoi speciale. Articolul VPrezentul ordin se publică în Monitorul Oficial al României, Partea I. Ministrul sănătăţii, Vlad Vasile Voiculescu Bucureşti, 19 decembrie 2016. Nr. 1.508. ANEXA Nr. 1(Anexa nr. 1 la norme) AGENŢIA NAŢIONALĂ A MEDICAMENTULUI ŞI A DISPOZITIVELOR MEDICALE FORMULAR de solicitare a autorizaţiei pentru furnizare de medicamente pentru nevoi speciale, conform art. 703 alin. (1) din Legea nr. 95/2006 privind reforma în domeniul sănătăţii 1. Informaţii despre medicul prescriptor Numele şi prenumele: Numărul documentului de liberă practică: Codul parafei: Unitatea medicală: Adresa: Telefon: Fax: Mobil: E-mail: Declar pe propria răspundere că îmi asum responsabilitatea pentru utilizarea medicamentului ........ ................ ................, conform justificării medicale anexate, cunoscând faptul că nu este autorizat de punere pe piaţă în România, conform legii. Medic prescriptor, ........ ................ ........... (semnătura şi parafa) Data ........ ......... 2. Informaţii despre pacient Numele şi prenumele: Act de identitate: CNP: Adresa: Telefon: Fax: Mobil: E-mail: Data naşterii: Diagnosticul: Declar pe propria răspundere că am luat la cunoştinţă că medicamentul ........ ................ ................ nu deţine autorizaţie de punere pe piaţă în România, conform legii, şi sunt de acord cu efectuarea tratamentului. Am fost informat cu privire la reacţiile adverse posibile şi cu privire la modalitatea de raportare a acestora şi mă angajez să suport contravaloarea medicamentului. Pacient, ........ ................ ........... (semnătura) Data ........ ........ 3. Informaţii despre medicamentul pentru nevoi speciale Denumirea comercială: Substanţa activă (DCI): Concentraţie: Forma farmaceutică: Fabricantul şi ţara de origine: Cantitatea solicitată*):*) Se prescrie cantitatea pentru cel mult un an. Indicaţii privind administrarea (posologia): Reacţii adverse şi precauţii privind administrarea: 4. Informaţii despre solicitant Denumirea distribuitorului angro: Adresa: Numărul autorizaţiei de distribuţie angro: Persoana calificată (date de contact): Telefon: Fax: E-mail: Solicităm eliberarea unei autorizaţii pentru furnizarea medicamentului de mai sus în cantitatea solicitată. Declarăm că ne angajăm să respectăm prevederile legale privind furnizarea de medicamente fără autorizaţie de punere pe piaţă în România, pentru nevoi speciale, conform art. 703 alin. (1) din Legea nr. 95/2006 privind reforma în domeniul sănătăţii, republicată, cu modificările şi completările ulterioare. Solicitant, ........ ................ ........... (semnătura şi ştampila) Data: ........ ........... NOTĂ: Acest formular de solicitare este valabil numai însoţit de toate documentele menţionate la art. 6 alin. (1) din Normele de aplicare a prevederilor art. 703 alin. (1) şi (2) din Legea nr. 95/2006 privind reforma în domeniul sănătăţii referitoare la medicamentele utilizate pentru rezolvarea unor nevoi speciale, aprobate prin Ordinul ministrului sănătăţii nr. 85/2013, cu modificările şi completările ulterioare. ANEXA Nr. 2(Anexa nr. 2 la norme) AGENŢIA NAŢIONALĂ A MEDICAMENTULUI ŞI A DISPOZITIVELOR MEDICALE FORMULAR de solicitare a autorizaţiei pentru furnizare de medicamente pentru nevoi speciale, conform art. 703 alin. (2) din Legea nr. 95/2006 privind reforma în domeniul sănătăţii 1. Informaţii despre medicamentul pentru nevoi speciale: Denumirea comercială: Substanţa activă (DCI): Concentraţie: Forma farmaceutică: Fabricantul şi ţara de origine: Cantitatea solicitată*):*) Se precizează cantitatea pentru cel mult un an. Indicaţii privind administrarea: Reacţii adverse şi precauţii privind administrarea: 2. Informaţii despre solicitant: Denumirea distribuitorului angro: Adresa: Numărul autorizaţiei de distribuţie angro: Persoana calificată (date de contact): Telefon: Fax: E-mail: Solicităm eliberarea unei autorizaţii pentru furnizarea medicamentului de mai sus în cantitatea precizată. Declarăm că ne angajăm să respectăm prevederile legale privind furnizarea de medicamente fără autorizaţie de punere pe piaţă în România, pentru nevoi speciale, conform art. 703 alin. (2) din Legea nr. 95/2006 privind reforma în domeniul sănătăţii, republicată, cu modificările şi completările ulterioare. Solicitant, ........ ................ ........... (semnătura şi ştampila) Data: ........ ......... NOTĂ: Acest formular de solicitare este valabil numai însoţit de toate documentele menţionate la art. 14 alin. (1) din Normele de aplicare a prevederilor art. 703 alin. (1) şi (2) din Legea nr. 95/2006 privind reforma în domeniul sănătăţii referitoare la medicamentele utilizate pentru rezolvarea unor nevoi speciale,, aprobate prin Ordinul ministrului sănătăţii nr. 85/2013, cu modificările şi completările ulterioare. ANEXA Nr. 3(Anexa nr. 3 la norme) AGENŢIA NAŢIONALĂ A MEDICAMENTULUI ŞI A DISPOZITIVELOR MEDICALE AUTORIZAŢIE privind furnizarea de medicamente pentru nevoi speciale conform art. 703 alin. (1) din Legea nr. 95/2006 privind reforma în domeniul sănătăţii Nr. ....... din ................ Având în vedere Solicitarea cu nr. ............ din ........ ........, depusă la Agenţia Naţională a Medicamentului şi a Dispozitivelor Medicale, distribuitorul ........ ........ ......... este autorizat pentru furnizarea medicamentului ........ ................ ................ ................ ................ ................ ................ ................ ............, (denumirea comercială, forma farmaceutică şi concentraţia) conţinând ........ ................ ................ ................ .......... în cantitate de ........ .............., pentru a răspunde (denumirea comună internaţională) prescrierii efectuate de dr. ........ ........ .............. pentru pacientul ........ ........ ............... . Această autorizaţie are valabilitate de 1 (un) an. Preşedinte, ........ ................ ................ ................ ........ ............. (numele şi prenumele în clar, semnătura şi ştampila instituţiei) ANEXA Nr. 4(Anexa nr. 4 la norme) AGENŢIA NAŢIONALĂ A MEDICAMENTULUI ŞI A DISPOZITIVELOR MEDICALE AUTORIZAŢIE privind furnizarea de medicamente pentru nevoi speciale conform art. 703 alin. (2) din Legea nr. 95/2006 privind reforma în domeniul sănătăţii Nr. ....... din ................ Având în vedere Solicitarea cu nr. ............... din ........ .........., depusă la Agenţia Naţională a Medicamentului şi a Dispozitivelor Medicale, distribuitorul ........ ................ ........ ........ este autorizat pentru furnizarea medicamentului ........ ................ ................ ................ ................ ................ ................ ..........., (denumirea comercială, forma farmaceutică şi concentraţia) conţinând ........ ................ ................ ........ ..............., în cantitate de ........ ........ ..........., pentru a răspunde (denumirea comună internaţională) solicitării Comisiei ........ ........ ............/Direcţiei ........ ................ ................ ................ ................ .............. (denumirea comisiei/direcţiei de specialitate) din cadrul Ministerului Sănătăţii. Această autorizaţie are valabilitate de 1 (un) an. Preşedinte, ........ ................ ................ ................ ........ ............. (numele şi prenumele în clar, semnătura şi ştampila instituţiei) ANEXA Nr. 5(Anexa nr. 5 la norme) CERERE de aprobare a preţurilor la medicamente pentru nevoi speciale
|
I. ........ ........ ............., deţinător/reprezentant al deţinătorului ANS nr. ............, solicit aprobarea preţului maximal de producător, după cum urmează: |
|
Denumirea produsului*) |
Forma farmaceutică*) |
Forma de ambalare*) |
D.C.I.*) |
Preţ producător - lei - |
|
|
|
|
|
|
|
*) Datele vor fi trecute în tabel în conformitate cu ANS. Vă declar că nivelul/nivelurile preţului/preţurilor de producător respectă prevederile art. 19 şi 20 din Normele de aplicare a prevederilor art. 703 alin. (1) şi (2) din Legea nr. 95/2006 privind reforma în domeniul sănătăţii referitoare la medicamentele utilizate pentru rezolvarea unor nevoi speciale, aprobate prin Ordinul ministrului sănătăţii nr. 85/2013, cu modificările şi completările ulterioare. |
|
II. Produsul/Produsele se regăseşte/regăsesc în următoarele ţări de comparaţie sau în ţara de origine, cu următoarele niveluri ale preţului de producător înregistrate: |
|
Ţara de origine; ţările de comparaţie şi sursa informaţiei pentru fiecare ţară |
Denumirea produsului |
Forma farmaceutică |
Forma de ambalare |
Preţ producător - lei - |
|
|
|
|
|
|
|
Anexez în susţinerea datelor prezentate copii de pe cataloagele existente în derulare în ţările menţionate mai sus, precum şi din ţara de origine, după caz. Anexez dovada calităţii de reprezentant al deţinătorului I_I (Se bifează doar dacă cererea este depusă de reprezentant.) |
|
Denumirea produsului |
Nr. ANS |
„Extras medicament" |
|
|
|
|
|
III. Produsul/Produsele se încadrează în categoria medicamentelor: - inovative - orfane - generice din categoria prevăzută la art. 22 alin. (2) din norme - generice din categoria prevăzută la art. 23 din norme - derivate din sânge uman şi plasmă umană - imunologice - biosimilar - PUMA (autorizaţie de uz pediatric) |
|
IV. Declar că informaţiile şi documentele prezentate respectă prevederile Normelor de aplicare a prevederilor art. 703 alin. (1) şi (2) din Legea nr. 95/2006 privind reforma în domeniul sănătăţii referitoare la medicamentele utilizate pentru rezolvarea unor nevoi speciale, aprobate prin Ordinul ministrului sănătăţii nr. 85/2013, cu modificările şi completările ulterioare. |
|
Date de contact (Compania) Nume: Adresa: Telefon: E-mail: Numele persoanei de contact pe probleme de preţuri: |
ANEXA Nr. 6(Anexa nr. 6 la norme) DECLARAŢIE Subsemnata/Subsemnatul, ........ ........ ........, deţinătoare/deţinător a/al CI/BI/P seria ........., nr. ........., cu domiciliul în ........ ................ ........., codul numeric personal ........ ........ ............, în calitate de reprezentant împuternicit al ........ ........ .............., cu sediul în .. ........ ................ ........ .........., în calitate de: deţinător al autorizaţiei privind furnizarea de medicamente pentru nevoi speciale reprezentant al deţinătorului autorizaţiei privind furnizarea de medicamente pentru nevoi speciale (Se bifează în mod corespunzător.), declar pe propria răspundere, sub sancţiunea prevăzută la art. 326 din Codul penal, cu modificările şi completările ulterioare, referitoare la falsul în declaraţii, că, la momentul depunerii documentaţiei, toate informaţiile cuprinse în documentaţia de aprobare a preţului, în special informaţiile utilizate la calculul preţului medicamentului respectiv, sunt complete şi corecte. Declar, totodată, că am respectat integral modul de calcul al preţului prevăzut în Normele de aplicare a prevederilor art. 703 alin. (1) şi (2) din Legea nr. 95/2006 privind reforma în domeniul sănătăţii referitoare la medicamentele utilizate pentru rezolvarea unor nevoi speciale, aprobate prin Ordinul ministrului sănătăţii nr. 85/2013, cu modificările şi completările ulterioare. Semnătura ........ ........ ......... L.S.
|