ORDIN Nr. 22
din 1 februarie 2007
privind aprobarea Normei
sanitare veterinare ce stabileste metode de analiza pentru controlul oficial al
furajelor privind nivelurile amidonului, proteinei brute, proteinei brute care
poate fi dizolvata de pepsina si acid clorhidric, gosipolului liber si total si
cu referire la activitatea pepsinei, precum si determinarea nivelurilor de
tilozina si virginiamicina din furaje
ACT EMIS DE:
AUTORITATEA SANITARA VETERINARA SI PENTRU SIGURANTA ALIMENTE
ACT PUBLICAT IN:
MONITORUL OFICIAL NR. 141 din 27 februarie 2007
Văzând Referatul de aprobare nr. 70.058 din 22 ianuarie
2007, întocmit de Direcţia de control şi coordonare a activităţii farmaceutice
veterinare din cadrul Autorităţii Naţionale Sanitare Veterinare şi pentru
Siguranţa Alimentelor,
având în vedere prevederile art. 10 lit. b) din Ordonanţa Guvernului nr. 42/2004 privind organizarea
activităţii sanitar-veterinare şi pentru siguranţa alimentelor, aprobată cu
modificări şi completări prin Legea nr. 215/2004, cu modificările şi
completările ulterioare,
în temeiul art. 3 alin. (3) şi
al art. 4 alin. (3) din Hotărârea Guvernului nr. 130/2006 privind organizarea
şi funcţionarea Autorităţii Naţionale Sanitare Veterinare şi pentru Siguranţa
Alimentelor şi a unităţilor din subordinea acesteia,
preşedintele Autorităţii Naţionale Sanitare
Veterinare şi pentru Siguranţa Alimentelor emite
următorul ordin:
Art. 1. - Se aprobă Norma sanitară veterinară ce
stabileşte metode de analiză pentru controlul oficial al furajelor privind
nivelurile amidonului, proteinei brute, proteinei brute care poate fi dizolvată
de pepsină şi acid clorhidric, gosipolului liber şi total şi cu referire la
activitatea pepsinei, precum şi determinarea nivelurilor de tilozină şi
virginiamicină din furaje, prevăzută în anexa care face parte integrantă din
prezentul ordin.
Art. 2. - Autoritatea Naţională Sanitară Veterinară şi
pentru Siguranţa Alimentelor, institutele veterinare centrale şi direcţiile
sanitar-veterinare şi pentru siguranţa alimentelor judeţene şi a municipiului
Bucureşti vor duce la îndeplinire prevederile
prezentului ordin.
Art. 3. - La data intrării în vigoare a prezentului
ordin se abrogă Ordinul ministrului agriculturii, pădurilor, apelor şi mediului
nr. 968/2003 privind aprobarea Normei sanitare veterinare ce stabileşte metode
de analiză pentru controlul oficial al furajelor privind amidonul, proteina
brută, proteina brută
descompusă de pepsină şi acid clorhidric, estimarea activităţii pepsinei, a
gosipolului liber şi cu referire la identificarea antibioticelor din grupul
tetraciclinelor, al clortetraciclinelor, oxitetraciclinelor şi tetraciclinelor,
a oleandomicinei şi a virginiamicinei, publicat în Monitorul Oficial al
României, Partea I, nr. 59 şi
59 bis din 23 ianuarie 2004.
Art. 4. - Prezentul ordin transpune prevederile
Directivei Comisiei 72/199/CEE ce stabileşte metode
comunitare de analiză pentru controlul oficial al furajelor, publicată în
Jurnalul Oficial al Comunităţilor Europene (JOCE) nr. L 123 din 29 mai 1972, p.
6, astfel cum a fost modificată ultima dată de Directiva Comisiei 1999/79/CE,
publicată în Jurnalul Oficial al Comunităţilor Europene (JOCE) nr. L 209 din 7
august 1999, p. 23.
Art. 5. - Prezentul ordin va fi publicat în Monitorul
Oficial al României, Partea I.
Preşedintele Autorităţii Naţionale Sanitare Veterinare
şi pentru Siguranţa Alimentelor,
Marian Avram
ANEXA
NORMĂ SANITARĂ VETERINARĂ
ce stabileşte metode de analiză pentru controlul
oficial al furajelor privind nivelurile amidonului, proteinei brute, proteinei brute care poate fi
dizolvată de pepsină şi acid clorhidric, gosipolului liber şi total şi cu referire la activitatea
pepsinei, precum şi determinarea nivelurilor de tilozină şi virginiamicină din
furaje
Art. 1. - Analizele pentru controalele oficiale ale
furajelor, în ceea ce priveşte nivelurile acestora de amidon, proteină brută,
proteină brută ce poate fi descompusă de pepsină şi acid clorhidric, de gosipol
liber sau total şi în ceea ce priveşte activitatea pepsinei, se efectuează
utilizându-se metodele descrise în anexa nr. 1.
Art. 2. - Analizele pentru controalele
oficiale ale furajelor, în ceea ce priveşte determinarea nivelurilor de tilozină şi virginiamicină din furaje, se
efectuează utilizându-se metodele descrise în anexa nr. 2.
Art. 3. - Autoritatea Naţională Sanitară Veterinară şi
pentru Siguranţa Alimentelor informează Comisia Europeană cu privire la actele
normative şi prevederile administrative necesare pentru implementarea prezentei
norme sanitare veterinare.
Art. 4. - Anexele nr. 1 şi 2 fac parte integrantă din
prezenta normă sanitară veterinară.
ANEXA Nr. 1 la norma sanitară veterinară
I. DETERMINAREA AMIDONULUI
Metoda polarimetrică
1. Scop şi domeniu de
aplicare
Această metodă se utilizează pentru determinarea
nivelurilor de amidon şi a produselor de degradare a amidonului cu greutate
moleculară mare din furaje, în scopul verificării conformităţii cu Norma
veterinară ce stabileşte metoda de calcul pentru valoarea energetică a furajelor
combinate pentru păsări, aprobată prin Ordinul preşedintelui Agenţiei
Veterinare şi pentru Siguranţa Alimentelor nr. 17/2004,
publicat în Monitorul Oficial al României, Partea I, nr.
1.020 şi 1.020 bis din 4 noiembrie 2004, ce transpune în legislaţia naţională
Directiva Comisiei 86/174/CEE, şi cu Norma sanitară veterinară privind
circulaţia şi utilizarea materiilor prime furajere, aprobată prin Ordinul
ministrului agriculturii, pădurilor, apelor şi mediului nr. 507/2003, publicat
în Monitorul Oficial al României, Partea I, nr. 683 şi 683 bis din 29 septembrie 2003, ce transpune în
legislaţia naţională Directiva Consiliului 96/25/CE.
2. Principiu
Metoda cuprinde două etape. In prima etapă, proba se
tratează, atunci când este fierbinte, cu acid clorhidric diluat. După
clarificare şi filtrare, rotaţia optică a soluţiei trebuie măsurată prin
polarimetrie.
In a doua etapă, proba trebuie
extrasă cu etanol 40%. După acidifierea filtratului cu acid clorhidric,
clarificând şi filtrând soluţia, rotaţia optică se măsoară ca în prima etapă.
Conţinutul în amidon al probei se calculează făcându-se
diferenţa dintre cele două măsurători, multiplicată cu un factor cunoscut.
3. Reactivi
3.1. Acid clorhidric (w/w) 25%, d: 1,126 g/ml
3.2. Acid clorhidric (w/v) 1,128%
Concentraţia trebuie să fie controlată prin titrare,
utilizându-se o soluţie de hidroxid de sodiu 0,1 mol/litru în prezenta de roşu
de metil (w/v) 0,1% în etanol 94% (V/V). 10 ml = 30,94 ml de NaOH 0,1 mol/litru
3.3. Soluţie Carrez I: Se dizolvă în apă 21,9 g acetat de zinc Zn(CH3COO)2. 2H2O şi 3g de acid acetic glacial. Se aduce la volum până la 100 ml cu
apă
3.4. Soluţie Carrez II: Se dizolvă în apă 10,6 g de ferocianură
de potasiu [K4(Fe(CN)6].
3H2O. Se aduce la volum până la 100 ml cu
apă
3.5. Etanol 40% (v/v), d : 0,948 g/ml la 20°C.
4. Aparatură
4.1. Retortă Erlenmeyer de 250 ml cu ajustare de
sticlă mată standard şi cu condensator de reflux
4.2. Polarimetru sau sacharimetru
5. Procedură
5.1. Prepararea probei
Se mărunţeşte proba până când este destul de fină
pentru a trece printr-o sită cu ochiuri de 0,5 mm.
5.2. Determinarea rotaţiei optice totale (P sau S)
(Vezi observaţia 7.1)
Se cântăresc 2,5 g din proba mărunţită, cu o
aproximaţie de mg, şi se plasează într-o retortă gradată de 100 ml. Se adaugă
25 ml de acid clorhidric (pct. 3.2), se agită pentru a se obţine chiar
distribuţia probei-test şi se adaugă încă 25 ml de acid clorhidric (pct.
3.2). Se imersează retorta
în apă fiartă, agitându-se energic şi constant timp de 3 minute, pentru a se
preveni formarea de flocoane. Cantitatea de apă din baia de apă trebuie să fie
suficientă pentru ca baia să rămână la punctul de fierbere, atunci când retorta
este introdusă în aceasta.
Retorta nu trebuie să fie scoasă din baie cât timp se
agită. După exact 15 minute, se scoate retorta din baie, se adaugă 30 ml de apă
rece şi se răceşte imediat la 20°C.
Se adaugă 5 ml de soluţie
Carrez I (pct. 3.3) şi se
agită timp de un minut. Apoi se adaugă 5 ml de soluţie Carrez II (pct. 3.4) şi se agită din nou, timp de
un minut. Se aduce la volum cu apă, se omogenizează şi se filtrează. Dacă
filtratul nu este perfect clar (fapt ce este rar), se repetă determinarea
utilizându-se o cantitate mai mare de soluţii Carrez I şi II, de exemplu 10 ml.
Se măsoară rotaţia optică a soluţiei într-un tub de 200
mm cu polarimetru sau cu sacharimetru.
5.3. Determinarea rotaţiei optice (P' sau S') a
substanţelor solubile în etanol 40%
Se cântăresc 5 g din probă cu o aproximaţie de mg, se
plasează într-o retortă gradată de 100 ml şi se adaugă aproximativ 80 ml de
etanol (pct. 3.5) (vezi observaţia 7.2). Se lasă retorta să stea timp de o oră
la temperatura camerei. In acest timp, se agită puternic de 6 ori, astfel încât
proba-test este bine amestecată cu etanol. Se aduce la volum cu etanol (pct.
3.5), se omogenizează şi se filtrează.
Se picură 50 ml din filtrat (= 2,5 g din probă) într-o
retortă Erlenmeyer de 250 ml, se adaugă 2,1 ml de acid clorhidric (pct. 3.1) şi
se agită cu vigoare. Se echipează retorta Erlenmeyer cu un condensator de
reflux şi se imersează acesta din urmă într-o baie de apă fierbinte. După exact
15 minute se îndepărtează retorta Erlenmeyer din baie, se transferă conţinutul
într-o retortă gradată de 100 ml, clătindu-se cu puţină apă rece, şi se răceşte
la 20°C. Se clarifică filtratul utilizându-se soluţiile Carrez I (pct. 3.3) şi II (pct. 3.4), se aduce la volum cu apă, se omogenizează, se filtrează
şi se măsoară rotaţia optică, aşa cum s-a indicat la pct. 5.2.
6. Calcularea rezultatelor
Conţinutul de amidon (%) este calculat după cum
urmează:
6.1. Măsurare cu polarimetru
Conţinut de amidon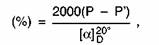
unde:
P = rotaţia optică totală în
grade;
P'= rotaţia optică în grade a substanţelor solubile în
etanol 40%'(V/V);
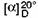 = rotaţie optică specifică de amidon pur.
Valorile numerice acceptate convenţional pentru acest factor sunt următoarele:
= rotaţie optică specifică de amidon pur.
Valorile numerice acceptate convenţional pentru acest factor sunt următoarele:
+ 185,9°: amidon din orez;
+ 185,4°: amidon din cartofi;
+ 184,6°: amidon din porumb;
+ 182,7°: amidon din grâu;
+ 181,5°: amidon din orz;
+ 181,3°: amidon din ovăz;
+ 184,0°: alte tipuri de amidon şi amestecuri de amidon
din furaje combinate.
6.2. Măsurarea cu zaharimetru
Continut de amidon = 2000_ x (2N x 0,665) x
(S - S') - 26,6 N x (S - S')
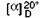 100
100 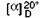
unde:
S = rotaţia optică totală în grade zaharimetrice;
S' = rotaţia optică în grade zaharimetrice a
substanţelor solubile în etanol 40% (V/V);
N = greutatea în grame a sucrozei în 100 ml de apă, ce
dă o rotaţie optică de 100 grade zaharimetrice, atunci când este măsurată
utilizând un tub de 200 mm. Greutatea variază după cum urmează, în conformitate
cu tipul de zaharimetru utilizat:
- 16,29 g pentru zaharimetrele franceze;
- 26,00 g pentru zaharimetrele germane; - 20,00 g
pentru zaharimetrele mixte;
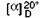 = rotaţie optică specifică a amidonului pur
(vezi pct. 6.1).
= rotaţie optică specifică a amidonului pur
(vezi pct. 6.1).
6.3. Repetabilitate
Diferenţa dintre rezultatele a două determinări
paralele efectuate pe aceeaşi probă trebuie să fie de maximum 0,4, în valoare
absolută, pentru un conţinut de amidon mai mic de 40% şi 1,1%, în valoare
relativă, pentru conţinuturi de amidon de minimum 40%.
7. Observaţii
7.1. Dacă proba conţine mai mult de 6% carbonaţi,
calculaţi în termeni de carbonat de calciu, aceştia trebuie să fie distruşi
prin tratament cu exact cantitatea corespunzătoare de diluţie de acid sulfuric,
înainte de determinarea rotaţiei optice totale.
7.2. In cazul produselor cu un conţinut ridicat de
lactoză, precum zerul pudră sau laptele praf degresat, se procedează după cum
urmează: după ce se adaugă 80 ml de etanol (pct. 3.5), se echipează retorta cu
un condensator de reflux şi se imersează aceasta din urmă într-o baie cu apă la
50°C, timp de 30 de minute. Se lasă să se răcească şi se continuă analiza aşa
cum s-a indicat la pct. 5.3.
7.3. In cazul în care următoarele materii furajere
sunt prezente în cantitate semnificativă în furaje, pot apărea interferenţe
atunci când se determină conţinutul de amidon prin metoda polarimetrică şi, de
aceea, pot fi obţinute rezultate incorecte:
a) produse din sfeclă (de zahăr), cum ar fi: pulpă de
sfeclă (de zahăr), melasă de sfeclă (de zahăr), pulpă melasată de sfeclă (de
zahăr), borhot de sfeclă (de zahăr), zahăr (de sfeclă);
b) pulpă de citrice;
c) sămânţă de in; turte de in obţinute prin presare;
turte de in rezultate după extracţie;
d) sămânţă de rapiţă; turte de rapiţă obţinute prin
presare; turte de rapiţă rezultate după extracţie; hoaspe de sămânţă de rapiţă;
e) sămânţă de floarea-soarelui; turte de
floarea-soarelui rezultate după extracţie; sămânţă de floarea-soarelui parţial
decorticată, extrasă;
f) turte de copra obţinute prin presare; turte de
copra rezultate după extracţie;
g) pulpă de cartof;
h) drojdie deshidratată;
i) produse bogate în inulină (de exemplu, tăiţei şi
făină de topinambur); j) jumări.
II. DETERMINAREA PROTEINEI BRUTE
1. Scop şi domeniu de
aplicare
Această metodă se utilizează pentru determinarea
conţinutului de proteină brută din furaje pe baza conţinutului de azot,
determinat în conformitate cu metoda Kjeldahl.
2. Principiu
Proba se digeră cu acid sulfuric în prezenţa unui
catalizator. Soluţia acidă trebuie alcalinizată cu soluţie de hidroxid de
sodiu. Amoniacul se distilează şi se colectează într-o cantitate măsurată de
acid sulfuric, al cărui exces este titrat cu o soluţie standard de hidroxid de
sodiu.
3. Reactivi
3.1. Sulfat de potasiu
3.2. Catalizator: oxid de cupru (II) CuO sau sulfat de
cupru pentahidrat (II), CuSO4 . 5H2 O
3.3. Zinc granulat
3.4. Acid sulfuric, p20 = 1,84g/ml
3.5. Acid sulfuric C(1/2H2S04) =
0,5 mol/l
3.6. Acid sulfuric C(1/2H2SO4) =
0,1 mol/l
3.7. Indicator roşu de metil: se dizolvă 300 mg de
roşu de metil în 100 ml de etanol,σ = 95-96% (v/v)
3.8. Soluţie de hidroxid de sodiu (poate fi utilizat
gradul tehnic) β= 40g/100ml
(m/v: 40%)
3.9. Soluţie c de hidroxid de sodiu = 0,25ml/l
3.10. Soluţie c de hidroxid
de sodiu = 0,1 mol/l
3.11. Piatră ponce granulată, spălată în acid
clorhidric şi aprinsă
3.12. Acetanilidă ( m.p. = 114°C, N = 10,36%)
3.13. Sucroză (liberă de azot).
4. Aparatură
Aparatură potrivită pentru efectuarea digestiei,
distilării şi titrării, în conformitate cu procedura Kjedahl.
5. Procedură
5.1. Digestie
Se cântăreşte 1 g de probă cu o aproximaţie de 0,001 g
şi se transferă în retorta aparatului de digestie. Se adaugă 15 g de sulfat de
potasiu (pct. 3.1), o cantitate corespunzătoare de catalizator (pct. 3.2) [0,3
până la 0,4 g de oxid de cupru (II) sau 0,9 până la 1,2 g de sulfat de cupru pentahidrat(II)], 25 ml de
acid sulfuric (pct. 3.4) şi câteva granule de piatră ponce (pct. 3.11) şi se
amestecă. Se încălzeşte mai întâi retorta cu moderaţie, rotindu-se din când în
când, dacă este necesar, până când masa de probă s-a carbonizat şi spuma a
dispărut. Se încălzeşte apoi mai intens până când lichidul fierbe constant.
Incălzirea este adecvată dacă acidul fiert condensează pe peretele retortei. Se
previne ca pereţii să devină supraîncălziţi şi ca particule organice să se
lipească pe aceştia. Când soluţia devine clară şi verde deschis, se continuă să
se fiarbă timp de încă două ore, apoi se lasă să se răcească.
5.2. Distilare
Se adaugă cu grijă destulă apă pentru dizolvarea
completă a sulfaţilor. Se lasă să se răcească şi apoi se adaugă câteva granule
de zinc (pct. 3.3).
Se plasează în retorta de colectare a aparatului de
distilare o cantitate exactă măsurată de 25 ml de acid sulfuric (pct. 3.5 sau
3.6), depinzând de conţinutul de azot estimat. Se adaugă câteva picături de
indicator de roşu de metil (pct. 3.7).
Se conectează retorta de digestie la condensatorul
aparatului de distilare şi se imersează porţiunea terminală a condensatorului
în lichidul conţinut în retorta de colectare, la o adâncime de cel puţin 1 cm
(vezi observaţia de la pct. 8.3). Se toarnă încet 100 ml de soluţie de hidroxid
de sodiu (pct. 3.8) în retorta de digestie, fără a se pierde amoniac (vezi
observaţia de la pct. 8.1).
Se încălzeşte retorta până când amoniacul s-a distilat.
5.3. Titrare
Se titrează excesul de acid sulfuric în retorta de
colectare cu soluţie de hidroxid de sodiu (pct. 3.9 sau 3.10), depinzând de
concentraţia de acid sulfuric utilizată, până când este atins punctul final.
5.4. Test martor
Pentru a se confirma că reactivii sunt liberi de azot,
se efectuează un test martor (digestie, distilare şi titrare), utilizându-se 1
g de sucroză (pct. 3.13) în locul probei.
6. Calcularea rezultatelor
Conţinutul în proteină brută este calculat în
conformitate cu următoarea formulă:
(V0 - V1) x c x 0,014 x 100 x
6,25
m
unde:
V0 = volumul (ml) de NaOH (pct. 3.9 sau pct.
3.10) utilizat la testul martor;
V1 = volumul (ml) de NaOH (pct. 3.9 sau pct.
3.10) utilizat la titrarea probei;
c = concentraţia (mol/l) de
hidroxid de sodiu (pct. 3.9 sau pct. 3.10);
m = masa probei (g).
7. Verificarea metodei
7.1. Repetabilitate
Diferenţa dintre rezultatele a două determinări
paralele, efectuate pe aceeaşi probă, trebuie să fie de maximum:
- 0,2% în valoare absolută,
pentru un conţinut de proteină brută mai mic de 20%;
- 1,0% relativ la valoarea mai mare, pentru un
conţinut de proteină brută de la 20% la 40%;
- 0,4% în valoare absolută, pentru un conţinut de
proteină brută de peste 40%.
7.2. Acurateţe
Se efectuează analiza (digestie, distilare şi titrare)
pe 1,5 până la 2 g de acetanilidă (pct. 3.12), în prezenţa a 1 g de sucroză
(pct. 3.13); 1 g de acetanilidă consumă 14,8 ml de acid sulfuric (pct. 3.5).
Recuperarea trebuie să fie de cel puţin 99%.
8. Observaţii
8.1. Aparatura poate fi de tip manual, semiautomat sau
automat. Dacă aparatura necesită transferul între fazele de digestie şi de
distilare, acest transfer trebuie să fie efectuat fără pierdere. Dacă retorta
aparatului de distilat nu este echipată cu o pâlnie, se adaugă imediat, înainte
de conectarea retortei la condensator, hidroxid de sodiu, turnând încet pe
pereţi.
8.2. Dacă materialul digerat se solidifică, se
reîncepe determinarea, utilizându-se o cantitate mai mare de acid sulfuric
(pct. 3.4) decât cea specificată anterior.
8.3. Pentru produse cu un conţinut scăzut de azot,
volumul de acid sulfuric (pct. 3.6) ce trebuie plasat în retorta de colectare
poate fi redus până la 10 sau 15 ml, dacă este necesar, si se aduce la volum cu
apă până la 25 ml.
III. DETERMINAREA PROTEINEI BRUTE DESCOMPUSE DE PEPSINĂ
Şl ACID CLORHIDRIC
1. Scop şi domeniu de
aplicare
Această metodă se utilizează pentru determinarea
fracţiunii de proteină brută descompusă de pepsină şi acid clorhidric în baza
condiţiilor definite. Aceasta este aplicabilă tuturor furajelor.
2. Principiu
Proba trebuie încălzită timp de 48 de ore, la 40°C,
într-o soluţie clorhidrică de pepsină. Suspensia trebuie filtrată, iar
conţinutul în azot al filtratului, determinat în conformitate cu metoda pentru determinarea proteinei brute.
3. Reactivi
3.1. Acid clorhidric, d: 1,125
3.2. Acid clorhidric, 0,075 N
3.3. 2,0 U/mg pepsină. Activitatea pepsinei este
definită de metoda descrisă în partea a 4-a a acestei anexe şi trebuie să fie
stabilită în conformitate cu acea metodă.
3.4. Aproximativ 0,2% (w/v) soluţie proaspăt
preparată de acid clorhidric (pct. 3.2); Activitate: 400 U/L
3.5. Emulsie antispumă (de exemplu, silicon).
3.6. Toţi reactivii menţionaţi la pct. 3 pentru metoda
de determinare a proteinei brute.
4. Aparatură
4.1. Baie de apă sau incubator, fixat la 40°C ± 1°C
4.2. Aparatură de digestie şi de distilare Kjedahl.
5. Procedură
5.1. Prepararea soluţiei (vezi observaţia 7.2)
Se cântăresc 2 g din probă, cu o aproximaţie de mg, şi
se plasează într-o retortă gradată de 500 ml. Se adaugă 450 ml de soluţie
clorhidrică de pepsină (pct. 3.4), încălzită anterior la 40°C, şi se agită
pentru a se preveni formarea flocoanelor. Se controlează ca ph-ul suspensiei să
fie mai mic de 1,7. Se plasează retorta într-o baie de apă sau incubator (pct.
4.1) şi se lasă acolo timp de 48 de ore. Se agită după 8, 24 şi 32 de ore. După
48 de ore se adaugă 15 ml de acid clorhidric (pct. 3.1), se răceşte până la
20°C, se aduce la volum cu apă şi se filtrează.
5.2. Digestia
Se iau 250 ml de filtrat şi se plasează în retorta aparatului
de distilare (pct. 4.2). Se adaugă reactivii necesari pentru digestia indicată
în a doua propoziţie a pct. 5.1 din metoda pentru determinarea proteinei brute.
Se omogenizează şi se aduce la fierbere. Dacă se formează orice spumă, se
adaugă câteva picături de emulsie antispumă (pct. 3.5). Se continuă fierberea
cu vigoare până când apa s-a evaporat aproape complet. Se reduce căldura şi se
elimină cu atenţie ultimele urme de apă.
Când soluţia devine clară şi incoloră (sau verde
deschis, dacă este utilizat un catalizator pe bază de cupru), se continuă
fierberea timp de încă o oră. Se lasă să se răcească.
5.3. Distilare şi titrare
Se procedează, aşa cum s-a indicat la pct. 5.2 şi 5.3
din metoda pentru determinarea proteinei brute.
5.4. Test martor
Se efectuează un test martor, aplicându-se aceeaşi
procedură, dar omiţându-se proba ce trebuie analizată.
6. Calcularea rezultatelor
Se scade volumul de acid sulfuric consumat la testul
martor din cel consumat la proba-test. 1 ml de acid sulfuric 0,1 N corespunde
la 1,4 mg de azot.
Se multiplică cantitatea de azot cu factorul 6,25. Se
exprimă rezultatul ca procent din probă.
Repetabilitate
Diferenţa dintre rezultatele a două determinări
paralele, efectuate pe aceeaşi probă, trebuie să fie de maximum:
- 0,4, în valoare absolută, pentru un conţinut mai mic
de 20%;
- 2,0%, în valoare absolută, pentru un conţinut peste
20% şi nu mai mult de 40%;
- 0,8, în valoare absolută, pentru un conţinut de
peste 40%.
7. Observaţii
7.1. Valorile obţinute prin această metodă nu au
conexiune directă cu digestibilitatea in vivo.
7.2. Produsele cu un conţinut în ulei sau grăsime ce
depăşeşte 10% trebuie mai întâi să fie degresate prin extracţie cu eter petrol
(B.P. 40°C până la 60°C).
IV. ESTIMAREA ACTIVITĂŢII
PEPSINEI
1. Scop şi domeniu de
aplicare
Această metodă se utilizează la stabilirea activităţii
de pepsină utilizată în determinarea proteinei brute descompuse de pepsină şi
acid clorhidric.
2. Principiu
Hemoglobina trebuie tratată cu pepsină, într-un mediu
de acid clorhidric, în baza condiţiilor definite. Fracţiunea nehidrolizată a
proteinei este precipitată în acid tricloracetic. Sunt adăugate filtratului
hidroxid de sodiu şi reactiv Folin-Ciocalteu. Densitatea optică a acestei
soluţii trebuie măsurată la lungimea de undă de 750 nm, iar cantitatea
corespunzătoare de tirozina trebuie citită de pe curba de calibrare.
Definiţie: Unitatea de
pepsină este definită ca fiind cantitatea din acea enzimă ce, în baza
condiţiilor metodei, eliberează pe minut o anumită cantitate din grupele
hidroxiaril care, atunci când intră în contact cu reactivul Folin-Ciocalteu,
are o densitate optică corespunzătoare celei la care un umol de tirozina
reacţionează în aceeaşi manieră.
3. Reactivi
3.1. Acid clorhidric 0,2 N
3.2. Acid clorhidric 0,06 N
3.3. Acid clorhidric 0,025 N
3.4. Soluţie 5% (w/v) de acid tricloracetic
3.5. Soluţie de hidroxid de sodiu 0,5 N
3.6. Reactiv Folin-Ciocalteu.
Se plasează 100 g de tungstat
de sodiu (Na2W04 . 2H2O), 25 g de molibdat de
sodiu (Na2MoO4 . 2H2O)
şi 700 ml de apă într-o retortă cu fundul rotund de 2 litri echipată cu o
îmbinare standard de sticlă mată. Se adaugă 50 ml de acid fosforic (d:1,71) şi
100 ml de acid clorhidric concentrat (d: 1,19), se conectează un condensator de
reflux la retortă, se aduce la fierbere şi se ţine soluţia fierbând uşor timp
de 10 ore. Se lasă să se răcească, se detaşează condensatorul de reflux, se
adaugă 175 g de sulfat de litiu (Li2SO4 . 2H2O), 50 ml de
apă şi 1 ml de bromură. Se fierbe timp de 15 minute pentru a se elimina excesul
de bromură.
Se lasă să se răcească, se transferă soluţia într-o
retortă gradată de un litru, se aduce la volum cu apă, se omogenizează şi se
filtrează. Nu trebuie să rămână nicio coloraţie verzuie. Inainte de utilizare
se diluează un volum de reactiv cu două volume de apă.
3.7. Soluţie de hemoglobina
Se cântăreşte o cantitate de hemoglobina (aproximativ 2
g de substrat proteic determinat în conformitate cu Anson) ce corespunde la 354 mg de azot(1)
şi se plasează într-o retortă de 200 ml echipată cu o îmbinare standard de
sticlă mată.
Se adaugă câţiva ml de acid clorhidric (pct. 3.2), se
conectează retorta la pompa de vacuum şi se agită până când hemoglobina a fost
dizolvată complet. Se eliberează vacuumul şi se adaugă, în timp ce se agită,
acid clorhidric (pct. 3.2), se completează până la 100 ml. Se prepară imediat
înainte de utilizare.
3.8. Soluţie standard de tirozina
Se dizolvă 181,2 mg de tirozina în acid clorhidric
(pct. 3.1) şi se completează până la un litru cu acelaşi acid (soluţie Stick).
Se iau 20 ml şi se diluează până la 100 ml cu acid clorhidric (pct. 3.1). 1 ml
din această soluţie conţine 0,2 umoli de tirozina.
4. Aparatură
4.1. Baie de apă fixată la 25°C
± 0,1 °C prin ultratermostat
4.2. Spectrofotometru
4.3. Cronometru, acurateţe: o secundă
4.4. Ph-metru.
5. Procedură
5.1. Prepararea soluţiei (vezi observaţia de la pct.
7.1) Se dizolvă 150 mg de pepsină în 100 ml de acid
clorhidric (pct. 3.2). Se pipetează 2 ml din soluţie
într-o retortă gradată de 50 ml şi se aduce la volum cu acid clorhidric (pct.
3.3). Ph-ul, controlat cu ph-metru, trebuie să fie de 1,6 ± 0,1. Se imersează
retorta într-o baie de apă (pct. 4.1).
5.2. Hidroliză
Se pipetează 5,0 ml de soluţie de hemoglobina (pct.
3.7) într-o eprubetă, se încălzeşte într-o baie de apă la 25°C (pct. 4.1), se
adaugă 1 ml de soluţie de pepsină obţinută ca la pct. 5.1 şi se amestecă cu o
baghetă de sticlă îngroşată la un capăt, cu aproximativ 10 mişcări înainte şi
înapoi. Se lasă eprubetă într-o baie de apă la 25°C, exact 10 minute, măsurate
de la adăugarea soluţiei de pepsină (trebuie să fie respectate cu stricteţe
durata şi temperatura). Apoi se adaugă 10,0 ml de soluţie de acid tricloracetic
(pct. 3.4), încălzită anterior la 25°C, se omogenizează şi se filtrează
printr-un filtru uscat.
5.3. Evoluţia colorării şi măsurarea densităţii
optice
Se pipetează 5,0 ml de filtrat într-o retortă
Erlenmeyer de 50 ml, se adaugă 10,0 ml de soluţie de hidroxid de sodiu (pct.
3.5) şi, agitându-se constant, 3 ml de reactiv Folin-Ciocalteu diluat (pct.
3.6). După 5 până la 10 minute, se determină densitatea optică a soluţiei cu
spectrofotometru la 750 nm în celule de 1 cm impermeabile.
5.4. Test martor
Pentru fiecare determinare se
efectuează un test martor, după cum urmează: Se pipetează 5 ml de soluţie de
hemoglobina (pct. 3.7) într-o eprubetă, se încălzeşte într-o baie de apă la
25°C (pct. 4.1), se adaugă 10,0 ml de soluţie de acid tricloracetic (pct. 3.4)
încălzită anterior la 25°C, se omogenizează, apoi se adaugă 1,0 ml de soluţie
de pepsină obţinută la pct. 5.1. Se amestecă cu o baghetă de sticlă şi se lasă
eprubetă în baia de apă (pct. 4.1) la 25°C pentru exact 10 minute. Se
omogenizează şi se filtrează printr-un filtru uscat. Se urmează procedura
indicată la pct. 5.3.
(1) Se determină
conţinutul în azot prin metoda semi-micro Kjeldahl (conţinutul teoretic: 17,7%
de azot).
5.5. Curba de calibrare
Se plasează 1,0, 2,0, 3,0, 4,0 şi 5,0 ml alicote de
soluţie standard de tirozină (pct. 3.8), corespunzând la 0,2, 0,4, 0,6, 0,8 şi
1,0 umoli de tirozină respectiv, în retorte Erlenmeyer de 50 ml. Se încheie
seriile cu o soluţie de referinţă liberă de tirozină. Se aduce la volum până la
5 ml cu acid clorhidric (pct. 3.1). Se adaugă 10,0 ml de soluţie de hidroxid de
sodiu (pct. 3.5) şi, agitându-se constant, 3 ml de diluţie de reactiv
Folin-Ciocalteu (pct. 3.6). Se măsoară densitatea optică, aşa cum s-a indicat
la ultima propoziţie a pct. 5.3. Se trasează curba de calibrare prin schiţarea
densităţilor optice corelate cu cantităţile de tirozină.
6. Calcularea rezultatelor
De pe curba de calibrare se citeşte cantitatea de
tirozină în umoli ce corespunde densităţii optice a soluţiei colorate,
corectată pe baza valorii martor.
Activitatea pepsinei, în umoli de tirozină la 25°C per
mg şi per minut, se calculează utilizându-se formula:
Unitati per mg (U/mg) = 0,32a
P
unde:
a = cantitatea de tirozină în umoli ce se citeşte de pe
curba de calibrare;
P = greutatea în mg a cantităţii de pepsină adăugată la
pct. 5.2.
7. Observaţii
7.1. Cantitatea de pepsină ce trebuie dizolvată
trebuie să fie astfel încât, la măsurarea fotometrică finală, să fie obţinută o
densitate optică de 0,35 ± 0,035.
7.2. Două unităţi per mg, obţinute prin această metodă,
corespund la: 3,64 miliunităţi Anson/mg (umoli de tirozină/mg min. la 35,5°C)
sau 36.400 unităţi comerciale/g (umoli de tirozină/g în 10 min. la 35,5°C).
V. DETERMINAREA DE GOSIPOL LIBER
1. Scop şi domeniu de aplicare
Această metodă se utilizează pentru determinarea
nivelurilor de gosipol liber, de gosipol total şi de substanţe chimic legate de
acesta din sămânţă de bumbac, făină de sămânţă de bumbac şi brichete de sămânţă
de bumbac şi din furaje combinate ce conţin aceste substanţe, atunci când sunt
prezente în cantitate mai mare de 20 ppm.
2. Principiu
Gosipolul trebuie extras în prezenţa
3-aminopropan-1-ol, fie cu un amestec de propan-2-ol şi hexan, pentru
determinarea gosipolului liber, sau cu dimetilformamidă, pentru determinarea
gosipolului total. Gosipolul este convertit de anilină în gosipol-dianilină, a
cărei densitate optică este măsurată la lungimea de undă de 440 nm.
3. Reactivi
3.1. Amestec de propan-2-olhexan: se amestecă 60 de
părţi de volum de propan-2-ol A.R. cu 40 de părţi de volum de n-hexan.
3.2. Solvent A: se plasează într-o retortă gradată de
1 litru aproximativ 500 ml de amestec de propan-2-ol-hexan (pct. 3.1), 2 ml de
aminopropan-1-ol, 8 ml de acid acetic glacial şi 50 ml de apă. Se aduce la
volum cu amestec de propan-2-ol-hexan (pct. 3.1). Acest reactiv este stabil
timp de o săptămână.
3.3. Solvent B: se pipetează 2 ml de
3-aminopropan-1-ol şi 10 ml de acid acetic glacial într-o retortă gradată de
100 ml. Se răceşte la temperatura camerei şi se aduce la volum cu N, N-dimetilformamidă. Acest
reactiv este stabil timp de o săptămână.
3.4. Anilină A.R.: Dacă densitatea optică a testului
martor depăşeşte 0,022, se distilează anilină peste praf de zinc, aruncând
prima şi ultima fracţiune de 10% a distilatului. Refrigerat şi depozitat într-o
retortă maro cu dop de sticlă, acest reactiv se va ţine timp de câteva luni.
3.5. Soluţie standard A de gosipol: Se plasează 27,9
mg de acetat de gosipol într-o retortă gradată de 250 ml. Se dizolvă şi se
aduce la volum cu solvent A (pct. 3.2). Se pipetează 50 ml din această soluţie
într-o retortă gradată de 250 ml şi se aduce la volum cu solvent A.
Concentraţia în gosipol a acestei soluţii este de 0,02 mg per ml. Se lasă să
stea timp de o oră la temperatura camerei înainte de
utilizare.
3.6. Soluţie B standard de gosipol: Se plasează 27,9
mg de acetat de gosipol într-o retortă gradată de 50 ml. Se dizolvă şi se aduce
la volum cu solvent B (pct. 3.3). Concentraţia de gosipol a acestei soluţii este de 0,5 mg per ml.
Soluţiile standard A şi B de gosipol vor rămâne stabile
timp de 24 de ore, dacă au fost ferite de lumină.
4. Aparatură
4.1. Mixer (cu pahar): aproximativ 35 rpm.
4.2. Spectrofotometru.
5. Procedură
5.1. Probă-test
Cantitatea de probă-test
utilizată depinde de conţinutul estimat de gosipol al probei. Este preferabil
să se lucreze cu o probă-test mică şi cu o parte relativ mare de alicotă a
filtratului, astfel încât să se obţină suficient gosipol, pentru ca să fie
posibilă măsurarea fotometrică precisă. Pentru determinarea de gosipol liber
din sămânţă de bumbac, făină de sămânţă de bumbac şi din brichetele de sămânţă
de bumbac, proba-test nu trebuie să depăşească 1 g. Pentru furaje combinate,
aceasta poate fi de maximum 5 g. O parte de alicotă de 10 ml din filtrat este
corespunzătoare în majoritatea cazurilor. Aceasta trebuie să conţină 50 până la
100 ug de gosipol. Pentru determinarea gosipolului total, proba-test trebuie să
fie între 0,5 şi 5 g, pentru ca o parte de 2 ml de alicotă din filtrat să
conţină 40 până la 200 ug de gosipol.
Analiza trebuie să fie efectuată la o temperatură a
camerei de aproximativ 20°C.
5.2. Determinarea de gosipol liber
Se plasează proba-test într-o retortă cu gât strâmt de
250 ml, fundul retortei fiind acoperit cu sticlă pisată. Utilizându-se o
pipetă, se adaugă 50 ml de solvent A (pct. 3.2), se astupă retorta şi se
amestecă timp de o oră cu mixerul. Se filtrează printr-un filtru uscat şi se
colectează filtratul într-o retortă cu gâtul strâmt. Se acoperă pâlnia în
timpul filtrării cu o sticlă de ceas. Se pipetează părţi identice de alicotă
din filtrat ce conţine 50 până la 100 ug de gosipol în fiecare din cele două
retorte gradate de 25 ml (A şi B). Dacă este necesar, se aduce la volum până la
10 ml cu solventul A (pct. 3.2). Apoi se aduce la volum conţinutul retortei (A)
cu amestec de propan-2-ol-hexan (pct. 3.1). Această soluţie este utilizată ca
soluţie de referinţă faţă de care se măsoară soluţia probei.
Se pipetează 10 ml de solvent A (pct. 3.2) în fiecare
dintre celelalte două retorte gradate de 25 ml (C şi D). Se aduce la volum
conţinutul retortei (C) cu amestec de propan-2-ol-hexan (pct. 3.1). Această
soluţie este utilizată ca soluţie de referinţă faţă de care se măsoară soluţia
testului martor.
Se adaugă 2 ml de anilină (pct.
3.4) în fiecare dintre retorte (D) şi (B). Se încălzeşte timp de 30 de minute
deasupra unei băi de apă fierbinte, pentru a dezvolta culoarea. Se răceşte la
temperatura camerei, se aduce la volum cu amestec de propan-2-ol-hexan (pct.
3.1), se omogenizează şi se lasă să stea timp de o oră.
Se determină densitatea optică a soluţiei testului
martor (D) prin comparare cu soluţia de referinţă (C) şi densitatea optică a
soluţiei probei (B) prin comparare cu soluţia de referinţă (A), cu
spectrofotometru la o lungime de undă de 440 nm, utilizându-se celule de sticlă
de 1 cm.
Se scade densitatea optică a soluţiei testului martor
din cea a soluţiei probei (= densitatea optică corectată). Din această valoare
se calculează conţinutul în gosipol liber, aşa cum s-a indicat la pct. 6.
5.3. Determinarea gosipolului total
Se plasează o probă-test ce conţine 1 până la 5 mg de
gosipol într-o retortă gradată de 50 ml şi se adaugă 10 ml de solvent B (pct.
3.3). In acelaşi timp, se prepară un test martor, plasând 10 ml de solvent B
(pct. 3.3) în altă retortă gradată de 50 ml. Se încălzesc cele două retorte
timp de 30 de minute deasupra unei băi de apă fierbinte. Se răceşte la
temperatura camerei şi se aduce la volum conţinutul fiecărei retorte cu amestec
de propan-2-ol-hexan (pct. 3.1), se omogenizează şi se lasă să sedimenteze timp
de 10 până la 15 minute, apoi se filtrează şi se colectează filtratele în
retorte de sticlă mată cu gât strâmt.
Se pipetează 2 ml de filtrat al probei în fiecare
dintre cele două retorte gradate de 25 ml şi încă 2 ml de filtrat al probei
martor în fiecare dintre alte două retorte de 25 ml. Se aduce la volum
conţinutul unei retorte din fiecare serie până la 25 ml, cu amestec de
propan-2-ol-hexan (pct. 3.1). Aceste soluţii sunt utilizate ca soluţii de
referinţă.
Se adaugă 2 ml de anilină (pct. 3.4) în fiecare dintre
cele două retorte. Se încălzeşte timp de 30 de minute deasupra unei băi de apă
fierbinte, pentru a dezvolta culoarea. Se răceşte la temperatura camerei, se
aduce la volumul de 25ml cu amestec de propan-2-ol-hexan (pct. 3.1), se
omogenizează şi se lasă să sedimenteze timp de o oră.
Se determină densitatea optică, aşa cum s-a indicat la
pct. 5.2 pentru gosipolul liber. Din această valoare se calculează conţinutul
de gosipol liber, aşa cum s-a indicat la pct. 6.
6. Calcularea rezultatelor
Rezultatele pot fi calculate fie pornindu-se de la
densitatea optică specifică (pct. 6.1), fie prin referire la o curbă de
calibrare (pct. 6.2).
6.1. Utilizarea densităţii optice specifice
Densităţile optice specifice, în baza condiţiilor
descrise, sunt următoarele:
gosipol liber: E _1% = 625
1cm
gosipol total: E _1% = 600
1cm
Conţinutul de gosipol liber şi total al probei este
calculat după următoarea formulă:
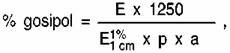
unde:
E = densitatea optică corectată, determinată aşa cum
s-a indicat la pct. 5.2;
p = proba-test, în g;
a = parte de alicotă a filtratului, în ml;
6.2. Utilizarea curbei de calibrare
6.2.1. Gosipol liber
Se prepară două serii de cinci retorte gradate de 25
ml. Se pipetează alicote de 2,0, 4,0, 6,0, 8,0 şi 10,0 de soluţie standard A de
gosipol (pct. 3.5) în fiecare serie de retorte. Se aduce la volum până la 10 ml
cu solvent A (pct. 3.2). Se completează fiecare serie cu o retortă gradată de
25 ml care conţine numai 10 ml de solvent A (pct. 3.2) (test martor).
Se aduc la volum retortele din primele serii (incluzând
retorta pentru testul martor) până la 25 ml cu amestec de propan-2-ol-hexan
(pct. 3.1) (serii de referinţă).
Se adaugă 2 ml de anilină (pct. 3.4) pentru fiecare
retortă din a doua serie (incluzând retorta pentru testul blanc). Se încălzeşte
timp de 30 de minute într-o baie de apă fierbinte pentru a dezvolta culoarea.
Se răceşte la temperatura camerei, se aduce la volum cu amestec de
propan-2-ol-hexan (pct. 3.1), se omogenizează şi se lasă să stea timp de o oră
(serii standard).
Densitatea optică a soluţiilor din seriile standard se
determină, aşa cum s-a indicat la pct. 5.2, prin comparare cu soluţiile
corespunzătoare din seriile de referinţă. Se trasează curba de calibrare prin
schiţarea densităţii optice în raport cu cantităţile de gosipol (în ug).
6.2.2. Gosipol total
Se prepară 6 retorte gradate de 50 ml. In prima retortă
se plasează 10 ml de solvent B (pct. 3.3), iar în celelalte se plasează respectiv
2,0, 4,0, 6,0, 8,0 şi 10,0 ml de soluţie standard B de gosipol (pct. 3.6). Se
umple conţinutul fiecărei retorte până la 10 ml cu solvent B (pct. 3.3). Se
încălzeşte timp de 30 de minute într-o baie de apă fierbinte. Se răceşte la
temperatura camerei, se umple volumul cu amestec de propan-2-ol-hexan (pct.
3.1) şi se omogenizează.
Se plasează 2,0 ml din aceste soluţii în fiecare dintre
cele două serii de 6 retorte gradate de 25 ml. Se umple conţinutul retortelor
din prima serie până la 25 ml cu amestec de propan-2-ol-hexan (pct. 3.1) (serii
de referinţă).
Se adaugă 2 ml de anilină (pct. 3.4) în fiecare retortă
dintre cele două serii. Se încălzeşte timp de 30 de minute într-o baie cu apă
fierbinte. Se răceşte la temperatura camerei, se aduce la volum cu amestec de
propan-2-ol-hexan (pct. 3.1), se omogenizează şi se lasă să stea timp de o oră
(serii standard).
Se determină densitatea optică a soluţiilor din seriile
standard, aşa cum s-a indicat la pct. 5.2, prin comparare cu soluţiile
corespunzătoare din seriile de referinţă. Se trasează curba de calibrare prin
schiţarea densităţii optice în raport cu cantităţile de gosipol (în ug).
6.3. Repetabilitate
Diferenţa dintre rezultatele celor două determinări
paralele efectuate pe aceeaşi probă trebuie să fie de maximum:
a) 15%, în valoare absolută, pentru conţinut de
gosipol mai mic de 500 ppm;
b) 75 ppm, în valoare absolută, pentru conţinut de
gosipol de minimum 500 ppm şi maximum 750 ppm;
c) 10%, în valoare absolută, pentru conţinut de
gosipol mai mare de 750 ppm.
ANEXA Nr. 2 la norma sanitară veterinară
I. DETERMINAREA TILOZINEI
- prin difuziune pe agar -
1. Scop şi domeniu de
aplicare
Această metodă se utilizează pentru determinarea
conţinutului de tilozină din furaje, concentrate şi premixuri, atunci când este
prezentă în cantitate mai mare de 2 ppm.
2. Principiu
Proba trebuie tratată cu o soluţie tampon fosfat la pH
8, încălzită anterior la 80°C şi apoi extrasă cu metanol. După centrifugare,
extrasul trebuie diluat şi determinată activitatea antibiotică a acestuia prin
măsurarea difuziei tilozinei pe mediu de agar însămânţat cu Sarcina Iutea.
Difuzia este evidenţiată prin formarea de zone de inhibiţie în prezenţa
microorganismului. Diametrul acestor zone este direct proporţional cu
logaritmul concentraţiei de antibiotic.
3. Microorganism: Sarcina Iutea ATCC nr. 9341
3.1. Intreţinerea tulpinii parentale
Se inoculează cu Sarcina Iutea un tub de agar înclinat
prelevat din mediul de cultură (pct. 4.1), se ajustează până la pH 7,0. Se incubează
peste noapte la aproximativ 35°C. Se ţine cultura într-un refrigerator şi se
reinoculează agarul înclinat cu aceasta în fiecare lună.
3.2. Prepararea suspensiei bacteriene
Se colectează bacteriile dintr-o eprubetă cu agar
înclinat, recent preparată (pct. 3.1), utilizându-se 2 până la 3 ml de soluţie
fiziologică salină (pct. 4.4). Cu această suspensie se însămânţează o retortă
Roux ce conţine 250 ml mediu de cultură (pct. 4.1), ajustat la pH 7,0. Se
incubează timp de 24 de ore, la 35°C, apoi se colectează bacteriile în 25 ml de
ser fiziologic (pct. 4.4). Se omogenizează şi se diluează această suspensie
pentru a se obţine o transmisie a luminii de aproximativ 75% la 650 nm.
Această soluţie poate fi utilizată timp de o săptămână,
dacă a fost ţinută într-un refrigerator.
Prin teste preliminarii pe plăcuţe cu mediu primar
pentru determinare (pct. 4.1) se stabileşte cantitatea de inocul care, pentru
diferite concentraţii de tilozină utilizate, va induce cele mai mari zone de
inhibiţie posibile ce sunt încă clare. Mediul de cultură este inoculat la
temperaturi între 48 până la 50°C.
4. Medii de cultură şi
reactivi
4.1. Mediu primar pentru determinare (1)
Glucoza
1 g
Peptonă triptică 10
g
Extract de
carne 1,5 g
Extract de
drojdie 3 g
Agar, conform cu calitatea 10 până la 20 g
Apă distilată până la
1.000 ml
Se ajustează pH-ul la 7, imediat înainte de utilizare, pentru a se
întreţine tulpina parentală şi prepararea suspensiei de bacterii şi la pH 8 pentru determinare.
4.2. Soluţie tampon fosfat, pH 8
Fosfat de potasiu dehidrogenat 0,523 g KH2PO4
A.R.
Fosfat de dipotasiu hidrogenat 16,730 g K2HPO4
A.R.
Apă
distilată până la 1.000 ml
4.3. Soluţie tampon fosfat, pH 7
Fosfat de potasiu dehidrogenat 5,5 g KH2PO4
A.R.
Fosfat de dipotasiu hidrogenat 13,6 g K2HPO4
A.R.
Apă
distilată până la 1.000 ml
4.4. Ser fiziologic steril.
4.5. Metanol pur.
4.6. Metanol 40% (v/v)
4.7. Amestec de soluţie tampon fosfat (pct. 4.2)/
metanol pur: 60/40 ca volum.
4.8. Substanţă standard:
tilozină cu activitate cunoscută.
5. Soluţii standard
Se usucă substanţa standard (pct. 4.8) timp de 3 ore la
60°C într-un cuptor cu vacuum (5 mm de mercur). Se cântăresc 10 până la 50 mg
într-o retortă gradată, se dizolvă în 5 ml de metanol (pct. 4.5) şi se diluează
soluţia cu soluţie tampon fosfat, pH 7 (pct. 4.3), pentru a se obţine o
concentraţie de tilozină bază de 1.000 ug per ml.
Se prepară din această soluţie de stoc o soluţie
standard de lucru S8 ce conţine 2 ug per ml de tilozină bază prin diluare cu amestecul
(pct. 4.7).
Se prepară apoi prin diluţii succesive (1+1),
utilizându-se amestecul (pct. 4.7), următoarele concentraţii:
S4 1
ug/ml
S2
0,5 ug/ml
S1
0,25 ug/ml
6. Extracţie
Pentru concentrate, se ia o probă-test de 10 g; pentru
premixuri şi furaje, o probă test de 20 g. Se adaugă 60 ml de soluţie tampon
fosfat, pH 8 (pct. 4.2), încălzită anterior până la 80°C, şi se omogenizează
timp de două minute (cu mixer domestic, Ultra-turrax etc).
Se lasă să sedimenteze timp de 10 minute, se adaugă 40
ml de metanol (pct. 4.5) şi se omogenizează timp de 5 minute. Se centrifughează
extractul şi se diluează o parte alicotă cu amestecul (pct. 4.7), pentru a se
obţine o concentraţie prezumtivă de tilozină de 2 ug per ml (= U8). Se prepară apoi concentraţiile U4, U2 şi U1
prin diluţii succesive (1 +1), utilizându-se amestecul (pct. 4.7).
Pentru un conţinut mai mic de 10 ppm, se evaporă
extractul până se usucă, într-un evaporator rotativ la 35°C, şi se dizolvă
reziduul în metanol 40% (pct. 4.6).
7. Metodă de determinare
7.1. Inocularea mediului de cultură
Se inoculează mediul primar pentru determinare, la 48
până la 50°C (pct. 4.1), se ajustează până la pH 8,0, cu suspensie de bacterii
(pct. 3.2).
7.2. Prepararea plăcilor
Difuzia în agar este efectuată pe plăci, utilizându-se
4 concentraţii de soluţii standard (S8 S4, S2, S1) şi 4 concentraţii ale extractului (U8 U4, U2 U1).
Cele 4 concentraţii ale soluţiei standard şi ale extractului trebuie să fie
plasate în fiecare placă.
De aceea, se aleg tăvi ce sunt destul de mari pentru a
permite ca cel puţin 8 godeuri cu diametrul de 10 până la 13 mm să fie
realizate în mediu de agar. Se calculează necesarul de mediu de cultură de
inoculat (pct. 7.1) pentru a se furniza o acoperire uniformă de aproximativ 2
mm grosime. Testul trebuie să fie efectuat, de preferinţă, pe plăci ce constau
din plăci plate de sticlă, echipate cu un inel din aluminiu sau plastic perfectat la nivel, cu diametrul de
200 mm şi înalt de 20 mm.
Se pipetează în godeuri cantităţile măsurate cu
acurateţe între 0,1 şi 0,15 ml de soluţie antibiotică, depinzând de diametrul
godeurilor.
Pentru fiecare probă se repetă difuzia de cel puţin 4
ori cu fiecare concentraţie, în aşa fel încât fiecare determinare să cuprindă o
evaluare de 32 de zone de inhibiţie.
7.3. Incubare
Se incubează tăvile peste noapte, la 35 până la 37°C.
8. Evaluare
Se măsoară diametrul zonelor de inhibiţie, de
preferinţă prin proiectare. Se înregistrează măsurătorile pe hârtie
semilogaritmică, împărţind logaritmul concentraţiilor la diametrul zonelor de
inhibiţie. Se urmăresc liniile soluţiei standard şi ale extractului. Cele două
linii sunt paralele, cu condiţia să nu existe nicio interferenţă.
Logaritmul activităţii relative este calculat
utilizându-se următoarea formulă:
(U1 + U2 + U4+U8
- S1 - S2 - S4 - S8 ) x 0,602
U4+U8+S4+S8
- U1 - U2 - S1 - S2
Activitate reală = activitate prezumată x activitate
relativă.
9. Repetabilitate
Diferenţa dintre rezultatele a două determinări
paralele, efectuate pe aceeaşi probă, nu trebuie să depăşească 10% în valoare
relativă.
II. DETERMINAREA VIRGINIAMICINEI
- prin difuziune pe un mediu de agar -
1. Scop şi domeniu de
aplicare
Metoda se utilizează pentru determinarea
virginiamicinei din furaje şi premixuri. Limita cea mai joasă de determinare
este 2 mg/kg (2 ppm)(1).
2. Principiu
Proba trebuie extrasă cu o soluţie metanolică de Tween
80. Extractul este decantat sau centrifugat şi diluat. Activitatea antibiotică
a acestuia se determină prin măsurarea difuziei virginiamicinei într-un mediu
de agar inoculat cu Micrococcus Iuteus. Difuzia este relevată prin formarea de zone de inhibiţie ale
microorganismului. Diametrul acestor zone este estimat a fi direct proporţional
cu logaritmul concentraţiei de antibiotic peste limita concentraţiilor de antibiotic
utilizate.
3. Microorganism: Micrococcus Iuteus ATCC
9341 (NCTC 8340, NCIB 8553)
3.1. Intreţinerea culturii stoc
Se inoculează eprubete ce conţin medii de cultură
înclinate (pct. 4.1) cu Micrococcus Iuteus şi se incubează timp de 24 de ore la 30°C. Se păstrează cultura
într-un refrigerator, la aproximativ 4°C. Se reinoculează la fiecare două
săptămâni.
3.2. Prepararea suspensiei bacteriene(a)
Se recoltează creşterea bacteriană dintr-un agar
înclinat, recent preparat (pct. 3.1) cu 2 până la 3 ml de soluţie de clorură de
sodiu (pct. 4.3). Se utilizează această suspensie pentru a se inocula 250 ml de
cultură de mediu (pct. 4.1) conţinută într-o retortă Roux şi se incubează timp
de 18 până la 20 de ore la 30°C. Se recoltează creşterea bacteriană în 25 ml de
soluţie de clorură de sodiu (pct. 4.3) şi se amestecă. Se diluează suspensia
până la 1/10 cu soluţie de
clorură de sodiu (pct. 4.3). Transmisia de lumină a suspensiei trebuie să fie
de aproximativ 75%, măsurată la 650 nm, într-o celulă de 1 cm, faţă de soluţie
de clorură de sodiu. Această suspensie poate fi păstrată timp de o săptămână,
la aproximativ 4°C.
4. Medii de cultură şi
reactivi
4.1. Mediu de cultură şi de probă(b)
Peptonă de carne
6 g
Triptonă
4 g
Extract de drojdie
3 g
Extract de carne
1,5 g
Glucoza
1 g
Agar 10 până la
20 g
Apă 1.000 ml pH 6,5 (după stilizare).
4.2. Fosfat tampon, pH 6
Fosfat acid de potasiu, KpHPO. 2g
Fosfat diacid de potasiu, KH2PO4
8g
Apă până la 1.000
ml
4.3. Soluţie de clorură de sodiu 0,8% (w/v): se
dizolvă 8 g de clorură de sodiu în apă şi se diluează până la 1.000 ml, apoi
se sterilizează.
4.4. Metanol
4.5. Amestec de fosfat tampon (pct. 4.2)/metanol (pct.
4.4): 80/20 (v/v).
4.6. Soluţie metanolică Tween 80 0,5% (w/v): se
dizolvă 5 g de Tween 80 în metanol (pct. 4.4) şi se diluează cu metanol până la
1.000 ml.
4.7. Substanţă standard: virginiamicină cu activitate
cunoscută.
5. Soluţii standard
Se dizolvă o cantitate din substanţa standard cântărită
cu acurateţe (pct. 4.7) în metanol (pct. 4.4) şi se diluează cu metanol (pct.
4.4), pentru a se obţine o soluţie stoc ce conţine 1.000 ug de virginiamicină
per ml.
Depozitată într-o retortă astupată la 4°C, această
soluţie este stabilă până la 5 zile.
Din această soluţie stoc se prepară, prin diluţie
succesivă cu amestecul (pct. 4.5), următoarele soluţii:
S8
1 ug/ml;
S4
0,5 ug/ml;
S2
0,25 ug/ml;
S1
0,125 ug/ml.
6. Prepararea extractului
şi a soluţiilor de testare
6.1. Extracţie
6.1.1. Produse cu un conţinut de virginiamicină de
până la 100 mg/kg
Se cântăreşte o cantitate din probă de 50 g, se adaugă
200 ml de soluţie (pct. 4.6) şi se agită timp de 30 de minute. Se lasă să se
sedimenteze sau se centrifughează, se iau 20 ml de soluţie de supernatant şi se
evaporă până la aproximativ 5 ml, într-un evaporator rotativ, la o temperatură
ce nu depăşeşte 40°C. Se diluează reziduul cu amestecul (pct. 4.5), pentru a se
obţine un conţinut de virginiamicină estimat la 1 ug/ml (= U8).
6.1.2. Produse cu un conţinut de virginiamicină mai
mare de 100 mg/kg
Se cântăreşte o cantitate de probă ce nu depăşeşte 10 g
şi care conţine între 1-50 mg de virginiamicină, se adaugă 100 ml de soluţie (pct.
4.6) şi se agită timp de 30 de minute. Se lasă să se sedimenteze sau se
centrifughează, apoi se diluează soluţia de supernatant cu amestecul (pct.
4.5), pentru a se obţine un conţinut de virginiamicină estimat de 1 ug/ml ( = U8).
(1) 1 mg de virginiamicină
este echivalent cu 1.000 de unităţi UK.
(a) Pot fi
utilizate alte metode, cu condiţia să fi fost stabilit că acestea dau suspensii
bacteriene similare.
(b) Poate fi
utilizat orice mediu de cultură comercial de compoziţie similară şi care dă
aceleaşi rezultate.
6.2. Soluţii de probă
Din soluţia U8 se prepară soluţii U4 (conţinut estimat: 0,5 ug/ml), U2 (conţinut estimat: 0,25 ug/ml) şi U1 (conţinut estimat: 0,125 ug/ml) prin intermediul diluţiei
succesive (1+1) cu amestecul (pct. 4.5).
7. Procedura de testare
7.1. Inocularea mediului de testare
Se inoculează mediul de testare (pct. 4.1) cu suspensie
bacteriană (pct. 3.2) la aproximativ 50°C. Prin teste preliminare pe plăci cu
mediu (pct. 4.1) se determină cantitatea de suspensie bacteriană necesară
pentru a induce cele mai mari şi mai clare zone de inhibiţie, cu concentraţii
variate de virginiamicină.
7.2. Prepararea plăcilor
Difuzia pe agar este efectuată pe plăci cu 4
concentraţii ale soluţiei standard (S8, S4, S2 şi S1) şi cele patru concentraţii ale
soluţiei de testare (U8, U4, U2 şi U1). Aceste 4 concentraţii de extract
şi de standard trebuie neapărat să fie plasate în fiecare placă. In acest scop,
se selectează plăci destul de mari pentru a permite realizarea a cel puţin 8
godeuri cu diametrul de 10 până la 13 mm şi de cel puţin 30 mm între centre, ce
trebuie realizate în mediu de agar. Testul poate fi efectuat pe plăci ce
constau din plăci plate de sticlă echipate cu un inel perfectat la nivel, din
aluminiu sau plastic, cu diametrul de 200 mm şi înalt de 20 mm.
Se toarnă în plăci o cantitate de mediu (pct. 4.1), se
inoculează ca la pct. 7.1, pentru a se obţine o grosime de aproximativ 2 mm (60
ml pentru o placă cu diametrul de 200 mm). Se lasă să se fixeze la o poziţie de
nivel, se realizează godeurile şi se plasează în acestea volume măsurate cu
exactitate de testare şi din soluţii standard (între 0,1 şi 0,15 ml per gaură,
în conformitate cu diametrul). Se replică fiecare concentraţie de cel puţin 4
ori, astfel încât fiecare determinare să fie supusă unei evaluări a 32 de zone
de inhibiţie.
7.3. Incubare
Se incubează plăcile timp de 16 până la 18 ore la 30 ±
2°C.
8. Evaluare
Se măsoară diametrul zonelor de inhibiţie cu o
aproximaţie de 0,1 mm. Se înregistrează măsurătorile medii pentru fiecare
concentraţie pe hârtie grafică semi-logaritmică, relevându-se logaritmul
concentraţiilor în legătură cu diametrele zonelor de inhibiţie. Se schiţează
liniile cele mai potrivite, atât ale soluţiei standard, cât şi ale extractului.
Se determină punctul „cel mai potrivit" pentru nivelul standard cel mai
scăzut (SL), utilizându-se formula:
a) SL = 7S1+4S2+S4
- 2S8
10
Se determină punctul „cel mai potrivit" pentru
nivelul standard cel mai înalt (SH), utilizându-se formula:
b) SH = 7S8+4S4+S2
- 2S1
10
Se calculează în mod similar punctele „cele mai
potrivite" pentru nivelul cel mai scăzut (UL) al extractului şi nivelul
cel mai înalt al extractului, înlocuind U1U2, U4 şi U8 pentru S1,S2,
S4 şi S8 în formula anterioară.
Se înregistrează valorile calculate SL şi SH pe aceeaşi
hârtie grafică şi acestea se unesc, pentru a da linia „cea mai potrivită"
pentru soluţia standard. Se înregistrează, în mod similar, UL şi UH şi acestea
se unesc, pentru a da linia „cea mai potrivită" pentru extract.
Liniile trebuie să fie paralele în absenţa oricărei
interferenţe. Din motive practice, liniile pot fi considerate paralele, dacă
valorile (SH - SL) şi (UH - UL) nu diferă cu mai mult de 10% din valoarea medie
a acestora.
Dacă liniile sunt estimate a nu fi paralele, fie U1 şi S1 sau U8 şi S8 pot fi ignorate şi SL, SH, UL şi UH
calculate, utilizându-se formula alternativă, pentru a da liniile alternative
„cele mai potrivite":
a') SL = 5S1 + 2S2 - S4
sau SL = 5S2 + 2S2 - S8
6 6
b') SH = 5S4 + 2S2 - S1 sau
SH = 5S8 + 2S4 - S2
6 6
şi în mod similar pentru UL şi UH. Trebuie să fie
îndeplinite aceleaşi criterii de paralelism. Trebuie să fie notat în raportul
final faptul că rezultatul a fost calculat pornindu-se de la 3 niveluri.
Atunci când liniile sunt considerate ca fiind paralele,
se calculează logaritmul activităţii relative (log A) prin intermediul uneia
dintre următoarele formule, depinzând dacă au fost utilizate 3 sau 4 niveluri pentru evaluarea paralelismului.
Pentru 4 niveluri:
c) Log A = (U1+U2+U4+U8
- S1 - S2 - S4 - S8) x 0,602
U4+U8+S4+S8
- U1 - U2 - S1 - S2
Pentru 3 niveluri:
d) Log A = (U1+U2+U4
- S1 - S2 - S4 ) x 0,401
U4+S4 -
U1 - S1
sau
d') Log A = (U2+U4+U8
- S2 - S4 - S8) x 0,401
U8+S8
- U2 - S2
Activitatea extractului de probă = activitatea
standardului relevant x A
(U8 = S8 x A)
Dacă se constată că activitatea relativă este în afara
intervalului 0,5 până la 2,0, atunci se repetă testarea, efectuându-se
ajustările corespunzătoare la concentraţiile extractului sau, dacă acest lucru
nu este posibil, la soluţiile standard. Atunci când activitatea relativă nu
poate fi adusă în intervalul solicitat, orice rezultat obţinut trebuie să fie
considerat ca aproximativ şi acesta trebuie să fie notat în raportul final.
Atunci când liniile sunt considerate ca nefiind
paralele, se repetă determinarea. Dacă paralelismul nu este încă atins,
determinarea trebuie să fie considerată ca nesatisfăcătoare.
Se exprimă rezultatul în miligrame de virginiamicină
per kilogram de furaj.
9. Repetabilitate
Diferenţa dintre rezultatele a două determinări
paralele, efectuate pe aceeaşi probă, de acelaşi analist, trebuie să fie de
maximum:
- 2 mg/kg, în valoare absolută, pentru un conţinut de
virginiamicină de până la 10 mg/kg;
- 20% în relaţie cu cea mai mare valoare pentru un
conţinut de 10 până la 25 mg/kg;
- 5 mg/kg, în valoare absolută, pentru un conţinut
de 25 până la 50 mg/kg;
- 10% în relaţie cu cea mai mare valoare pentru un
conţinut de peste 50 mg/kg.