ORDIN Nr. 20
din 1 februarie 2007
privind aprobarea Normei
sanitare veterinare ce stabileste metode comunitare de analiza pentru
determinarea vitaminei A, a vitaminei E si a triptofanului din furaje
ACT EMIS DE:
AUTORITATEA SANITARA VETERINARA SI PENTRU SIGURANTA ALIMENTE
ACT PUBLICAT IN:
MONITORUL OFICIAL NR. 147 din 28 februarie 2007
Văzând Referatul de aprobare nr. 15.442 din 25 ianuarie
2007, întocmit de Direcţia generală sanitară veterinară din cadrul Autorităţii
Naţionale Sanitare Veterinare şi pentru Siguranţa Alimentelor,
având în vedere prevederile art.
10 lit. b) din Ordonanţa Guvernului nr. 42/2004 privind organizarea activităţii
sanitar-veterinare şi pentru siguranţa alimentelor, aprobată cu modificări şi
completări prin Legea nr. 215/2004, cu modificările şi completările ulterioare,
în temeiul art. 3 alin. (3) şi
al art. 4 alin. (3) din Hotărârea Guvernului nr. 130/2006 privind organizarea
şi funcţionarea Autorităţii Naţionale Sanitare Veterinare şi pentru Siguranţa
Alimentelor şi a unităţilor din subordinea acesteia,
preşedintele Autorităţii Naţionale Sanitare
Veterinare şi pentru Siguranţa Alimentelor emite
următorul ordin:
Art. 1. - Se aprobă Norma sanitară veterinară ce
stabileşte metode comunitare de analiză pentru determinarea vitaminei A, a
vitaminei E si a triptofanului din furaje, prevăzută în anexa care face parte
integrantă din prezentul ordin.
Art. 2. - Autoritatea Naţională Sanitară Veterinară şi
pentru Siguranţa Alimentelor, institutele veterinare centrale şi direcţiile
sanitare veterinare şi pentru siguranţa alimentelor judeţene şi a municipiului
Bucureşti vor duce la îndeplinire prevederile prezentului ordin.
Art. 3. - La data intrării în vigoare a prezentului
ordin se abrogă Ordinul ministrului agriculturii, pădurilor, apelor şi mediului
nr. 967/2003 pentru aprobarea Normei sanitare veterinare ce stabileşte metode naţionale de analiză pentru
determinarea vitaminei A, a vitaminei E si a triptofanului din furaje, publicat
în Monitorul Oficial al României, Partea I, nr. 7 din 7
ianuarie 2004.
Art. 4. - Prezentul ordin transpune Directiva Consiliului 2000/45/CE ce stabileşte metode comunitare de analiză
pentru determinarea vitaminei A, a vitaminei E şi a triptofanului din furaje,
publicată în Jurnalul Oficial al Comunităţilor Europene (JOCE) nr. L 174 din 13
iulie 2000, p. 32.
Art. 5. - Prezentul ordin va fi publicat în Monitorul
Oficial al României, Partea I şi va intra în vigoare
la 10 zile de la publicare.
Preşedintele Autorităţii Naţionale Sanitare Veterinare
şi pentru Siguranţa Alimentelor,
Marian Avram
ANEXĂ
NORMĂ SANITARĂ VETERINARĂ
ce stabileşte metode comunitare de analiză pentru
determinarea vitaminei A, a vitaminei E si a triptofanului din furaje
Art. 1. - Autoritatea veterinară centrală a României
trebuie să solicite ca analizele efectuate în scopul controalelor oficiale
pentru determinarea conţinutului de vitamina A, vitamina E şi triptofan al
furajelor şi premixurilor să fie efectuate folosindu-se metoda stabilită în
anexa la prezenta normă sanitară veterinară.
Art. 2. - Autoritatea veterinară centrală a României
informează Comisia Europeană cu privire la actele normative şi prevederile
administrative necesare pentru implementarea prezentei norme sanitare
veterinare.
Art. 3. - Anexa face parte integrantă din prezenta
normă sanitară veterinară.
ANEXĂ
la norma sanitară veterinară
PARTEA A: Determinarea vitaminei A (retinol)
1. Scop şi domeniu
Această metodă se foloseşte pentru determinarea
vitaminei A (retinol) din furaje şi premixuri. Vitamina A include toţi compuşii
alcool trans-retinol şi izomerii cis. Conţinutul de vitamina A este exprimat în
unităţi internaţionale (Ul)/kg. O unitate internaţională corespunde activităţii
a 0,300 µg a tuturor
compuşilor alcoolici trans ai vitaminei A sau 0,344 µg a tuturor compuşilor acetaţi trans ai vitaminei A ori 0,550 µg a tuturor compuşilor palmitaţi trans ai
vitaminei A. Limita de determinare este de 2.000 UI vitamina A/kg.
2. Principiul metodei
Proba este hidrolizată cu soluţie etanolică de hidroxid
de potasiu, iar vitamina A este extrasă în eter de petrol. Solventul este
înlăturat prin evaporare, iar reziduul este diluat în metanol şi, dacă este necesar, diluat până la concentraţia
necesară. Conţinutul de vitamina A este determinat prin lichid cromatografie de
înaltă performanţă cu fază inversă (RP-HPLC), folosindu-se un detector cu UV
sau cu fluorescentă. Parametrii cromatografici sunt aleşi astfel încât să nu
existe nicio diferenţă între toţi compuşii alcoolici trans ai vitaminei A şi
izomerii cis.
3. Reactivi:
3.1. Etanol, c = 96%, anhidru
3.2. Eter de petrol, interval de fierbere 40°-60°C
3.3. Metanol
3.4. Soluţie de hidroxid de potasiu, β = 50 g/100 ml
3.5. Soluţia de ascorbat de sodiu, β = 10 g/100 ml (a se vedea observaţiile
de la pct. 7.7)
3.6. Sulfit de sodiu, Na2S x H20
(x = 7-9)
3.6.1. Soluţie de sulfit de sodiu,
c = 0,5 mol/l în glicerol, β
= 120 g/l (pentru x = 9) (a se vedea observaţiile de la pct. 7.8)
3.7. Soluţie de fenoftaleină, β = 2 g/100 ml în etanol (pct. 3.1)
3.8. 2-Propanol
3.9. Faza mobilă pentru HPLC: amestec de metanol
(pct. 3.3) şi apă, de exemplu 980 + 20 (v + v).
Raportul exact trebuie determinat prin intermediul caracteristicilor coloanei
folosite.
3.10. Azot, liber de oxigen
3.11. Acetat de vitamina A trans total, extrapur, cu
activitate certificată, de exemplu 2,80 x 106 Ul/g
3.11.1. Soluţie stoc din
vitamina A acetat trans total: se cântăresc, cu aproximaţie de 0,1 mg, 50 mg
din acetat de vitamina A (pct. 3.11) într-un balon cotat de 100 ml. Se dizolvă
în 2-propanol (pct. 3.8) şi se completează până la semn cu acelaşi solvent.
Concentraţia nominală a acestei soluţii este de 1.400 UI vitamina A/ml. Conţinutul exact trebuie determinat
în conformitate cu pct. 5.6.3.1.
3.12. Palmitat de vitamina A, extrapur, cu activitate
certificată, de exemplu 1,80 x 106 Ul/g
3.12.1. Soluţie stoc din retinol palmitat trans total:
se cântăresc, cu aproximaţie de 0,1 mg, 80 mg din palmitat de vitamina A (pct.
3.12) într-un balon cotat de 100 ml. Se dizolvă în 2-propanol (pct. 3.8) şi se
completează până la semn cu acelaşi solvent. Concentraţia nominală a acestei
soluţii este de 1.400 UI vitamina A/ml. Conţinutul exact trebuie determinat în conformitate cu pct.
5.6.3.2.
3.13. 2,6-di-tert-butil-4-metilfenol (BHT) (a se
vedea observaţiile de la pct. 7.5).
4. Aparatură:
4.1. Evaporator rotativ cu vacuum
4.2. Sticlărie brună
4.2.1. Baloane cu fund plat sau conice de 500 ml, cu
şlif
4.2.2. Baloane cotate cu dopuri rodate, cu gât
îngust, cu capacitate de 10, 25, 100 şi 500 ml
4.2.3. Pâlnii de separare, conice, de 1.000 ml, cu
dopuri din sticlă
4.2.4. Baloane piriforme din
sticlă de 250 ml cu şlif
4.3. Condensator Allihn, de 300 mm, cu legătură din
sticlă, cu adaptator pentru o pipă de aprovizionare cu gaz
4.4. Hârtie de filtru pentru separarea fazică, cu
diametrul de 185 mm (de exemplu Schleicher &
Schuell 597 HY1/2 sau similar)
4.5. Lichid cromatografie de înaltă presiune
(echipament HPLC cu sistem de injecţie)
4.5.1. Coloană de lichid cromatografie, 250 mm x 4 mm,
C18, de 5 sau 10 µm sau echivalent (criteriu de performanţă: doar un singur peak
pentru toţi izomerii retinolului în baza condiţiilor HPLC)
4.5.2. Detector UV sau de fluorescentă, cu ajustare
variabilă a lungimii de undă
4.6. Spectrofotometru cu cuve de cuarţ de 10 mm
4.7. Baie de apă cu agitator magnetic
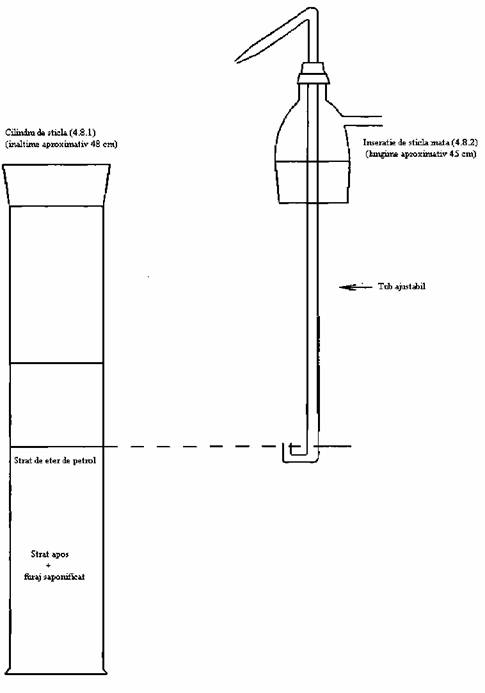
4.8. Aparat de extracţie ce constă din:
4.8.1. Cilindru de sticlă cu capacitate de 1 l, echipat cu gât şi dop rodat;
4.8.2. Mufă rodată, echipată cu un braţ exterior şi
un tub ajustabil ce trece prin centru. Tubul ajustabil trebuie să aibă un capăt
în formă de U în partea de jos şi o parte efilată la partea opusă, astfel încât
stratul superior de lichid din cilindru să poată fi transferat într-un tub de
separare.
5. Procedură
NOTĂ: Vitamina A este sensibilă la lumină (UV) şi
oxidare. Toate operaţiunile trebuie efectuate în absenţa luminii (folosindu-se
sticlărie brună sau sticlărie protejată cu folie de aluminiu) şi a oxigenului
(a se purja cu azot). In timpul extracţiei aerul de deasupra lichidului trebuie
înlocuit cu azot (evitaţi presiunea în exces prin lărgirea dopului din când în când).
5.1. Pregătirea probei
Se mărunţeşte proba astfel încât să treacă printr-o
sită cu ochiuri de 1 mm, avându-se grijă să se evite generarea de căldură.
Mărunţirea trebuie efectuată imediat înainte de cântărire şi saponificare,
altfel ar putea avea loc pierderi de vitamina A.
5.2. Saponificarea
In funcţie de conţinutul de vitamina A, se cântăresc,
cu aproximaţie de 0,01 g, 2 până la 25 g din probă, într-un balon de 500 ml cu
fundul plat sau conic (pct. 4.2.1). Se adaugă în continuare, prin amestecare,
130 ml etanol (pct. 3.1), aproximativ 100 mg BHT (pct. 3.13), 2 ml soluţie de
ascorbat de sodiu (pct. 3.5) şi 2 ml soluţie de sulfit de sodiu (pct. 3.6). Se
potriveşte un condensator (pct. 4.3) la balon şi se scufundă balonul într-o
baie de apă cu agitator magnetic (pct. 4.7). Se încălzeşte până la fierbere şi
se lasă la reflux timp de 5 minute. Se adaugă apoi 25 ml soluţie de hidroxid de
potasiu (pct. 3.4) prin condensator (pct. 4.3) şi se lasă la reflux timp de 25
de minute, agitându-se sub un flux uşor de azot. Apoi se clăteşte condensatorul
cu aproximativ 20 ml apă şi se răceşte conţinutul balonului la temperatura
camerei.
5.3. Extracţie
Se transferă prin decantare întreaga soluţie
saponificată, prin clătire cu un volum total de 250 ml apă într-o pâlnie de
separare de 1.000 ml (pct. 4.2.3) sau în aparatul de extracţie (pct. 4.8). Se
clăteşte balonul de saponificare în continuare cu 25 ml etanol (pct. 3.1) şi
100 ml eter de petrol (pct. 3.2) şi se transferă soluţiile de clătire în pâlnia
de separare sau în aparatul de extracţie. Proporţia de apă şi etanol în
soluţiile combinate ar trebui să fie de 2:1. Se agită viguros timp de două
minute şi se lasă să se sedimenteze timp de două minute.
5.3.1. Extracţie folosind un tub de separare (pct.
4.2.3) Când straturile de lichid s-au separat (a se vedea observaţia de la pct.
7.3), se transferă stratul de eter de petrol într-o altă pâlnie de separare
(pct. 4.2.3). Se repetă această extracţie de două ori, cu 100 ml eter de petrol
(pct. 3.2) şi de două ori cu 50 ml eter de petrol (pct. 3.2). Se spală extractele
combinate în pâlnia de separare, de două ori, prin amestecare uşoară - pentru a
se evita formarea emulsiilor - cu cantităţi de 100 ml apă şi după agitare
repetată alte cantităţi de 100 ml apă, până când apa rămâne incoloră la
adăugarea soluţiei de fenoftaleină (pct. 3.7) - spălarea de patru ori este
suficientă. Se filtrează extractul spălat printr-un filtru de hârtie pentru
separare fazică (pct. 4.4), pentru a se înlătura orice
cantitate de apă în suspensie, într-un balon cotat de
500 ml (pct. 4.2.2). Se spală pâlnia de separare şi filtrul cu 50 ml eter de
petrol (pct. 3.2), se umple până la semn cu eter de petrol (pct. 3.2) şi se
amestecă bine.
5.3.2. Extracţie folosind un aparat de extracţie (pct.
4.8) Când straturile s-au separat (a se vedea observaţia de la pct. 7.3), se
înlocuieşte dopul cilindrului de sticlă (pct. 4.8.1) prin inserţie din sticlă
mată (pct. 4.8.2) şi se aranjează capătul de mai jos în formă de U al tubului
ajustabil, astfel încât să se afle deasupra nivelului interfeţei. Prin aplicarea
unei presiuni de la generatorul de azot prin braţul exterior, se transferă
stratul superior de eter de petrol într-un tub de separare de 1.000 ml (pct.
4.2.3). Se adaugă 100 ml eter de petrol (pct. 3.2) în cilindrul de sticlă (al
aparatului), se ataşează dopul şi se agită bine. Se lasă straturile să se
separe şi se transferă stratul de deasupra în tubul de separare, la fel ca
înainte. Se repetă procedura extracţiei cu încă 100 ml eter de petrol (pct.
3.2), apoi de două ori cu cantităţi de 50 ml eter de petrol (pct. 3.2) şi se
adaugă straturile de eter de petrol în tubul de separare. Se spală extractele
combinate din eter de petrol, după cum este descris la pct. 5.3.1, şi se
procedează după cum este descris la acel punct.
5.4. Prepararea soluţiei probă pentru HPLC
Se pipetează o cantitate alicotă din soluţia de eter de
petrol (de la pct. 5.3.1 la pct. 5.3.2) într-un balon în formă de pară de 250
ml (pct. 4.2.4). Se evaporă solventul până aproape de sec, la evaporatorul
rotativ (pct. 4.1), cu presiune redusă, la o temperatură a băii de apă ce nu
depăşeşte 40°C. Se restabileşte presiunea atmosferică prin admisie de nitrogen
(pct. 3.10) şi se îndepărtează balonul de pe evaporatorul rotativ. Se înlătură
solventul rămas în curent de azot (pct. 3.10) şi se dizolvă imediat reziduul cu
un volum cunoscut (10 - 100 ml) de metanol (pct. 3.3) (concentraţia de vitamina
A trebuie să fie între 5 Ul/ml si 30 Ul/ml).
5.5. Efectuarea determinării prin HPLC
Vitamina A este separată pe o
coloană C18 cu fază
inversă (pct. 4.5.1), iar concentraţia este măsurată printr-un detector de UV
(325 nm) sau un detector de fluorescentă (excitaţie: 325 nm, emisie: 475 nm)
(pct. 4.5.2). Se injectează o cantitate alicotă (de exemplu 20 µl) de soluţie metanolică obţinută
conform pct. 5.4 şi se eluează cu faza mobilă (pct. 3.9). Se calculează media
peak-urilor înălţimii mai multor injecţii din aceeaşi soluţie de probă şi media
peak-urilor înălţimii mai multor injecţii ale soluţiilor de calibrare (pct. 5.6.2).
Condiţii de separare HPLC
Sunt oferite următoarele condiţii pentru instruire; pot
fi folosite alte condiţii, cu obligaţia ca acestea să ofere rezultate
echivalente.
Coloana de lichid cromatografie (pct. 4.5.1): 250 mm x 4
mm, C18 de 5 sau 10 µm ori echivalent
Faza mobilă (pct. 3.9): amestec de metanol (pct. 3.3)
şi apă, de exemplu 980 + 20 (v + v)
Rata de curgere: 1-2 ml/min.
Detector (pct. 4.5.2): detector cu UV (325 nm) sau
detector cu fluorescentă (excitaţie: 325 nm/emisie: 475 nm)
5.6. Calibrare
5.6.1. Prepararea soluţiilor standard de lucru Se
pipetează 20 ml soluţie stoc de acetat vitamina A (pct. 3.11) sau 20 ml soluţie
stoc de palmitat vitamina A (pct. 3.12.1) într-un balon cu fund plat sau conic
(pct. 4.2.1) şi se hidrolizează după cum este descris la pct. 5.2, dar fără a
se adăuga BHT. Se aplică apoi extracţia cu eter de petrol (pct. 3.2) în
conformitate cu pct. 5.3 şi se completează până la 500 ml cu eter de petrol (pct. 3.2). Se evaporă 100 ml din
acest extract pe evaporatorul rotativ (a se vedea pct. 5.4) până aproape de
sec, se înlătură solventul rămas cu un curent de azot (pct. 3.10) şi se
redizolvă reziduul în 10,0 ml metanol (pct. 3.3). Concentraţia nominală a
acestei soluţii este 560 UI vitamina A/ml. Conţinutul exact trebuie determinat
în conformitate cu pct. 5.6.3.3. Soluţia standard de lucru trebuie preparată
proaspătă, înainte de folosire. Se pipetează 2,0 ml din această soluţie
standard de lucru, într-un balon cotat de 20 ml, se completează cu metanol până
la semn (pct. 3.3) şi se amestecă. Concentraţia nominală a acestei soluţii
standard de lucru diluate este de 56 UI de vitamina A/ml.
5.6.2. Prepararea soluţiilor de calibrare şi a
graficului de calibrare: se transferă 1,0; 2,0; 5,0 şi 10,0 ml din soluţia
standard de lucru, diluată într-o serie de baloane cotate de 20 ml, se
completează până la semn cu metanol (pct. 3.3) şi se amestecă. Concentraţiile
nominale ale acestor soluţii sunt 2,8; 5,6; 14,0 şi 28,6 UI de vitamina A/ml.
Se injectează 20 µl din
fiecare soluţie de calibrare de mai multe ori şi se determină media înălţimilor
peack-urilor. Folosindu-se media înălţimilor peack-urilor, se întocmeşte o
curbă de calibrare, luându-se în considerare rezultatele obţinute în UV
(pct. 5.6.3.3).
5.6.3. Standardizarea UV a soluţiilor standard
5.6.3.1. Soluţie stoc acetat de vitamina A
Se pipetează 2,0 ml din soluţia stoc acetat de vitamina
A (pct. 3.11.1) într-un balon cotat de 50 ml (pct. 4.2.2) şi se completează
până la semn cu 2-propanol (pct. 3.8). Concentraţia nominală a acestei soluţii
este de 56 UI vitamina A/ml. Se pipetează 3,0 ml din această soluţie de acetat
de vitamina A într-un balon cotat de 25 ml şi se completează până la semn cu
2-propanol (pct. 3.8). Concentraţia nominală a acestei soluţii este de 6,72 UI
vitamina A/ml. Se măsoară spectrul UV al acestei soluţii faţă de 2-propanol
(pct. 3.8) cu un spectrofotometru (pct. 4.6), la o lungime de undă între 300 nm
şi 400 nm. Extincţia maximă trebuie să fie între 325 nm şi 327 nm.
Calcularea conţinutului de vitamina A:
UI vitamina A/ml = E326 x 19,0
(E1cm1% pentru vitamina A acetat =
1.530 la 326 nm în 2-propanol)
5.6.3.2. Palmitatul de vitamina A soluţia stoc
Se pipetează 2,0 ml de vitamina A palmitat din soluţia
stoc (pct. 3.12.1) într-un balon cotat de 50 ml (4.2.2) si se completează până
la semn cu 2-propanol (pct. 3.8). Concentraţia nominală a acestei soluţii este
de 56 UI vitamina A/ml. Se pipetează 3,0 ml din această soluţie diluată de
vitamina A palmitat într-un balon cotat de 25 ml şi se completează până la semn
cu 2-propanol (pct. 3.8). Concentraţia nominală a acestei soluţii este de 6,72
UI vitamina A/ml. Se măsoară spectrul UV al acestei soluţii faţă 2-propanolului
(pct. 3.8) cu spectrofotometrul (pct. 4.6) fixat la o lungime de undă între 300 nm si 400 nm.
Extincţia maximă trebuie să fie între 325 nm si 327 nm.
Calcularea conţinutului de vitamina A:
UI vitamina A/ml = E326 x 19,0
(E1cm1% pentru vitamina A palmitat
= 1.530 la 326 nm în 2-propanol)
5.6.3.3. Vitamina A = Soluţie standard de lucru. Se
pipetează 3,0 ml din soluţia standard de vitamina A nediluată, preparată în
conformitate cu pct. 5.6.1, într-un balon cotat de 50 ml (pct. 4.2.2) şi se
completează până la semn cu 2-propanol (pct. 3.8). Se pipetează 5 ml din
această soluţie într-un balon cotat de 25 ml şi se aduce la semn cu 2-propanol (pct. 3.8). Concentraţia
nominală a acestei soluţii este de 6,72 UI de vitamina A/ml. Se măsoară
spectrul acestei soluţii faţă de 2-propanol (pct. 3.8) cu spectrofotometrul
(pct. 4.6) la lungime de undă între 300 nm şi 400 nm. Extincţia maximă trebuie
să fie între 325 nm şi 327 nm.
Calcularea conţinutului în vitamina A:
UI vitamina A/ml = E325 x 18,3 (E1cm1%
pentru retinol = 1.821 la 325 nm în 2-propanol)
6. Calcularea rezultatelor
Pornindu-se de la înălţimea medie a peak-urilor de
vitamina A a soluţiei de probă, se determină concentraţia soluţiei de probă în
Ul/ml, prin referire faţă de curba de calibrare (pct. 5.6.2).
Conţinutul w de vitamina A în Ul/kg al probei este dat
de următoarea formulă:
w = 500 x β x V2 x 1.000 [Ul/kg],
V1 x m
in care:
β = concentraţia de vitamina
A din soluţia de probă (pct. 5.4) la Ul/ml;
V1 = volumul
soluţiei de probă (pct. 5.4), în ml;
V2 = volumul
cantităţii alicote luate conform pct. 5.4, în ml;
m = masa de probă luată în lucru, în g.
7. Observaţii
7.1. Pentru probe cu concentraţie redusă de vitamina A
poate fi util să se combine extractele de eter de petrol din două încărcături
de saponificare (cantitate cântărită = 25 g) într-o soluţie de probă pentru
determinare HPLC.
7.2. Cantitatea probei
utilizate pentru analiză nu ar trebui să conţină mai mult de 2 g grăsime.
7.3. Dacă separarea fazică nu are loc, adăugaţi
aproximativ 10 ml etanol (pct. 3.1) pentru a întrerupe emulsia.
7.4. Pentru ulei din ficat de cod şi alte grăsimi
pure timpul de saponificare trebuie să fie extins la 45-60 de minute.
7.5. Poate fi folosită hidrochinonă în loc de BHT.
7.6. Folosindu-se o coloană fazică normală, este
posibilă separarea de izomeri de retinol.
7.7. Se pot folosi aproximativ 150 mg de acid ascorbic în loc de soluţie de ascorbat de sodiu.
7.8. Se pot folosi aproximativ 50 mg EDTA în loc de
soluţia de sulfit de sodiu.
8. Repetabilitate
Diferenţa dintre rezultatele a două determinări
paralele, efectuate pe aceeaşi probă, nu trebuie să depăşească 15%, valoare
relativă faţă de cel mai mare rezultat.
9. Rezultate ale unui studiu de colaborare*)
|
|
Premix
|
Furaj
cu premix
|
Concentrat mineral
|
Furaj proteic
|
Purcel
|
|
L
|
13
|
12
|
13
|
12
|
13
|
|
n
|
48
|
45
|
47
|
46
|
49
|
|
medie
[Ul/kg]
|
17,02 x 106
|
1,21 x 106
|
537.100
|
151.800
|
18.070
|
|
Sr
[Ul/kg]
|
0,51 x 106
|
0,039 x 106
|
22.080
|
12.280
|
682
|
|
r
[Ul/kg]
|
1,43 x 106
|
0,109 x 106
|
61.824
|
34.384
|
1.910
|
|
CVr [%]
|
3,0
|
3,5
|
4,1
|
8,1
|
3,8
|
|
SR
[Ul/kg]
|
1,36 x 106
|
0,069 x 106
|
46.300
|
23.060
|
3.614
|
|
R
[Ul/kg]
|
3,81 x 106
|
0,193 x 106
|
129.640
|
64.568
|
10.119
|
|
CVR [%]
|
8,0
|
6,2
|
8,6
|
15
|
20
|
L: număr de laboratoare
n: număr de valori singulare
Sr:
deviaţia standard a repetabilităţii
SR: deviaţia
standard a reproductibilităţii
r: repetabilitate
R: reproductibilitate
CVr: coeficient
de variaţie al repetabilităţii
CVR: coeficient de
variaţie al reproductibilităţii
*) = Realizat de grupul de lucru pentru furaje din
Verband Deutscher Landwirtschaftlicher Untersuchungs-und Forschungsanstalten
(VDLUFA)
Fig. 1. Aparatul de extracţie (4.8)
PARTEA B: Determinarea vitaminei E (tocoferol)
1. Scop şi domeniu
Această metodă se foloseşte pentru determinarea
vitaminei E din furaje şi premixuri. Conţinutul de vitamina E este exprimat ca
mg de DL acetat de tocoferol/kg. Astfel, 1 mg DL acetat de tocoferol corespunde la 0,91 mg DL tocoferol (vitamina E).
Limita de determinare este de 2 mg vitamina E/kg.
2. Principiu
Proba este hidrolizată cu soluţie de hidroxid de
potasiu etanolic, iar vitamina E este extrasă în eter de petrol. Solventul este
înlăturat prin evaporare, iar reziduul este dizolvat în metanol şi, dacă este
necesar, diluat până la concentraţia necesară. Conţinutul de vitamina E este
determinat prin lichid cromatografie de înaltă performanţă cu fază inversată
(RP-HPLC), folosindu-se un detector cu fluorescentă sau UV.
3. Reactivi
3.1. Etanol, c = 96%
3.2. Eter de petrol, fracţia 40°C - 60°C
3.3. Metanol
3.4. Soluţie de hidroxid de potasiu, β = 50 g/100 ml
3.5. Soluţie de ascorbat de sodiu, β = 10 g/100 ml (a se vedea observaţiile
de la pct. 7.7)
3.6. Sulfit de sodiu, Na2S x H20
(x = 7-9)
3.6.1. Soluţie de sulfit de sodiu, c = 0,5 mol/l în
glicerol, β = 120 g/l
(pentru x = 9) (a se vedea observaţiile de la pct. 7.8)
3.7. Soluţie de fenolftaleină, β = 2 g/100 ml în etanol (pct. 3.1)
3.8. Faza mobilă pentru HPLC:
amestec de metanol (pct. 3.3) şi apă, de exemplu: 980 + 20 (v + v). Raportul
exact trebuie să fie determinat prin intermediul caracteristicilor coloanei
folosite.
3.9. Azot liber de oxigen
3.10. DL-α-tocoferol acetat, extrapur, cu activitate
certificată
3.10.1. Soluţie stoc din DL-α-acetat de tocoferol: se cântăresc, cu aproximaţie de 0,1 mg, 100
mg DL-α-acetat de tocoferol
(pct. 3.10) într-un balon cotat de 100 ml. Se dizolvă în etanol (pct. 3.1) şi se
completează până la semn cu acelaşi solvent. Astfel, 1 ml din această soluţie
conţine 1 mg DL-α-acetat de
tocoferol (pentru control UV, a se vedea pct. 5.6.2.3; pentru stabilizare, a se
vedea observaţiile de la pct. 7.4)
3.11. DL-α-tocoferol, extrapur, cu activitate certificată 3.11.1. Se cântăresc, cu aproximaţie de 0,1 mg,100 mg de
DL-α-tocoferol (pct. 3.10)
într-un balon gradat de 100 ml. Se dizolvă în etanol (pct. 3.1) şi se
completează până la semn cu acelaşi solvent. Astfel, 1 ml din această soluţie
conţine 1 mg DL-α-tocoferol (pentru control UV, a se vedea pct. 5.6.2.3; pentru
stabilizare, a se vedea observaţiile de la pct. 7.4).
3.12. 2,6 di-terţ-butil-metilfenol (BHT) (a se vedea
observaţiile de la pct. 7.5).
4. Aparatură:
4.1. Evaporator rotativ cu vacuum
4.2. Sticlărie brună
4.2.1. Baloane cu fund plat sau conice de 500 ml, cu
slif
4.2.2. Baloane cotate, cu dopuri rodate, cu gât
strâmt, cu capacitate de 10, 25, 100 şi 500 ml
4.2.3. Pâlnii de separare conice, de 1.000 ml, cu dopuri
de sticlă
4.2.4. Baloane piriforme din
sticlă de 250 ml cu gât rodat
4.3. Condensator Allihn, de 300 mm, cu legătură din
sticlă, cu adaptator pentru o pipă de aprovizionare cu gaz
4.4. Hârtie de filtru pentru separare fazică, cu
diametrul de 185 mm (de exemplu Schleicher &
Schuell 597 HY 1/2 sau similar).
4.5. Echipament HPLC cu sistem de injecţie
4.5.1. Coloana de lichid cromatografie, 250 mm x 4 mm,
C18, de 5 ori 10 µm sau echivalent
4.5.2. Detector UV sau de fluorescentă, cu ajustare
variabilă a lungimii de undă
4.6. Spectrofotometru cu cuve
de cuarţ de 10 mm
4.7. Baie de apă cu agitator magnetic
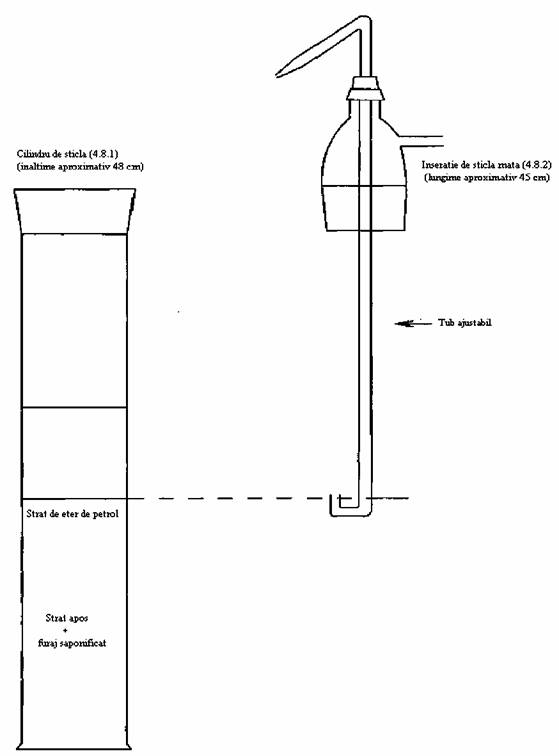
4.8. Aparat de extracţie constând în:
4.8.1. Cilindru de sticlă, de capacitate de 1 I, căruia i se pun un gât şi dop de sticlă
4.8.2. Mufă din sticlă mată, echipată cu un braţ
exterior şi cu un tub ajustabil ce trece prin centru. Tubul ajustabil trebuie
să aibă un capăt în formă de U situat în partea de jos şi un capăt efilat la
partea opusă, astfel încât stratul superior de lichid din cilindru să poată fi
transferat într-o pâlnie de separare.
5. Procedură
NOTĂ: Vitamina E este sensibilă la lumină (UV) şi
oxidare. Toate operaţiunile trebuie efectuate în absenţa luminii (folosindu-se
sticlărie brună sau sticlărie protejată cu folie de aluminiu) şi a oxigenului
(a se spăla cu azot). In timpul extracţiei, aerul de deasupra lichidului
trebuie înlocuit de azot (a se evita presiunea prin lărgirea dopului din când
în când).
5.1. Pregătirea probei: se mărunţeşte proba astfel
încât să treacă printr-o sită cu ochiuri de 1 mm, avându-se grijă să se evite
generarea de căldură. Mărunţirea trebuie efectuată imediat înainte de cântărire
şi saponificare, altfel pot avea loc pierderi de vitamina E.
5.2. Saponificare: în funcţie de conţinutul de
vitamina E, se cântăresc, cu aproximaţie de 0,01 g, 2 până la 25 g din probă
într-un balon de 500 ml cu fundul plat sau conic (pct. 4.2.1). Se adaugă în
continuare, prin amestecare, 130 ml etanol (pct. 3.1), aproximativ 100 mg BHT
(pct. 3.12), 2 ml soluţie de ascorbat de sodiu (pct. 3.5) şi 2 ml soluţie de
sulfit de sodiu (pct. 3.6). Se potriveşte un condensator (pct. 4.3) la balon şi
se scufundă balonul într-o baie de apă cu agitator mecanic (pct. 4.7). Se
încălzesc până la fierbere şi se lasă la reflux timp de 5 minute. Se adaugă
apoi 25 ml soluţie de hidroxid de potasiu (pct. 3.4) prin condensator (pct.
4.3) şi se lasă la reflux timp de 25 de minute, agitându-se sub un flux uşor de
azot. Apoi se clăteşte condensatorul cu aproximativ 20 ml apă şi se răceşte
conţinutul balonului la temperatura camerei.
5.3. Extracţie: se transferă, prin decantare,
întreaga soluţie de saponificare, prin clătire cu un volum total de 250 ml apă,
într-o pâlnie de separare de 1.000 ml, (pct.4.2.3) sau în aparatul de extracţie
(pct. 4.8). Se clăteşte balonul de saponificare, în continuare, cu 25 ml etanol
(pct. 3.1) şi 100 ml eter de petrol (pct. 3.2) şi se transferă soluţiile de
clătire în tubul de separare sau în aparatul de extracţie. Proporţia de apă şi
etanol în soluţiile combinate trebuie să fie 2:1. Se scutură viguros timp de
două minute şi se lasă să se sedimenteze timp de două minute.
5.3.1. Extracţie folosind o pâlnie de separare (pct.
4.2.3); când straturile de lichid s-au separat (a se vedea pct. 7.3), se
transferă stratul de eter de petrol într-o altă pâlnie de separare (pct.
4.2.3). Se repetă această extracţie de două ori cu 100 ml eter de petrol (pct.
3.2) şi de două ori cu 50 ml eter de petrol (pct. 3.2). Se spală extractele combinate din pâlnia de
separare de două ori, prin amestecare uşoară (pentru a se evita formarea
emulsiilor), cu cantităţi de 100 ml apă şi după agitare repetată alte cantităţi
de 100 ml apă, până când apa rămâne incoloră la adăugarea soluţiei de
fenolftaleină (pct. 3.7) (spălarea de 4 ori este de obicei suficientă). Se
filtrează extractul spălat printr-un filtru împăturit, pentru separare fazică
(pct. 4.4), pentru a se înlătura orice cantitate de apă în suspensie, într-un
balon cotat de 500 ml (pct. 4.2.2). Se spală pâlnia de separare şi filtrul cu
50 ml eter de petrol (pct. 3.2), se umple până la semn cu eter de petrol (pct.
3.2) şi se amestecă bine.
5.3.2. Extracţie folosind un aparat de extracţie (pct.
4.8); când straturile s-au separat (a se vedea observaţia de la pct. 7.3) se
înlocuieşte dopul cilindrului de sticlă (pct. 4.8.1) cu inserţie din sticlă
mată (pct. 4.8.2) şi se aranjează capătul de jos în formă de U al tubului
ajustabil, astfel încât să se afle deasupra nivelului interfeţei. Prin
aplicarea unei presiuni de la generatorul nitrogenului, prin braţul exterior,
se transferă stratul superior de eter de petrol într-un tub de separare de
1.000 ml (pct. 4.2.3). Se adaugă 100 ml eter de petrol (pct. 3.2) în cilindrul
de sticlă, se ataşează dopul şi se agită bine. Se lasă straturile să se separe
şi se transferă stratul de deasupra în tubul de separare ca şi mai înainte. Se
repetă procedura extracţiei cu încă 100 ml eter de petrol (pct. 3.2), apoi de
două ori cu cantităţi de 50 ml eter de petrol (pct. 3.2) şi se adaugă
straturile de eter de petrol în tubul de separare. Se spală extractele
combinate din eter de petrol, după cum este descris la pct. 5.3.1, şi se
procedează după cum este descris acolo.
5.4. Prepararea soluţiei probă pentru HPLC: se
pipetează o cantitate alicotă din soluţia de eter de petrol (de la pct. 5.3.1
la pct. 5.3.2) într-un balon în formă de pară, de 250 ml (pct. 4.2.4). Se
evaporă solventul aproape de uscare pe evaporatorul rotativ (pct. 4.1) cu
presiune redusă, la o temperatură a băii ce nu depăşeşte 40°C. Se readuce la
presiunea atmosferică prin admisie de azot (pct. 3.9) şi se îndepărtează
balonul de pe evaporatorul rotativ. Se înlătură solventul rămas printr-un
curent de azot (pct. 3.9) şi se dizolvă imediat reziduul cu un volum cunoscut
(10-100 ml) de metanol (pct. 3.3) (concentraţia de L-a-tocoferol trebuie să fie
între 5 µg/ml şi 30 µg/ml).
5.5. Determinare prin HPLC: vitamina E este separată
pe o coloană cu fază inversată de C18 (pct. 4.5.1), iar concentraţia este măsurată printr-un detector de
fluorescentă (excitaţie: 295 nm, emisie: 330 nm) sau un detector de UV (292 nm)
(pct. 4.5.2). Se injectează o fracţie alicotă (de exemplu: 20 µl) de soluţie metanolică obţinută
conform pct. 5.4 şi se realizează o eluţie cu faza mobilă (pct. 3.8). Se
calculează media înălţimii peak-ului mai multor injecţii din aceeaşi soluţie de
probă şi mediile înălţimii peak-ului ale mai multor injecţii ale soluţiilor de
calibrare (pct. 5.6.2).
Condiţii HPLC: Sunt oferite următoarele condiţii pentru
orientare; pot fi folosite alte situaţii, cu condiţia ca acestea să ofere
rezultate echivalente.
Coloană de lichid cromatografic (pct. 4.5.1): 250 mm x
4 mm, C18, ambalaje
de 5 µm sau 10 µm sau echivalent
Faza mobilă (pct. 3.8): amestec de metanol (pct. 3.3)
şi apă, de exemplu: 980 + 20 (v + v)
Debit: 1-2 ml/min
Detector (pct. 4.5.2): detector
cu fluorescentă(excitaţie: 295 nm, emisie: 330 nm) sau detector de UV (292 nm)
5.6. Calibrare (DL acetat de tocoferol sau DL-α-tocoferol) 5.6.1. DL acetat de
tocoferol standard de referinţă
5.6.1.1. Prepararea soluţiei standard de lucru
Se transferă cu o pipetă 25 ml
soluţie de DL acetat de tocoferol (pct. 3.10.1) într-un balon de 500 ml cu fund
plat sau conic (pct. 4.2.1) şi se hidrolizează după cum este descris la pct.
5.2. Apoi se extrage cu eter de petrol (pct. 3.2), în concordanţă cu pct. 5.3,
şi se completează până la 500 ml cu eter de petrol (pct. 3.2). Se evaporă 25 ml
din acest extract pe evaporatorul rotativ (a se vedea pct. 5.4) până aproape de
uscare, se înlătură solventul rămas cu un curent de azot (pct. 3.9) şi se
redizolvă reziduurile în 25,0 ml metanol (pct. 3.3). Concentraţia nominală a
acestei soluţii este 45,5 µg DL-α-tocoferol/ml, echivalent cu 50 µg DL-α-tocoferol acetat/ml. Soluţia standard de lucru trebuie preparată
proaspătă, înainte de folosire.
5.6.1.2. Prepararea soluţiilor de calibrare sau a
curbei de calibrare: se transferă 1,0, 2,0, 4,0 şi 10,0 ml din soluţia standard
de lucru într-o serie de baloane gradate de 20 ml, se completează până la semn
cu metanol (pct. 3.3) şi se amestecă. Concentraţiile nominale ale acestor
soluţii sunt: 2,5; 5,0; 10,0 şi 25,0 µg/ml DL-α-tocoferol acetat, de exemplu: 2,28,
4.55, 9,10 µg/ml şi 22,8 µg/ml
DL-α-tocoferol. Se
injectează 20 µl din fiecare
soluţie de calibrare, de mai multe ori, şi se determină media înălţimii
peak-ului. Folosindu-se media înălţimilor peak-ului, se întocmeşte un grafic de
calibrare.
5.6.1.3. Standardizarea UV a soluţiei de tocoferol
acetat (pct. 3.10.1)
Se dizolvă 5,0 ml soluţie de tocoferol acetat (pct.
3.10.1) până la 25,0 ml cu etanol şi se măsoară spectrul UV al soluţiei faţă de
etanol (pct. 3.1) cu un spectrofotometru (pct. 4.6) la o lungime de undă între
250 nm şi 320 nm.
Absorbţia maximă trebuie să fie la 284 nm:
E1cm1% = 43,6 la 284 nm în etanol
La această dilutie trebuie obţinută o valoare de
extincţie de 0,84 - 0,88.
5.6.2. DL-α-tocoferol standard de referinţă
5.6.2.1. Prepararea soluţiei standard de lucru
Se transferă cu pipeta 2,0 ml soluţie de tocoferol
acetat (pct. 3.11.1) într-un balon cotat de 50 ml, se dizolvă în metanol (pct.
3.3) şi se completează până la semn cu metanol. Concentraţia nominală a acestei
soluţii este de 40 µg DL-α-tocoferol/ml, echivalent cu 44,0 µg de
tocoferol acetat/ml. Soluţia standard de lucru trebuie preparată proaspătă
înainte de folosire.
5.6.2.2. Prepararea soluţiilor de calibrare şi a
graficului de calibrare
Se transferă 1,0; 2,0; 4,0 şi 10,0 ml din soluţia
standard de lucru diluată într-o serie de baloane cotate de 20 ml, se
completează până la semn cu metanol (pct. 3.3) şi se amestecă. Concentraţiile
nominale ale acestor soluţii sunt: 2,0; 4,0; 8,0 şi 20,0 µg/ml şi 22,0 µg/rnl tocoferol acetat. Se injectează 20 µl
din fiecare soluţie de calibrare de mai multe ori şi
se determină mediile înălţimii peak-ului. Folosindu-se mediile înălţimii
peak-ului, se întocmeşte un grafic de calibrare.
5.6.2.3. Standardizarea UV a soluţiei DL-α-tocoferol (pct. 3.11.1)
Se dizolvă 2,0 ml până la 25,0 ml din soluţia stoc de
tocoferol (pct. 3.11.1) cu etanol (pct. 3.1) şi se măsoară spectrul UV al acestei
soluţii faţă de etanol cu spectrofotometru (pct. 4.6) la lungime de undă între
250 nm şi 320 nm.
Absorbţia maximă trebuie să fie la 292 nm:
E1cm1% =
75,8 la 292 nm în etanol. La această dilutie trebuie obţinută o valoare de
extincţie de 0,6.
6. Calcularea rezultatelor
Pornindu-se de la media
înălţimii peak-ului pentru vitamina E a soluţiei de probă, se determină
concentraţia soluţiei de probă în µg/ml (calculată ca α-tocoferol acetat) faţă de curba de calibrare (pct. 5.6.1.2 sau
5.6.2.2).
Conţinutul w de vitamina E în mg/kg de probă este dat
de următoarea formulă:
w = 500 x β x V2 [mg/kg]/V1 x m,
în care:
β = concentraţia de vitamina
E din soluţia de probă (pct. 5.4) în Ul/ml;
V1 = volumul
soluţiei de probă (pct. 5.4), în µg/ml;
V2 = volumul
cantităţii alicote folosite la pct. 5.4, în ml;
m = masa porţiunii de testat, în g.
7. Observaţii
7.1. Pentru probe cu concentraţie redusă de vitamina
E poate fi util să se combine extractele de eter de petrol din două încărcături
de saponificare (cantitate cântărită: 25 g) într-o soluţie de probă, pentru determinare HPLC.
7.2. Masa probei utilizate pentru analiză nu ar trebui
să conţină mai mult de 2 g grăsime.
7.3. Dacă separarea fazică nu are loc, se adaugă
aproximativ 10 ml I etanol (pct. 3.1), pentru a întrerupe
emulsia.
7.4. După măsurarea cu spectrofotometrul a soluţiei
de tocoferol acetat sau DL-α-tocoferol,
în conformitate cu pct. 5.6.1.3 sau 5.6.2.3, se adaugă aproximativ 10 mg BHT
(pct. 3.12) la soluţie (3.10.1 sau 3.10.2) şi se păstrează soluţia la frigider
(perioadă de păstrare de maximum 4 săptămâni).
7.5. Poate fi folosită hidrochinona în loc de BHT.
7.6. Folosindu-se o coloană fazică normală, este
posibilă separarea unui a-, β-, Y şi d-tocoferol.
7.7. Se pot folosi aproximativ 150 mg acid ascorbic
în loc de soluţie de ascorbat de sodiu.
7.8. Se pot folosi aproximativ 50 mg EDTA în loc de
soluţie de sulfit de sodiu.
8. Repetabilitate
Diferenţa dintre rezultatele a două determinări
paralele, efectuate pe aceeaşi probă, nu trebuie să depăşească 15%, valoare
relativă faţă de cel mai mare rezultat.
9. Rezultatele unui studiu de colaborare*)
|
|
Premix
|
Furaj
cu premix
|
Concentrat mineral
|
Furaj proteic
|
Purcel
|
|
L
|
12
|
12
|
12
|
12
|
12
|
|
n
|
48
|
48
|
48
|
48
|
48
|
|
medie
[Ul/kg]
|
17380
|
1187
|
926
|
315
|
61,3
|
|
Sr
[Ul/kg]
|
384
|
45,3
|
25,2
|
13,0
|
2,3
|
|
r
[Ul/kg]
|
1075
|
126,8
|
70,6
|
36,4
|
6,4
|
|
CVr [%]
|
2,2
|
3,8
|
2,7
|
4,1
|
3,8
|
|
SR
[Ul/kg]
|
830
|
65,0
|
55,5
|
18,9
|
7,8
|
|
R
[Ul/kg]
|
2324
|
182,0
|
155,4
|
52,9
|
21,8
|
|
CVR[%]
|
4,8
|
5,5
|
6,0
|
6,0
|
12,7
|
L: număr de laboratoare
n: număr de valori singulare
Sr: deviaţia
standard a repetabilităţii
SR: deviaţia
standard a reproductibilităţii
r: repetabilitate
R: reproductibilitate
CVr: coeficient
de variaţie al repetabilităţii
CVR: coeficient de
variaţie al reproductibilităţii
*) Realizat de grupul de lucru pentru furaje din
Verband Deutscher Landwirtschaftlicher Untersuchungs- und Forschungsanstalten
(VDLUFA).
Fig. 1 .Aparatul de extracţie (4.8)
PARTEA C: Determinarea triptofanului
1. Scop şi domeniu
Această metodă se foloseşte pentru determinarea
cantităţii totale şi libere de triptofan din furaje. Nu se face distincţie
între formele D şi L.
2. Principiu
Pentru determinarea triptofanului total, proba este
hidrolizată în condiţii alcaline cu soluţie saturată de hidroxid de bariu şi
încălzită la 110°C, pentru 20 de ore. După hidroliză se adaugă standardul
intern. Pentru determinarea triptofanului liber proba este extrasă în condiţii
de aciditate uşoară, în prezenţa standardului intern. Triptofanul şi standardul
intern din hidrolizat sau din extract sunt determinate prin HPLC cu detector cu
fluorescentă.
3. Reactivi
3.1. Trebuie folosită apă bidistilată sau apă de
calitate echivalentă (conductivitate < 10 µS/cm)
3.2. Substanţa standard: triptofan (puritate/conţinut
> 99%), uscată sub vacuum pe pentoxid de fosfor
3.3. Substanţă standard intern: a-metil-triptofan
(puritate/conţinut > 99%), uscată sub vacuum pe pentoxid de fosfor
3.4. Hidroxid de bariu octahidrat [trebuie avut grijă
pentru a nu se expune Ba(OH)2 x 8H20 excesiv la aer, pentru a se evita formarea de
BaCO3 ce ar putea afecta determinarea] (a
se vedea observaţia de la pct. 9.3)
3.5. Hidroxid de sodiu
3.6. Acid ortofosforic, w = 85%
3.7. Acid clorhidric, 20 = 1,19 g/ml
3.8. Metanol, grade HPLC
3.9. Eter de petrol, domeniu de fierbere 40-60°C
3.10. Soluţie de hidroxid de sodiu, c = 1 mol/l
Se dizolvă 40,0 g NaOH (pct. 3.5) în apă şi se
completează cu apă până la 1 l (pct. 3.1)
3.11. Acid clorhidric, c = 6 mol/l. Se iau 492 ml HCL
(pct. 3.7) şi se completează cu apă până la 1 l.
3.12. Acid clorhidric, c = 1
mol/l. Se iau 82 ml HCL (pct. 3.7) şi se completează cu apă până la 1 l.
3.13. Acid clorhidric, c = 0,1 mol/l. Se iau 8,2 ml
HCL (pct. 3.7) şi se completează cu apă până la 1 l.
3.14. Acid ortofosforic, c = 0,5 mol/l. Se iau 34 ml acid ortofosforic (pct. 3.6) si se completează cu apă până la
1 l (pct. 3.1).
3.15. Soluţie concentrată de triptofan (pct. 3.2), c
= 2,50 mol/ml: într-un balon cotat de 500 ml se dizolvă 0,2553 g triptofan
(pct. 3.2) în acid clorhidric (pct. 3.13) şi se completează până la semn cu
acid clorhidric (pct. 3.13). Se depozitează la -18°C pentru maximum 4
săptămâni.
3.16. Soluţie concentrată standard intern, c = 2,50 µmol/ml.
Intr-un balon cotat de 500 ml se dizolvă 0,2728 g
a-metil-triptofan (pct. 3.3) în acid clorhidric (pct. 3.13) şi se completează
până la semn cu acid clorhidric (pct. 3.13). Se depozitează la - 18°C pentru
maximum 4 săptămâni.
3.17. Soluţie de triptofan standard de calibrare şi
standard intern: se iau 2,00 ml soluţie concentrată de triptofan (pct. 3.15) şi
2,00 ml soluţie standard intern concentrat (a-metil-triptofan) (pct. 3.16). Se
diluează cu apă (pct. 3.1) şi metanol (pct. 3.8) cu aproximativ acelaşi volum
şi până la aproximativ aceeaşi concentraţie de metanol (10-30%) ca şi
hidrolizatul final finisat. Soluţia standard trebuie să fie proaspăt preparată
înainte de folosire.
3.18. Acid acetic
3.19. 1,1,1-tricloro-2-metil-2-propanol
3.20. Etanolamină > 98%
3.21. Soluţie de 1 g -
1,1,1-tricloro-2-metil-2-propanol (pct. 3.19) în 100 ml
metanol 1% (pct. 3.8)
3.22. Fază mobilă pentru HPLC: 3,00 g acid acetic
(pct. 3.18) + 900 ml apă (pct. 3.1) + 50,0 ml soluţie (pct. 3.21) de
1,1,1-tricloro-2-metil-2-propanol (pct. 3.19) în metanol (pct. 3.8) (1 g/100
ml). Se ajustează pH-ul la 5,00, folosindu-se etanolamină (pct. 3.20). Se
completează până la 1.000 ml cu apă (pct. 3.1).
4. Aparatură
4.1. Echipament HPLC cu un detector spectrofluorimetric
4.2. Coloană de lichid cromatografie, 125 mm x 4 mm, C18, în ambalaje de 3 µm sau echivalent
4.3. pH-metru
4.4. Balon de polipropilenă, capacitate 125 ml, cu
gât larg şi dop cu şurub
4.5. Membrană filtrantă, 0,45 µm
4.6. Autoclav sau etuvă cu vid 110(±2)°C,1,4(±0,1)
bar.
4.7. Agitator mecanic sau agitator magnetic
4.8. Agitator vortex
5. Procedură
5.1. Prepararea probelor
Proba trebuie să treacă printr-o sită de 0,5 mm.
Probele cu umiditate ridicată trebuie să fie uscate în aer, la o temperatură ce
nu depăşeşte 50°C, sau uscate cu gheaţă, înainte de mărunţire. Probele cu
conţinut ridicat de grăsimi trebuie extrase cu eter de petrol (pct. 3.9)
înainte de mărunţire.
5.2. Determinarea triptofanului liber (extract)
Se cântăreşte, cu aproximaţie de 1 mg, o cantitate de
probă (1-5 g) (pct. 5.1) într-un balon conic. Se adaugă 100,0 ml acid
clorhidric, c = 0,1 mol/l (pct. 3.13) şi 5,00 ml din soluţie standard internă
concentrată (pct. 3.16). Se agită sau se amestecă timp de 60 de minute,
folosindu-se un agitator mecanic sau un agitator magnetic (pct. 4.7). Se
permite sedimentului să se depună şi se pipetează 10,0 ml din soluţia de
supernatant într-un pahar de laborator. Se adaugă 5 ml acid ortofosforic, c =
0,5 mol/l. Se ajustează pH-ul la 3,0 folosind hidroxid de sodiu, c = 1,0 mol/l.
Se adaugă suficient metanol (pct. 3.8) pentru a se realiza o concentraţie între
10 şi 30% de metanol volum final. Se transferă într-un balon cotat de volum
corespunzător şi se diluează cu apă până la un volum necesar pentru
cromatografie [aproximativ acelaşi volum ca şi soluţia de calibrare standard
(pct. 3.17)].
Se filtrează câţiva ml de soluţie printr-un filtru de
membrană de 0,45 µm (pct.
4.5), înaintea injectării pe coloana HPLC. Se trece la etapa cromatografiei, în
conformitate cu pct. 5.4. Se protejează soluţia standard şi extrasele faţă de
lumina directă a soarelui. Dacă nu este posibil să se analizeze extractele în
aceeaşi zi, acestea pot fi păstrate la 5°C pentru maximum 3 zile.
5.3. Determinarea triptofanului total (hidrolizat)
Se cântăreşte cu aproximaţie 0,2 mg, de la 0,1 la 1 g
din proba preparată (pct. 5.1), în balonul de propilenă (pct. 4.4). Cantitatea
de probă cântărită trebuie să aibă un conţinut de azot de 10 mg. Se adaugă 8,4
g de octahidrat de hidroxid de bariu (pct. 3.4) şi 10 ml de apă. Se amestecă cu
un agitator vortex (pct. 4.8) sau cu un agitator magnetic (pct. 4.7). Se lasă
magnetul acoperit cu teflon, în amestec. Se spală pereţii vasului cu 4 ml de
apă. Se pune dopul cu şurub şi se închide uşor balonul. Se transferă într-o
autoclavă (pct. 4.6) cu apă ce fierbe şi se lasă la aburi pentru 30-60 de
minute). Se închide autoclavă şi se realizează autoclavare la 110(+2)°C pentru 20 de ore. Inaintea
deschiderii autoclavei se reduce temperatura până la 100°C. Pentru a evita
cristalizarea Ba(OH)2 x 8H20, se adaugă la amestecul cald 30 ml de apă la temperatura camerei.
Se scutură sau se agită uşor. Se adaugă 2,00 ml soluţie standard intern
concentrată (de a-metil-triptofan) (pct. 3.16). Se răcesc paharele pe baie de
apă timp de 15 minute. Se adaugă apoi 5 ml de acid ortofosforic, c = 0,5 mol/l
(pct. 3.14). Se păstrează vasul la baia de răcire şi se neutralizează cu HCI, c
= 6 mol/l (pct. 3.11) în timp ce se agită şi se ajustează pH-ul la 3,0
folosindu-se HCI, c = 1 mol/l (pct. 3.12). Se adaugă suficient metanol pentru a
se realiza o concentraţie între 10 şi 30% de metanol în volumul final. Se
transferă într-un balon cotat de volum corespunzător şi se diluează cu apă până
la semn, necesar pentru cromatografie (de exemplu 100 ml). Adăugarea de metanol
nu trebuie să ducă la apariţia precipitatului.
Se filtrează câţiva ml din
soluţie printr-un filtru de membrană de 0,45 µm (pct. 4.5) înaintea injectării pe coloana HPLC, se trece la etapa
cromatografiei, în conformitate cu pct. 5.4. Se protejează soluţia standard şi
hidrolizatele faţă de lumina directă a soarelui. Dacă nu este posibil să se
analizeze hidrolizatele în aceeaşi zi, acestea pot fi depozitate la 5°C, pentru
maximum 3 zile.
5.4. Determinare prin HPLC
Sunt oferite pentru instruire următoarele condiţii de
eluţie isocratică; pot fi folosite alte situaţii, cu condiţia ca acestea să
ofere rezultate echivalente (a se vedea, de asemenea, observaţiile de la pct.
9.1 şi 9.2).
Coloana de lichid cromatografie (pct. 4.2): 125 mm x 4
mm, C18, ambalaj de 3 µm.
Temperatura coloanei: temperatura camerei.
Faza mobilă (pct. 3.22): 3,00 g
acid acetic apă (pct. 3.1) + 50,0 ml soluţie (pct. 3.21) de
1,1,1-tricloro-2-metil-2-propanol (pct. 3.19) în metanol (pct. 3.8) (1 g/100
ml).
Se ajustează pH-ul la 5,00, folosindu-se etanolamină
(pct. 3.20).
Se completează până la 1.000 ml cu apă [pct. 3.1; de
exemplu: 980+20 (v + v)].
Debitul: 1 ml/min.
Timpul total de funcţionare: aproximativ 34 minute.
Detecţia la lungimea de undă: excitaţie: 280 nm,
emisie: 356 nm.'
Volumul de injecţie: 20 µl
6. Calcularea rezultatelor
AxBxCxDxExMW= g
triptofan/ 100 g proba, unde:
FxGxHx10000xW
A = zona peak-ului pentru standardul intern, soluţie
standard de calibrare ( pct. 3.17);
B = zona peak-ului triptofanului, extract (pct. 5.2) sau
hidrolizat (pct. 3.3);
C = volumul, în ml (2 ml), al soluţiei de triptofan
concentrat (pct. 3.15) adăugat soluţiei de calibrare (pct. 3.17);
D = concentraţia, în/µmol/ml (= 2,50), din soluţia de triptofan concentrat (pct. 3.15)
adăugată soluţiei de calibrare (pct. 3.17);
E = volumul, în ml, al soluţiei concentrate standard
intern (pct. 3.16), adăugată la extract (pct. 5.2) (= 5,00 ml) sau hidrolizat
(pct. 5.3) (= 2,00 ml);
F = zona peak-ului pentru standardul intern, extract
(pct. 5.2) sau hidrolizat (pct. 5.3);
G = zona peak-ului triptofanului, soluţie standard de calibrare (pct. 3.17);
H = volumul în ml (= 2,00) al soluţiei standard intern
concentrată (pct. 3.16), adăugată la soluţia standard de calibrare (pct. 3.17);
W = greutatea probei în g (corectată la greutatea
originală, dacă este uscată şi/sau degresată);
MW = greutatea moleculară a triptofanului (= 204,23).
7. Repetabilitate
Diferenţa dintre rezultatele a două determinări
paralele, efectuate pe aceeaşi probă, nu trebuie să depăşească 10% valoare
relativă faţă de cel mai mare rezultat.
8. Rezultate ale unui studiu de colaborare
A fost realizat un studiu de colaborare la nivelul
comunitar (a patra intercomparaţie) în cadrul căruia s-au analizat 3 probe, de
către 12 laboratoare, pentru a certifica metoda pentru hidroliză. Au fost
efectuate 5 replicate din fiecare probă. Rezultatele sunt oferite de tabelul
următor:
|
|
Probai
Furaj
pentru
porcine
|
Proba 2
Furaj pentru
porcine suplimentat
cu L-triptofan
|
Proba 3
Concentrat
de furaj
pentru porcine
|
|
L
|
12
|
12
|
12
|
|
N
|
50
|
55
|
50
|
|
medie
[g/kg]
|
2,42
|
3,40
|
4,22
|
|
Sr
[g/kg]
|
0,05
|
0,05
|
0,08
|
|
r
[g/kg]
|
0,14
|
0,14
|
0,22
|
|
CVr[%]
|
1,9
|
1,6
|
1,9
|
|
SR
[g/kg]
|
0,15
|
0,20
|
0,09
|
|
R
[g/kg]
|
0,42
|
0,56
|
0,25
|
|
CVR[%]
|
6,3
|
6,0
|
2,2
|
L: număr de laboratoare
n: număr de valori singulare
Sr: deviaţia
standard a repetabilităţii
SR: deviaţia
standard a reproductibilităţii
r: repetabilitate
R: reproductibilitate
CVr: coeficient
de variaţie al repetabilităţii
CVR: coeficient de
variaţie al reproductibilităţii
A fost realizat un alt studiu de colaborare la nivelul
comunitar (a treia intercomparaţie) în cadrul căruia
s-au analizat două probe de către 13 laboratoare, pentru a se certifica metoda
de extracţie pentru triptofanul liber. Au fost efectuate analize replicate (5)
din fiecare probă. Rezultatele sunt oferite de tabelul următor:
|
|
Proba 4
Amestec de grâu
şi soia
|
Proba 5
Amestec de grâu
şi soia (= proba 4)
cu triptofan adăugat
(0,457 g/kg)
|
|
L
|
12
|
12
|
|
N
|
55
|
60
|
|
medie
[g/kg]
|
0,391
|
0,931
|
|
Sr
[g/kg]
|
0,005
|
0,012
|
|
r
[g/kg]
|
0,014
|
0,034
|
|
CVr
[%]
|
1,34
|
1,34
|
|
SR
[g/kg]
|
0,018
|
0,048
|
|
R
[g/kg]
|
0,050
|
0,134
|
|
CVR[%]
|
4,71
|
5,11
|
L: număr de laboratoare
n: număr de valori singulare
Sr: deviaţia
standard a repetabilităţii
SR: deviaţia
standard a reproductibilităţii
r: repetabilitate
R: reproductibilitate
CVr: coeficient
de variaţie al repetabilităţii
CVR: coeficient de
variaţie al reproductibilităţii
A fost realizat un alt studiu de colaborare la nivel
comunitar, în cadrul căruia s-au analizat 4 probe de către 7 laboratoare, cu
scopul unei certificări a triptofanului prin hidroliză. Rezultatele sunt
oferite mai jos. Analize replicate (5) au fost efectuate pe fiecare probă.
|
|
Proba 1 Furaj
amestecat pentru porcine
(CRM 117)
|
Proba 2
Hrană
pentru
peşte, cu
nivel
scăzut de
grăsime
(CRM 118)
|
Proba 3
Hrană
din
soia-
fasole
(CRM 119)
|
Proba 4
Pudră
de
lapte
ecremat
(CRM 120)
|
|
L
|
7
|
7
|
7
|
7
|
|
n
|
25
|
30
|
30
|
30
|
|
medie
[g/kg]
|
2,064
|
8,801
|
6,882
|
5,236
|
|
Sr
[g/kg]
|
0,021
|
0,101
|
0,089
|
0,040
|
|
r
[g/kg]
|
0,059
|
0,283
|
0,249
|
0,112
|
|
CVr[%]
|
1,04
|
1,15
|
1,30
|
0,76
|
|
SR
[g/kg]
|
0,031
|
0,413
|
0,283
|
0,221
|
|
R
[g/kg]
|
0,087
|
1,156
|
0,792
|
0,619
|
|
CVR[%]
|
1,48
|
4,69
|
4,11
|
4,22
|
L: număr de laboratoare
n: număr de valori singulare
Sr: deviaţia
standard a repetabilităţii
SR: deviaţia
standard a reproductibilităţii
r: repetabilitate
R: reproductibilitate
CVr: coeficient
de variaţie al repetabilităţii
CVR: coeficient de
variaţie al reproductibilităţii
9. Observaţii
9.1. Folosirea unor condiţii cromatografice speciale
poate crea o mai bună separare între tiptofan şi a-metil-triptofan.
Eluţie isocratică urmată de spălarea gradientului de
coloană lichid cromatografie cu: 125 mm x 4 mm, C18, ambalaje de 5 µm sau echivalent.
Temperatura coloanei: 32°C
Faza mobilă: A: 0,01 mol/KH2P04/metanol, 95 + 5 (V +
V) 1
B: Metanol
Program gradient: 0 min........ 100%
A 0% B
15 min........
100% A 0% B
17 min........
60% A 40% B
19 min........
60% A 40% B
21 min........
100% A 0% B
33 min........
100% A 0% B
Debit: 1,2 ml/min.
Timpul total de separare: aproximativ 33 de minute
9.2. Cromatografia variază în
concordanţă cu tipul de HPLC şi de materialul de împachetare a coloanei
folosit. Sistemul ales trebuie să fie capabil să ofere o separare de bază între
tiptofan şi standardul intern. Mai mult, este important ca produsele de
degradare să fie bine separate de triptofan şi de standardul intern.
Hidrolizatele fără standard intern trebuie testate pentru a se verifica linia
de bază pentru impurităţi sub standardul intern. Este important ca timpul de
achiziţie să fie suficient de lung pentru eluţia tuturor produselor de
degradare, altfel pot interfera limite cu eluţie târzie cu utilizări
cromatografice ulterioare. In domeniul funcţionării sistemul de cromatografie
trebuie să ofere răspuns linear. Răspunsul linear trebuie măsurat cu o
concentraţie constantă (normală) a standardului intern şi a concentraţiilor
variate de triptofan. Este important şi faptul că mărimea atât a peak-urilor
triptofanului, cât şi a peak-urilor standardelor interne este cuprinsă în
domeniul linear al sistemului HPLC/fluorescenţă. Dacă peak-ul triptofanului
şi/sau al standardului intern este prea mic sau ridicat, analiza trebuie
repetată cu o altă cantitate de probă şi/sau cu un volum final schimbat.
9.3. Hidroxid de bariu
Cu timpul hidroxidul de bariu devine mai dificil de
dizolvat.
Aceasta duce la o soluţie neclară pentru determinarea
HPLC ce poate produce rezultate scăzute pentru triptofan.