ORDIN Nr. 1764
din 12 octombrie 2007
pentru modificarea si
completarea Normelor privind alimentele cu destinatie nutritionala speciala,
aprobate prin Ordinul ministrului sanatatii si familiei si al ministrului
agriculturii, alimentatiei si padurilor nr. 387/251/2002
ACT EMIS DE: MINISTERUL
SANATATII
ACT PUBLICAT IN:
MONITORUL OFICIAL NR. 783 din 19 noiembrie 2007
Văzând Referatul de aprobare al Autorităţii de Sănătate
Publică nr. 10.621 din 12 octombrie 2007 din cadrul Ministerului Sănătăţii
Publice,
având în vedere prevederile art. 13 din Ordonanţa de
urgenţă a Guvernului nr. 97/2001 privind reglementarea producţiei, circulaţiei
şi comercializării alimentelor, aprobată cu modificări şi completări prin Legea
nr. 57/2002,
în temeiul prevederilor Hotărârii Guvernului nr.
862/2006 privind organizarea şi funcţionarea Ministerului Sănătăţii Publice, cu
modificările şi completările ulterioare, ale Hotărârii Guvernului nr. 385/2007
privind organizarea şi funcţionarea Ministerului Agriculturii şi Dezvoltării
Rurale şi ale Hotărârii Guvernului nr. 130/2006 privind organizarea şi
funcţionarea Autorităţii Naţionale Sanitare Veterinare şi pentru Siguranţa
Alimentelor şi a unităţilor din subordinea acesteia, cu modificările şi
completările ulterioare,
ministrul sănătăţii publice, ministrul agriculturii
şi dezvoltării rurale şi preşedintele Autorităţii Naţionale Sanitare Veterinare
şi pentru Siguranţa Alimentelor emit următorul ordin:
Art. I. - Normele privind alimentele cu destinaţie nutriţională specială,
aprobate prin Ordinul ministrului sănătăţii şi familiei şi al ministrului
agriculturii, alimentaţiei şi pădurilor nr. 387/251/2002, publicat în Monitorul
Oficial al României, Partea I, nr. 926 din 18 decembrie 2002, cu modificările şi completările
ulterioare, se modifică şi se completează după cum urmează:
1. Articolul 8 se
modifică şi va avea următorul cuprins:
„Art. 8. -In sensul prezentelor norme se definesc:
a) sugari - copiii cu
vârsta mai mică de 12 luni;
b) copii de vârstă mică - copiii cu vârsta cuprinsă între un an şi 3 ani;
c) formule de început -
produsele alimentare destinate unei alimentaţii speciale a sugarilor în primele
luni de viaţă şi care îndeplinesc prin ele însele nevoile nutriţionale ale
acestor sugari până la introducerea unei alimentaţii complementare
corespunzătoare;
d) formule de continuare - produsele alimentare destinate unei alimentaţii speciale a
sugarilor atunci când se introduce o alimentaţie complementară corespunzătoare
şi care constituie principalul element lichid dintr-o alimentaţie diversificată
progresiv a acestor sugari;
e) reziduu de pesticid -
reziduul unui produs fitosanitar, astfel cum este definit în legislaţia privind
reziduurile de pesticide în produsele alimentare, inclusiv metaboliţii acestuia
şi produsele rezultate din degradarea sau reacţia acestuia, prezente în
formulele de început şi în formulele de continuare."
2. Articolul 9 se
modifică şi va avea următorul cuprins:
„Art. 9. - (1) Formulele de început şi formulele de
continuare pot fi
comercializate pe teritoriul României numai în cazul în care respectă
prevederile prezentului ordin.
(2) Niciun alt produs, în afara formulelor de început,
nu poate fi comercializat sau prezentat în alt mod, ca
fiind adecvat să îndeplinească în sine cerinţele nutriţionale ale sugarilor
sănătoşi normali, în primele luni de viaţă, până la introducerea alimentaţiei
complementare corespunzătoare.
(3) Formulele de început şi formulele de continuare nu
conţin nicio substanţă într-o cantitate care să pună în pericol sănătatea
sugarilor şi a copiilor de vârstă mică."
3. La articolul 10,
alineatele (1) şi (2) se modifică şi vor avea următorul cuprins:
„Art. 10. - (1) Formulele de început sunt produse, după caz, din sursele de proteine definite la pct.
2 din anexa nr. 1 şi din alte ingrediente alimentare, pentru care s-a stabilit,
prin date ştiinţifice general acceptate, că sunt corespunzătoare pentru o
alimentaţie specială a sugarilor, începând de la naştere. Această cerinţă se
demonstrează printr-o examinare sistematică a datelor disponibile referitoare
la avantajele estimate şi la aspectele de siguranţă, precum şi, după caz, prin
studii corespunzătoare, realizate în conformitate cu opiniile general acceptate
ale experţilor referitoare la conceperea şi realizarea acestor studii.
(2) Formulele de continuare sunt produse, după caz, din
sursele de proteine definite la pct. 2 din anexa nr. 2 şi din alte ingrediente
alimentare pentru care s-a stabilit, prin date ştiinţifice general acceptate,
că sunt corespunzătoare pentru o alimentaţie specială a sugarilor cu o vârstă
mai mare de 6 luni. Această cerinţă se demonstrează printr-o examinare
sistematică a datelor disponibile referitoare la avantajele estimate şi la
aspectele de siguranţă, precum şi, după caz, prin studii corespunzătoare,
realizate în conformitate cu opiniile general acceptate ale experţilor
referitoare la conceperea şi realizarea acestor studii."
4. Articolul 11 se
modifică şi va avea următorul cuprins:
„Art. 11. - (1) Formulele de început respectă
criteriile de compoziţie
stabilite în anexa nr. 1, ţinând seama de specificaţiile din anexa nr. 5. In
cazul formulelor de început produse din proteine din lapte de vacă, definite la
pct. 2.1 din anexa nr. 1, cu un conţinut de proteine cuprins între minim şi 0,5
g/100 kJ (2 g/100 kcal), adecvarea formulelor de început pentru alimentaţia
specială a sugarilor se demonstrează prin studii corespunzătoare, realizate în
conformitate cu orientările general acceptate ale experţilor referitoare la
conceperea şi realizarea acestor studii. In cazul formulelor de început produse
din hidrolizate proteice, definite la pct. 2.2 din anexa nr. 1, cu un conţinut
de proteine cuprins între minim şi 0,56 g/100 kJ (2,25 g/100 kcal), adecvarea
formulelor de început pentru alimentaţia specială a sugarilor se demonstrează
prin studii corespunzătoare, realizate în conformitate cu opiniile
general acceptate ale experţilor referitoare la conceperea şi realizarea acestor studii, şi este în
conformitate cu specificaţiile corespunzătoare stabilite în anexa nr. 13.
(2) Formulele de continuare respectă criteriile de
compoziţie stabilite în anexa nr. 2, ţinând seama de specificaţiile stabilite
în anexa nr. 5.
(3) Pregătirea formulelor de
început şi a formulelor de continuare pentru utilizare necesită, după caz,
numai adăugarea de apă.
(4) Se respectă interdicţiile şi limitările privind
utilizarea ingredientelor alimentare în formulele de început şi în formulele de
continuare stabilite în anexele nr. 1 şi 2."
5. Articolul 12 se
modifică şi va avea următorul cuprins:
„Art. 12. - (1) Numai substanţele enumerate în anexa
nr. 3 pot fi utilizate la
producerea de formule de început şi formule de continuare, în vederea
îndeplinirii cerinţelor privind:
a) substanţele minerale;
b) vitaminele;
c) aminoacizii şi alţi compuşi ai azotului;
d) alte substanţe cu un scop nutriţional specific.
(2) Pentru producţia de produse alimentare destinate
altor scopuri decât cele care fac obiectul prezentului ordin, se aplică
criteriile de puritate prevăzute în legislaţia comunitară referitoare la
utilizarea substanţelor enumerate în anexa nr. 3.
(3) Pentru substanţele pentru care nu sunt prevăzute
criterii de puritate în legislaţia comunitară, se aplică criteriile de puritate
general acceptate, recomandate de organismele internaţionale, până la adoptarea
unor astfel de criterii la nivel comunitar."
6. La articolul 13, alineatele (2), (3), (31) şi (32) se modifică şi vor avea următorul cuprins:
„(2) Formulele de început şi formulele de continuare nu
trebuie să conţină reziduuri ale diferitelor pesticide la niveluri mai mari de
0,01 mg/kg de produs recomandat a fi consumat ca atare sau reconstituit în
conformitate cu instrucţiunile producătorului.
(3) Pesticidele enumerate în anexa nr. 16 nu trebuie să
fie utilizate în cazul produselor agricole destinate producţiei de formule de
început şi de formule de continuare.
Cu toate acestea, în scopul controlului:
a) pesticidele enumerate în tabelul 1 din anexa nr. 16 se consideră ca nefiind utilizate în cazul în care
conţinutul de reziduuri al acestora nu depăşeşte 0,003 mg/kg. Acest nivel, care
este considerat limita de cuantificare a metodelor analitice, este revizuit în
mod periodic, ţinându-se seama de progresul tehnic;
b) pesticidele enumerate în tabelul 2 din anexa nr. 16
se consideră ca nefiind utilizate în cazul în care nivelurile de reziduuri ale
acestora nu depăşesc 0,003 mg/kg. Acest nivel este revizuit în mod periodic, în
funcţie de datele privind contaminarea mediului înconjurător.
(31) Prin derogare
de la prevederile alin. (2), pentru pesticidele enumerate în anexa nr. 17 se
aplică conţinutul maxim de reziduuri specificat în anexa respectivă.
(32) Conţinutul
menţionat la alin. (3) şi (31) se aplică produselor recomandate a fi
consumate ca atare sau reconstituite, în conformitate cu instrucţiunile
producătorilor."
7. Articolul 14 se
modifică şi va avea următorul cuprins:
„Art. 14. - (1) Cu excepţia cazului prevăzut la art. 14 alin. (2), denumirile sub care se
comercializează formulele de început şi formulele de continuare sunt,
respectiv:
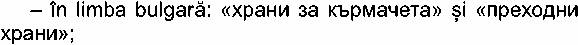
în limba spaniolă: «Preparado para
lactantes» şi «Preparado de continuacion»;
- în limba cehă: «pocatecni kojenecka vyziva» şi
«pokracovaci kojenecka vyziva»;
- în limba daneză: «Modermaelkserstatning» şi
«Tilskudsblanding»;
- în limba germană: «Săuglingsanfangsnahrung» şi
«Folgenahrung»;
- în limba estonă: «imiku
piimasegu» şi «ătkupiimasegu»;
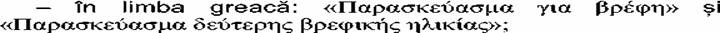
- în limba engleză: «infant formula» şi «follow-on formula»;
- în limba franceză: «Preparation pour nourrissons» şi
«Preparation de suite»;
- în limba italiană: «Alimento per lattanti» şi
«Alimento di proseguimento»;
- în limba letonă: «Maksligais maisijums zidainiem» şi
«Maksligais papildu edinăsanas maisijums zidainiem»;
- în limba lituaniană: «misinys kudikiams iki papildomo
maitinimo jvedimo» şi «misinys kudikiams, jvedus papildomq maitinimq»;
- în limba maghiară: «anyatej-helyettesîto tapszer» şi
«anyatejkiegeszito tapszer»;
- în limba malteză: «formula tat-trabi» şi «formula
tal-prosegwiment»;
- în limba olandeză: «Volledige zuigelingenvoeding» şi
«Opvolgzuigelingenvoeding»;
- în limba poloneză: «preparat do poczqtkowego zywienia
niemowlqt» şi «preparat do dalszego zywienia niemowlqt»;
- în limba portugheză: «Formula
para lactentes» şi «Formula de transigăo»;
- în limba română: «lapte de început» şi «lapte de
continuare»;
- în limba slovacă: «pociatocna dojcenska vyziva» şi
«nâsledna dojcenska vyziva»;
- în limba slovenă: «zacetna formula za dojencke» şi
«nadaljevalna formula za dojencke»;
- în limba finlandeză:
«Aidinmaidonkorvike» şi «Vieroitusvalmiste»;
- în limba suedeză: «Modersmjolksersăttning» şi
«Tillskottsnăring»;
(2) Denumirile sub care se comercializează formulele de
început şi formulele de continuare produse integral din proteine din lapte de
vacă sunt, respectiv:
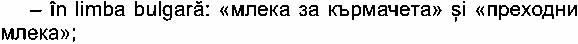
- în limba spaniolă: «Leche para lactantes» şi «Leche
de continuacion»;
- în limba cehă: «pocatecnu mlecna kojenecka vyziva» şi
«pokracovacu mlecna kojenecka vyziva»;
- în limba daneză: «Modermaelkserstatning udelukkende
baseret pâ maelk» şi «Tilskudsblanding udelukkende baseret pâ maelk»;
- în limba germană: «Săuglingsmilchnahrung» şi
«Folgemilch»;
- în limba estonă: «Piimal pohinev imiku piimasegu» şi
«Piimal pohinev jătkupiimasegu»;
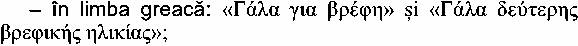
- în limba engleză: «infant milk»şi «follow-on milk»;
- în limba franceză: «Lait pour nourrissons» şi «Lait
de suite»;
- în limba italiană: «Latte per lattanti» şi «Latte di
proseguimento»;
- în limba letonă: «Makslugais piena maisijums
zîdainiem» şi «Maksligais papildu edinăsanas piena maisijums zidainiem»;
- în limba lituaniană: «pieno misinys kudikiams iki
papildomo maitinimo jvedimo» şi «pieno misinys kudikiams jvedus papildomq
maitinimq»;
- în limba maghiară: «tejalapu anyatej-helyettesito
tapszer» şi «tejalapu anyatej-kiegeszîto tâpszer»;
- în limba malteză: «fialib tat-trabi» şi «fialib
tal-prosegwiment»;
- în limba olandeză: «Volledige
zuigelingenvoeding op basis van melk» sau «Zuigelingenmelk»şi «Opvolgmelk»;
- în limba poloneză: «mleko
poczqtkowe» şi «mleko nastşpne»;
- în limba portugheză: «Leite para lactentes» şi «Leite
de transigăo»;
- în limba română: «lapte de început» şi «lapte de
continuare»;
- în limba slovacă: «pociatocnâ dojcenskâ mliecna
vyziva» şi «nâslednâ dojcenskâ mliecna vyziva»;
- în limba slovenă: «zacetno mleko za dojencke» şi
«nadaljevalno mleko za dojencke»;
- în limba finlandeză: «Maitopohjainen
ăidinmaidonkorvike» şi «Maitopohjainen vieroitusvalmiste»;
- în limba suedeză: «Modersmjolksersăttning uteslutande
baserad pâ mjolk» şi «Tillskottsnăring uteslutande baserad pâ mjolk».
(3) Etichetarea trebuie să cuprindă, în afara
cerinţelor legale privind etichetarea produselor alimentare, următoarele
menţiuni obligatorii:
a) în cazul formulelor de început, o menţiune care să precizeze că produsul este adecvat pentru
alimentaţia specială a sugarilor, începând de la naştere, atunci când nu sunt
alăptaţi;
b) în cazul formulelor de continuare, o menţiune care
să precizeze că produsul este adecvat numai pentru alimentaţia specială a
sugarilor în vârstă de peste 6 luni, că ar trebui să constituie doar o parte
dintr-o alimentaţie diversificată, că nu trebuie utilizat ca înlocuitor al
laptelui matern în primele 6 luni de viaţă şi că decizia de introducere a
alimentaţiei complementare, inclusiv orice excepţie până la vârsta de 6 luni,
nu ar trebui luată decât cu avizul specialiştilor în domeniul medicinei,
nutriţiei sau farmaciei ori al altor specialişti cu responsabilităţi în
îngrijirea mamei şi a copilului, pe baza nevoilor de creştere şi dezvoltare
specifice fiecărui sugar.
c) în cazul formulelor de început şi al formulelor de
continuare, valoarea energetică disponibilă, exprimată în kJ şi kcal, precum şi
conţinutul de proteine, carbohidraţi şi lipide, exprimat în formă numerică,
pentru 100 ml de produs gata de consum;
d) în cazul formulelor de început şi al formulelor de
continuare, cantitatea medie a fiecărei substanţe minerale şi a fiecărei
vitamine menţionate în anexa nr. 1 şi, respectiv, în anexa nr. 2, iar, după
caz, cantitatea de colină, de inositol şi de carnitină, exprimată în formă
numerică, pentru 100 ml de produs gata de consum;
e) în cazul formulelor de început şi al formulelor de
continuare, instrucţiuni pentru prepararea, depozitarea şi distrugerea
corespunzătoare a produsului, precum şi o avertizare cu privire la riscurile
pentru sănătate rezultate din preparare şi depozitare necorespunzătoare.
(4) Etichetarea poate să cuprindă următoarele menţiuni:
a) în cazul formulelor de început şi al formulelor de
continuare, cantitatea medie de nutrienţi menţionată în anexa nr. 3, atunci
când această menţiune nu este specificată la alin. (1) lit. d), exprimată în
formă numerică, pentru 100 ml de produs gata de utilizat;
b) în cazul formulelor de continuare, în afară de
informaţiile numerice, informaţii privind vitaminele şi mineralele incluse în
anexa nr. 8, exprimate ca procentaj din valorile de referinţă menţionate în
aceasta, pentru 100 ml de produs gata de consum.
(5) Etichetarea formulelor de început şi a formulelor
de continuare va fi concepută într-un mod care să furnizeze informaţiile
necesare cu privire la utilizarea corespunzătoare a produselor, astfel încât să
nu descurajeze alăptarea.
Utilizarea termenilor «umanizat», «maternizat»,
«adaptat» sau a termenilor similari este interzisă.
(6) Etichetarea formulelor de început conţine, de
asemenea, următoarele menţiuni obligatorii, precedate de cuvântul «Recomandare»
sau de echivalentul acestuia:
a) o menţiune referitoare la superioritatea alăptării;
b) o menţiune care recomandă utilizarea produsului
numai cu avizul persoanelor independente, calificate în domeniul medicinei,
nutriţiei sau farmaciei, ori al altor specialişti responsabili de îngrijirea
mamei şi a copilului.
(7) Etichetarea formulelor de început nu poate include imagini cu sugari, nici alte imagini sau texte care ar
putea idealiza utilizarea produsului. Cu toate acestea, etichetarea poate să
includă reprezentări grafice care să faciliteze identificarea produsului şi să
ilustreze metodele de preparare.
(8) Etichetarea formulelor de
început nu poate să conţină menţiuni nutriţionale şi referitoare la sănătate
decât în cazurile enumerate în anexa nr. 5 şi în conformitate cu condiţiile
stabilite în aceasta.
(9) Formulele de început şi formulele de continuare
sunt etichetate într-un mod care să permită consumatorilor să facă o distincţie
clară între aceste produse, astfel încât să se evite orice risc privind
apariţia oricărei confuzii între formulele de început şi formulele de
continuare.
(10) Cerinţele, interdicţiile şi restricţiile menţionate
la alin. (3)-(9) se aplică, de asemenea:
a) prezentării produselor în cauză, în special formei
şi aspectului acestora sau ambalajului, materialelor de ambalare utilizate,
modului în care sunt dispuse şi mediului în care sunt
expuse;
b) publicităţii."
8. Articolul 15 se
modifică şi va avea următorul cuprins:
„Art. 15. - (1) Publicitatea făcută formulelor de
început se limitează la publicaţiile specializate în puericultura şi la
publicaţiile ştiinţifice. România poate să impună şi alte restricţii sau
interdicţii acestei publicităţi. Publicitatea pentru formulele de început se
supune condiţiilor prevăzute la art. 14 alin. (3)-(9) şi la art. 14 alin. (10)
lit. (b) şi conţine numai informaţii de natură ştiinţifică şi faptică. Aceste
informaţii nu sugerează şi nici nu induc ideea că alimentaţia cu biberonul este
echivalentă sau superioară alăptării.
(2) In cazul formulelor de început, nu trebuie să se
practice publicitatea la punctele de vânzare sau de distribuire de eşantioane
ori să se aplice alte practici de promovare a vânzării directe către consumator
la nivelul comerţului cu amănuntul, precum etalări speciale, bonuri de
reducere, prime, vânzări speciale, vânzări în pierdere şi vânzări cuplate.
(3) Producătorii şi distribuitorii de formule de început
nu pot furniza marelui public, nici femeilor însărcinate, mamelor sau membrilor
familiei acestora produse gratuite ori cu preţ redus, eşantioane sau orice alte
cadouri de promovare, nici direct, nici indirect prin intermediul sistemului de
îngrijire a sănătăţii sau al lucrătorilor din acest sistem."
9. Articolul 16 se
modifică şi va avea următorul cuprins:
„Art. 16. - (1) România se asigură că sunt furnizate informaţii obiective şi coerente
referitoare la alimentaţia sugarilor şi a copiilor de vârstă mică, pentru a fi
utilizate de către familii şi de persoanele implicate în domeniul alimentaţiei
sugarilor şi a copiilor de vârstă mică, în materie de planificare,
aprovizionare, concepere şi difuzare de informaţii, precum şi de control al acestora.
(2) România se asigură că materialele de informare şi
educare, fie scrise, fie audiovizuale, care se referă la probleme de
alimentaţie a sugarilor şi care sunt destinate femeilor însărcinate şi mamelor
de sugari şi de copii de vârstă mică, includ informaţii clare privind toate aspectele enumerate în
continuare:
a) avantajele şi superioritatea alăptării;
b) nutriţia mamei, pregătirea pentru alăptare şi
continuarea acesteia;
c) posibilul efect negativ asupra alăptării, decurgând
din introducerea alimentaţiei parţiale cu biberonul;
d) dificultatea revenirii asupra deciziei de a nu
alăpta;
e) după caz, utilizarea corectă a formulelor de
început.
In cazul în care materialele respective conţin
informaţii cu privire la utilizarea formulelor de început, acestea trebuie să includă
şi implicaţiile sociale şi financiare ale acestei utilizări, riscurile pentru
sănătate ale alimentelor sau ale unor metode de alimentaţie improprii şi, în
special, riscurile pentru sănătate în cazul unei utilizări improprii a
formulelor de început. Aceste materiale nu trebuie să conţină nicio imagine de
natură să prezinte utilizarea formulelor de început ca fiind o soluţie ideală.
(3) România se asigură că donaţiile de materiale sau de
echipamente cu scop informativ sau educativ sunt efectuate de producători ori
distribuitori numai la cerere şi cu aprobarea scrisă a autorităţii naţionale
competente sau în cadrul orientărilor date de autoritatea respectivă în acest
scop. Aceste echipamente sau materiale pot purta denumirea ori sigla firmei
donatoare, dar nu pot face referire la o marcă specifică a unei formule de
început şi nu pot fi distribuite decât prin intermediul sistemului de îngrijire
a sănătăţii.
(4) România se asigură ca donaţiile sau vânzările cu
preţ redus ale stocurilor de formule de început către instituţii sau
organizaţii, fie în scopul utilizării în instituţii, fie în scopul distribuirii
în afara acestora, să nu se realizeze decât pentru sugarii care trebuie să fie
alimentaţi cu formule de început şi doar pentru perioadele prescrise pentru
aceşti sugari."
10. La anexa nr. 12
la norme în tabelul 1 privind elementele minerale, poziţia a 12-a se modifică
şi va avea următorul cuprins:
|
„Mangan (μg)
|
0,25
|
25
|
1
|
100"
|
11. La articolul 20 se introduce un nou alineat,
alineatul (2), cu următorul cuprins:
„(2) Criteriile de puritate a acestor substanţe vor fi
stabilite într-o fază ulterioară."
12. La articolul 22,
după alineatul (1) se introduce un nou alineat, alineatul (11), cu următorul cuprins:
„(11) Se vor stabili nivelele maxime necesare pentru substanţele, altele decât cele menţionate
la alin. (2) şi (4)."
13. La articolul 22,
alineatele (2) şi (4) se modifică şi vor avea următorul cuprins:
„(2) Alimentele pe bază de cereale prelucrate şi
alimentele pentru copii nu vor conţine reziduuri de pesticide individuale la
nivele care să depăşească 0,01 mg/kg, cu excepţia acelor substanţe pentru care
s-au stabilit nivele specifice în anexa nr. 18, caz în care se vor aplica
aceste nivele. Metodele analitice pentru determinarea nivelelor de reziduuri de pesticide vor fi metodele standardizate
general acceptate.
........................................................................................................................................................................ ........................................................
(4) Pesticidele listate în anexa nr. 18 nu vor fi
utilizate la produsele agricole destinate pentru
producerea alimentelor pe bază de cereale prelucrate şi a alimentelor pentru
copii.
Insă, în scopul controlului:
a) pesticidele listate în tabelul 1 din anexa nr. 18 se
consideră că nu au fost utilizate dacă reziduurile lor nu depăşesc un nivel de
0,003 mg/kg. Acest nivel, care este considerat a fi
limita de cuantificare a metodelor analitice, va fi revizuit în mod regulat, luându-se
în considerare progresul tehnic;
b) pesticidele listate în tabelul 2 din anexa nr. 18 se
consideră că nu au fost utilizate dacă reziduurile lor nu depăşesc un nivel de 0,003 mg/kg. Acest nivel va fi revizuit în mod regulat,
luându-se în considerare progresul tehnic."
14. La articolul 22,
după alineatul (5) se introduc două noi alineate, alineatele (6) şi (7), cu
următorul cuprins:
„(6) Pentru pesticidele cuprinse în anexa nr. 18, dacă
se ia o decizie privind neincluderea unei substanţe active în lista cu
substanţe autorizate pentru utilizarea produselor pentru protecţia plantelor pe
teritoriul României, aprobată prin Hotărârea Guvernului nr. 437/2005 privind
aprobarea Listei cu substanţele active autorizate pentru utilizare în produse
de protecţie a plantelor pe teritoriul României, cu completările ulterioare, se
modifică în consecinţă anexa nr. 18.
(7) Unde este cazul se vor stabili criterii
microbiologice."
15. La articolul 26,
alineatul (1) se modifică şi va avea următorul cuprins:
„Art. 26. - (1) Denumirile sub care vor fi vândute
produsele descrise la art. 24 sunt:

- în limba spaniolă: «Alimento dietetico para usos medicos especiales»
- în limba cehă: «Dietnî potravina ureena pro zvlastni
Iekaoske ueely»
- în limba daneză: «Levnedsmiddel/Levnedsmidler til
saerlige medicinske formal»
- în limba germană: «Diătetisches/Diătetische
Lebensmittel fur besondere medizinische Zwecke (Bilanzierte Diăten) »
- în limba estoniană: «Toit meditsiinilisel năidustusel
kasutamiseks»
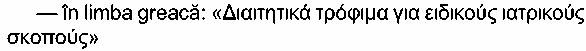
- în limba engleză: «Food(s) for special medical
purposes»
- în limba franceză: «Aliment(s) dietetique(s)
destine(s) â des fins medicales speciales»
- în limba italiană: «Alimento
dietetico destinata a fini medici speciali»
- în limba letonă: «Dietiska partika cilvekiem ar
veselibas traucejumiem»
- în limba lituaniană: «Specialios medicinines
paskirties maisto produktai»
- în limba maghiară: «Speciâlis -gyogyâszati celra szânt-tâpszer»
- în limba malteză: «Ikel dijetetiku ghal skopijiet
medici specifici»
- în limba olandeză: «Dieetvoeding voor medisch
gebruik»
- în limba poloneză: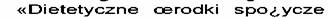 specjalnego
przeznaczenia medycznego»
specjalnego
przeznaczenia medycznego»
- în limba portugheză: «Produto dietetico de uso clînico»
- în limba română: «Alimente dietetice pentru scopuri
medicale speciale»
- în limba slovacă: «dietetickâ potravina na osobitne
lekârske ueely»
- în limba slovenă: «Dietno (dietetieno) zivilo za
posebne zdravstvene namene»
- în limba finlandeză:
«Kliininen ravintovalmiste/kliinisiă ravintovalmisteita»
- în limba suedeză: «Livsmedel for speciella medicinska
ăndamâl»."
16. La articolul 30,
alineatul (3) se modifică şi va avea următorul cuprins:
„(3) Etichetarea, publicitatea şi prezentarea
produselor în cauză nu trebuie să facă nicio referire la ritmul sau la
pierderea în greutate determinată de utilizarea lor."
17. După articolul
33 se introduc două noi articole, articolele 34 şi 35, cu următorul cuprins:
„Art. 34. - Produsele care nu se
conformează cerinţelor anexei nr. 15 mai pot fi comercializate pe teritoriul
României până la data de 31 decembrie 2009.
Art. 35. - Pentru a facilita monitorizarea oficială
eficientă pe teritoriul României a formulelor de început, atunci când un
operator din sectorul alimentar introduce o formulă de început pe piaţă, el
notifică acest lucru Ministerului Sănătăţii Publice, prin transmiterea unui
model de etichetă utilizată pentru produsul respectiv."
18. Anexele nr. 1, 2,
3, 5, 6, 8, 9 şi 11,16-18 la norme se modifică şi se înlocuiesc cu anexele nr.
1-11 care fac parte integrantă din prezentul ordin.
19. După anexa nr. 18 la norme se introduc două noi
anexe, anexele nr. 19 şi 20 la norme, conform anexelor nr. 12 şi 13 care fac
parte integrantă din prezentul ordin.
Art. II. - Noile cerinţe
stabilite la articolul I punctul
6 alineatele (1) şi (2) nu se aplică în mod obligatoriu alimentelor dietetice
cu scopuri medicale speciale destinate sugarilor, menţionate la punctul 4 din
anexa nr. 12 la Normele privind alimentele cu destinaţie nutriţională specială,
aprobate prin Ordinul ministrului sănătăţii şi familiei şi al ministrului agriculturii,
alimentaţiei şi pădurilor nr. 387/251/2002, cu modificările şi completările
ulterioare, înainte de 1 ianuarie 2012.
Art. III. - România
aplică prevederile prezentului ordin, astfel încât:
a) să permită comerţul cu produse conforme cu
prevederile prezentului ordin până cel târziu la data de 1 ianuarie 2008;
b) fără a aduce atingere art. Il, să interzică începând
cu data de 31 decembrie 2009 comerţul cu produse care nu sunt conforme cu
prevederile prezentului ordin.
Art. IV. - (1) Prezentul ordin transpune Directiva 2006/82/CE de adaptare a
Directivei 1991/321/CEE privind preparatele pentru sugari şi preparatele de
continuare şi a Directivei 1999/21/CE privind alimentele dietetice destinate
unor scopuri medicale speciale, ca urmare a aderării Bulgariei şi României,
publicată în Jurnalul Oficial al Comisiei Europene nr. L 82 din 23 octombrie
2006, Directiva Comisiei 2006/125/CE privind alimentele pe bază de cereale
prelucrate şi alimentele pentru sugari şi copii mici, publicată în Jurnalul
Oficial al Uniunii Europene nr. L 339/16 din 6 decembrie 2006, Directiva
2006/141/CE privind formulele de început şi formulele de continuare şi de
modificare a Directivei 1999/21/CE, publicată în Jurnalul Oficial al Comisiei
Europene nr. L 401/1 din 30 decembrie 2006, Directiva 2007/26/CE care
prelungeşte durata de aplicare a Directivei 2004/6/CE, publicată în Jurnalul
Oficial al Uniunii Europene nr. L 118/5 din 8 mai 2007, şi Directiva 2007/29 de
modificare a Directivei 96/8/CE în ceea ce priveşte etichetarea, publicitatea
şi prezentarea produselor alimentare destinate utilizării în dietele cu valoare
energetică redusă pentru scăderea în greutate, publicată în Jurnalul Oficial al
Uniunii Europene nr. L139/22 din 31 mai 2007.
(2) Prezentul ordin permite României să pună în
aplicare principiile şi obiectivele Codului internaţional de comercializare a
înlocuitorilor laptelui matern, care se referă la comercializarea, informarea
şi responsabilităţile autorităţilor sanitare.
(3) In sensul prezentului ordin, se aplică definiţiile
termenilor „menţiune", „menţiune nutriţională", „menţiune referitoare
la sănătate" şi „menţiune privind reducerea riscului de îmbolnăvire"
din Regulamentul (CE) nr. 1924/2006, art. 2 alin. (2), pct. 1, 4, 5 şi 6.
Art. V. - Prezentul ordin se publică în Monitorul Oficial al României,
Partea I, şi intră în vigoare
în termen de 30 de zile de la data publicării.
p. Ministrul sănătăţii publice,
Ervin-Zoltan Szekely,
secretar de stat
Ministrul agriculturii şi dezvoltării rurale,
Dacian Ciolos
p. Preşedintele Autorităţii Sanitare Veterinare şi
pentru Siguranţa Alimentelor,
Csutak-Nagy Laszlo
ANEXA Nr. 1 (Anexa nr. 1 la norme)
COMPOZIŢIA
ESENŢIALA
a formulelor de început atunci când sunt
reconstituite conform instrucţiunilor
producătorului
Valorile indicate în prezenta anexă se referă la
produsul final gata de consum, comercializat ca atare sau reconstituit conform
instrucţiunilor producătorului.
1. Energie
|
Minim
|
Maxim
|
|
250 kJ/100 ml
(60 kcal/100 ml)
|
295 kJ/100 ml
(70 kcal/100 ml)
|
2. Proteine
(Conţinutul de proteine = conţinutul de azot X 6,25)
2.1. Formule de început pe bază de proteine din lapte
de vacă:
|
Minimi)
|
Maxim
|
|
0,45 g/100 kJ
(1,8 g/100 kcal)
|
0,7 g/100 kJ
(3 g/100 kcal)
|
1) Formulele de
început pe bază de proteine din lapte de vacă cu un conţinut de proteine
cuprins între minim şi 0,5 g/100 kJ (2g/100 kcal) sunt conforme cu dispoziţiile
art. I, alin. 6 (1).
La o valoare energetică egală,
formula de început trebuie să conţină o cantitate disponibilă din fiecare
aminoacid indispensabil sau indispensabil în anumite condiţii cel puţin egală
cu cea conţinută în proteina de referinţă (laptele matern, astfel cum este
definit în anexa nr. 5 la norme*). Cu toate acestea, pentru calcule,
concentraţia de metionină şi cea de cistină se pot adăuga împreună, în cazul în
care raportul metionină/cistină nu depăşeşte 2, iar concentraţia de
fenilalanină şi cea de tirozină se pot adăuga împreună, în cazul în care
raportul tirozină/fenilalanină nu depăşeşte 2. Raportul metionină/cistină poate
fi mai mare de 2, dar nu poate depăşi 3, cu condiţia să se demonstreze, prin
studii corespunzătoare, realizate în conformitate cu opiniile general acceptate
ale experţilor privind conceperea şi realizarea acestor studii, că produsul
este adecvat pentru alimentaţia specială a sugarilor.
2.2. Formule de început pe bază de hidrolizate
proteice:
|
Minim1)
|
Maxim
|
|
0,45 g/100 kJ
(1,8 g/100 kcal)
|
0,7 g/100 kJ
(3 g/100 kcal)
|
1) Formulele de
început pe bază de hidrolizate proteice cu un conţinut de proteine cuprins între
minim şi 0,56 g/100 kJ (2,25g/100 kcal) sunt conforme cu dispoziţiile art. I, alin. 6 (1).
La o valoare energetică egală, formula de început
trebuie să conţină o cantitate disponibilă din fiecare aminoacid indispensabil
sau indispensabil în anumite condiţii cel puţin egală cu cea conţinută în
proteina de referinţă (laptele matern, astfel cum este definit în anexa nr. 5
la norme*). Cu toate acestea, pentru calcule, concentraţia de metionină şi cea
de cistină se pot adăuga împreună, în cazul în care raportul metionină/cistină
nu depăşeşte 2, iar concentraţia de fenilalanină şi cea de tirozină se pot
adăuga împreună, în cazul în care raportul tirozină/fenilalanină nu depăşeşte
2. Raportul metionină/cistină poate fi mai mare de 2, dar nu poate depăşi 3, cu
condiţia să se demonstreze, prin studii corespunzătoare, realizate în
conformitate cu opiniile general acceptate ale experţilor privind conceperea şi
realizarea acestor studii, că produsul este adecvat pentru alimentaţia specială
a sugarilor.
Conţinutul de L-carnitină trebuie să fie cel putin egal
cu 0,3 mg/100 kJ (1,2 mg/100 kcal).
2.3. Formule de început pe bază de izolate de proteine
din soia, singure sau în amestec cu proteine din lapte de vacă:
|
Minim
|
Maxim
|
|
0,56 g/100 kJ
(2,25 g/100 kcal)
|
0,7 g/100 kJ
(3 g/100 kcal)
|
La obţinerea acestor formule de început nu se folosesc
decât izolatele proteice din soia.
La o valoare energetică egală, formula de început
trebuie să conţină o cantitate disponibilă din fiecare aminoacid indispensabil
sau indispensabil în anumite condiţii cel puţin egală cu cea conţinută în
proteina de referinţă (laptele matern, astfel cum este definit în anexa nr. 5
la norme*). Cu toate acestea, pentru calcule, concentraţia de metionină şi cea
de cistină se pot adăuga împreună, în cazul în care raportul metionină/cistină
nu depăşeşte 2, iar concentraţia de fenilalanină şi cea de tirozină se pot
adăuga împreună, în cazul în care raportul tirozină/fenilalanină nu depăşeşte
2. Raportul metionină/cistină poate fi mai mare de 2, dar nu poate depăşi 3, cu
condiţia să se demonstreze, prin studii corespunzătoare, realizate în
conformitate cu opiniile general acceptate ale experţilor privind conceperea şi
realizarea acestor studii, că produsul este adecvat pentru alimentaţia specială
a sugarilor.
Conţinutul de L-carnitină trebuie să fie cel putin egal
cu 0,3 mg/100 kJ (1,2 mg/100 kcal).
2.4. In toate cazurile,
aminoacizii se pot adăuga în formulele de început doar pentru a îmbunătăţi
valoarea nutriţională a proteinelor şi doar în proporţiile necesare în acest
scop.
3. Taurină
In cazul în care se adaugă în formulele de început,
cantitatea de taurină nu trebuie să fie mai mare de 2,9 mg/100 kJ (12 mg/100
kcal).
4. Colină
|
Minim
|
Maxim
|
|
1,7 mg/100 kJ
(7 mg/100 kcal)
|
12 mg/100 kJ
(50 mg/100 kcal)
|
5. Lipide
|
Minim
|
Maxim
|
|
1,05 g/100 kJ
(4,4 g/100 kcal)
|
1,4 g/100 kJ
(6,0 g/100 kcal)
|
5.1. Se interzice utilizarea
următoarelor substanţe:
- ulei din seminţe de susan;
- ulei din seminţe de bumbac.
5.2. Acid lauric şi
acid miristic
|
Minim
|
Maxim
|
|
-
|
separat sau împreună: 20% din
conţinutul total de grăsimi
|
5.3. Conţinutul de izomeri trans
ai acizilor graşi nu trebuie să fie mai mare de 3%
din conţinutul total de grăsimi.
5.4. Conţinutul de acid erucic nu trebuie să fie mai
mare de 1% din conţinutul total de grăsimi.
5.5. Acid linoleic
(sub formă de gliceride = linoleaţi):
|
Minim
|
Maxim
|
|
70 mg/100 kJ
(300 mg/100 kcal)
|
285 mg/100 kJ
(1.200 mg/100 kcal)
|
5.6. Conţinutul de acid alfalinolenic trebuie să fie de
cel puţin 12 mg/100 kJ (50 mg/100 kcal).
Raportul acid linoleic/acid alfalinolenic trebuie să
fie de cel puţin 5, dar nu trebuie să depăşească 15.
5.7. Se pot adăuga acizi graşi polinesaturaţi (LCP) cu
catene lungi de 20 şi 22 de atomi de carbon. In acest caz, conţinutul lor nu
trebuie să depăşească:
- 1% din conţinutul total de grăsimi pentru LCP n-3; şi
- 2% din conţinutul total de grăsimi pentru LCP n-6 [1%
din conţinutul total de grăsimi pentru acidul arahidonic (20:4 n-6)].
Conţinutul de acid eicosapentaenoic (20:5 n-3) nu
trebuie să depăşească conţinutul de acid docosahexaenoic (22:6 n-3).
Conţinutul de acid docosahexaenoic (22:6 n-3) nu
trebuie să îl depăşească pe cel de LCP n-6.
6. Fosfolipide
Cantitatea de fosfolipide din formulele de început nu
trebuie să depăşească 2 g/l.
7. Inozitol
|
Minim
|
Maxim
|
|
1 mg/100 kJ
(4 mg/100 kcal)
|
10 mg/100 kJ
(40 mg/100 kcal)
|
8. Carbohidrati
|
Minim
|
Maxim
|
|
2,2 g/100 kJ
(9 g/100 kcal)
|
3,4 g/100 kJ
(14 g/100 kcal)
|
8.1. Se pot utiliza doar următorii carbohidraţi:
- lactoză;
- maltoză;
- Zaharoză;
- glucoza;
- malto-dextrine;
- sirop de glucoza sau sirop de glucoza deshidratat;
- amidon prefiert;
- amidon gelatinizat
8.2. Lactoză:
|
Minim
|
Maxim
|
|
1,1g/100kJ
(4,5 g/100 kcal)
|
-
|
Prezenta dispoziţie nu se aplică formulelor de început
în care izolatele din proteine din soia reprezintă mai mult de 50% din
conţinutul total de proteine.
8.3. Zaharoză:
Zaharoză nu se poate adăuga decât în formulele de
început pe bază de hidrolizate proteice. Atunci când se adaugă, conţinutul de
Zaharoză nu trebuie să depăşească 20% din conţinutul total de carbohidrati.
8.4. Glucoza:
Glucoza nu se poate adăuga decât în formulele de
început pe bază de hidrolizate proteice. Atunci când se adaugă, conţinutul de
glucoza nu trebuie să depăşească 0,5 g/100 kJ (2 g/100 kcal).
8.5. Amidon prefiert şi/sau amidon gelatinizat:
|
Minim
|
Maxim
|
|
-
|
2 g/100 ml şi 30% din conţinutul total
de carbohidraţi
|
9. Fructo-oligozaharide
şi galacto-oligozaharide
Fructo-oligozaharidele şi galacto-oligozaharidele pot
fi adăugate în formulele de început. In acest caz, conţinutul lor nu trebuie să
depăşească: 0,8 g/100 ml într-o combinaţie de 90% oligogalactozil-lactoză şi de
10% oligofructozil-zaharoză cu greutate moleculară mare.
Alte combinaţii şi conţinut maxim de fructo-oligozaharide
şi galacto-oligozaharide pot fi utilizate în conformitate cu art. I pct. 3 din ordin.
10. Substanţe
minerale
10.1. Formule de început pe bază de proteine din lapte
de vacă sau hidrolizate proteice:
|
|
Pentru 100 kJ
|
Pentru 100 kcal
|
|
Minim
|
Maxim
|
Minim
|
Maxim
|
|
Sodiu (mg)
|
5
|
14
|
20
|
60
|
|
Potasiu (mg)
|
15
|
38
|
60
|
160
|
|
Clorură (mg)
|
12
|
38
|
50
|
160
|
|
Calciu (mg)
|
12
|
33
|
50
|
140
|
|
Fosfor (mg)
|
6
|
22
|
25
|
90
|
|
Magneziu (mg)
|
1,2
|
3,6
|
5
|
15
|
|
Fier (mg)
|
0,07
|
0,3
|
0,3
|
1,3
|
|
Zinc (mg)
|
0,12
|
0,36
|
0,5
|
1,5
|
|
Cupru (μg)
|
8,4
|
25
|
35
|
100
|
|
Iod (μg)
|
2,5
|
12
|
10
|
50
|
|
Seleniu (μg)
|
0,25
|
2,2
|
1
|
9
|
|
Mangan (μg)
|
0,25
|
25
|
1
|
100
|
|
Fluorură (μg)
|
-
|
25
|
-
|
100
|
Raportul calciu/fosfor trebuie să fie de cel puţin 1,
dar să nu depăşească 2.
10.2. Formule de început pe bază de izolate din
proteine din soia, singure sau în amestec cu proteine din lapte de vacă:
Se aplică toate cerinţele de la pct. 10.1, cu excepţia
celor referitoare la fier şi la fosfor, care sunt următoarele:
|
|
Pentru 100 kJ
|
Pentru 100 kcal
|
|
Minim
|
Maxim
|
Minim
|
Maxim
|
|
Fier (mg)
Fosfor (mg)
|
0,12
7,5
|
0,5
25
|
0,45
30
|
2
100
|
11. Vitamine
|
|
Pentru 100 kJ
|
Pentru 100 kcal
|
|
Minim
|
Maxim
|
Minim
|
Maxim
|
|
Vitamina A (ug-RE)1)
|
14
|
43
|
60
|
180
|
|
Vitamina D (μg)2)
|
0,25
|
0,65
|
1
|
2,5
|
|
Tiamina (μg)
|
14
|
72
|
60
|
300
|
|
Riboflavină (μg)
|
19
|
95
|
80
|
400
|
|
Niacină (μg)3)
|
72
|
375
|
300
|
1.500
|
|
Acid pantotenic (μg)
|
95
|
475
|
400
|
2.000
|
|
Vitamina B6 (μg)
|
9
|
42
|
35
|
175
|
|
Biotină (μg)
|
0,4
|
1,8
|
1,5
|
7,5
|
|
Acid folie (μg)
|
2,5
|
12
|
10
|
50
|
|
Vitamina B12 (μg)
|
0,025
|
0,12
|
0,1
|
0,5
|
|
Vitamina C (mg)
|
2,5
|
7,5
|
10
|
30
|
|
Vitamina K (μg)
|
1
|
6
|
4
|
25
|
|
Vitamina E (mg a-TE)4)
|
0,5/g acizi
graşi polinesaturaţi
exprimaţi în
acid linoleic corectat pentru legături duble5
dar în niciun caz
mai puţin de 0,1 mg pentru 100 kJ disponibili
|
1,2
|
0,5/g acizi
graşi
polinesaturaţi exprimaţi în acid linoleic corectat
pentru legături duble5
dar în niciun caz
mai puţin de 0,5 mg
pentru 100 kcal
disponibile
|
5
|
1) RE = toţi
echivalenţii trans retinol.
2) Sub formă de
colecalciferol, din care 10 μg
= 400 LU. de vitamina D.
3) Niacină
preformată.
4) a-TE = echivalent
de d-a-tocoferol.
5) 0,5 mg a-TE/1 g
acid linoleic (18:2 n-6); 0,75 mg a-TE/1 g acid a-linolenic (18:3 n-3); 1,0 mg
a-TE/1 g acid arahidonic (20:4 n-6); 1,25 mg a-TE/1 g acid eicosapentaenoic
(20:5 n-3); 1,5 mg a-TE/1 g acid docosahexanoic (22:6 n-3).
12. Nucleotide
Se pot adăuga următoarele nucleotide:
|
|
Maxim1)
|
|
(mg/100 kJ)
|
(mg/100 kcal)
|
|
citidină 5'-monofosfat
|
0,60
|
2,50
|
|
u rid in 5'-monofosfat
|
0,42
|
1,75
|
|
adenozină 5'-monofosfat
|
0,36
|
1,50
|
|
guanozină 5'-monofosfat
|
0,12
|
0,50
|
|
inozină 5'-monofosfat
|
0,24
|
1,00
|
1) Concentraţia
totală de nucleotide nu trebuie să depăşească 1,2 mg/100 kJ (5 mg/100 kcal).
ANEXA Nr. 2 (Anexa nr. 2 la norme)
COMPOZIŢIA ESENŢIALĂ
a formulelor de continuare atunci când sunt
reconstituite conform instrucţiunilor
producătorului
Valorile indicate în prezenta anexă se referă la
produsul final gata de consum, comercializat ca atare sau reconstituit conform
instrucţiunilor producătorului.
1. Energie
|
Minim
|
Maxim
|
|
250 kJ/100 ml
(60 kcal/100 ml)
|
295 kJ/100 ml
(70 kcal/100 ml)
|
2. Proteine
(Conţinutul de proteine = conţinutul de azot x 6,25)
2.1. Formule de continuare pe bază de proteine din
lapte de vacă:
|
Minim
|
Maxim
|
|
0,45 g/100 kJ
(1,8 g/100 kcal)
|
0,8 g/100 kJ
(3,5 g/100 kcal)
|
La o valoare energetică egală, formula de continuare
trebuie să conţină o cantitate disponibilă din fiecare aminoacid indispensabil
sau indispensabil în anumite condiţii cel puţin egală cu cea conţinută în
proteina de referinţă (laptele matern, astfel cum este definit în anexa nr. 5
la norme). Cu toate acestea, pentru calcule, concentraţia de metionină şi cea
de cistină se pot adăuga împreună, în cazul în care raportul metionină/cistină
nu depăşeşte 3, iar concentraţia de fenilalanina şi cea de tirozina se pot
adăuga împreună, în cazul în care raportul tirozină/fenilalanină nu depăşeşte
2.
2.2. Formule de continuare pe bază de hidrolizate
proteice:
|
Minim
|
Maxim
|
|
0,56 g/100 kJ
(2,25 g/100 kcal)
|
0,8 g/100 kJ
(3,5 g/100 kcal)
|
La o valoare energetică egală, formula de continuare
trebuie să conţină o cantitate disponibilă din fiecare aminoacid indispensabil
sau indispensabil în anumite condiţii cel puţin egală cu cea conţinută în
proteina de referinţă (laptele matern, astfel cum este definit în anexa nr. 5
la norme). Cu toate acestea, pentru calcule, concentraţia de metionină şi cea
de cistină se pot adăuga împreună, în cazul în care raportul metionină/cistină
nu depăşeşte 3, iar concentraţia de fenilalanina şi cea de tirozina se pot
adăuga împreună, în cazul în care raportul tirozină/fenilalanină nu depăşeşte
2.
2.3. Formule de continuare pe bază de izolate de
proteine din soia, singure sau în amestec cu proteine din lapte de vacă:
|
Minim
|
Maxim
|
|
0,56 g/100 kJ
(2,25 g/100 kcal)
|
0,8 g/100 kJ
(3,5 g/100 kcal)
|
La obţinerea acestor formule nu
se folosesc decât izolatele de proteine din soia.
La o valoare energetică egală, formula de continuare
trebuie să conţină o cantitate disponibilă din fiecare aminoacid indispensabil
sau indispensabil în anumite condiţii cel puţin egală cu cea conţinută în
proteina de referinţă (laptele matern, astfel cum este definit în anexa nr. 5
la norme). Cu toate acestea, pentru calcule, concentraţia de metionină şi cea
de cistină se pot adăuga împreună, în cazul în care raportul metionină/cistină
nu depăşeşte 3, iar concentraţia de fenilalanina şi cea de tirozina se pot
adăuga împreună, în cazul în care raportul tirozină/fenilalanină nu depăşeşte
2.
2.4. In toate cazurile, aminoacizii se pot adăuga în
formulele de continuare numai pentru a îmbunătăţi valoarea nutritivă a
proteinelor şi numai în proporţiile necesare în acest scop.
3. Taurină
In cazul în care se adaugă în formulele de continuare,
cantitatea de taurină nu trebuie să depăşească 2,9 mg/100 kJ (12 mg/100 kcal).
4. Lipide
|
Minim
|
Maxim
|
|
0,96 g/100 kJ
(4,0 g/100 kcal)
|
1,4 g/100 kJ
(6,0 g/100 kcal)
|
4.1. Se interzice utilizarea următoarelor substanţe:
- ulei din seminţe de susan;
- ulei din seminţe de bumbac.
4.2. Acid lauric si acid miristic:
|
Minim
|
Maxim
|
|
-
|
separat sau împreună: 20% din
conţinutul total de grăsimi
|
4.3. Conţinutul de izomeri trans
ai acizilor graşi nu trebuie să depăşească 3% din
conţinutul total de grăsimi.
4.4. Conţinutul de acid erucic nu trebuie să
depăşească 1% din conţinutul total de grăsimi.
4.5. Acid linoleic (sub formă
de gliceride = linoleaţi):
|
Minim
|
Maxim
|
|
70 mg/100 kJ
(300 mg/100 kcal)
|
285 mg/100 kJ
(1.200 mg/100 kcal)
|
4.6. Conţinutul de acid alfalinolenic trebuie să fie de
cel puţin 12 mg/100 kJ (50 mg/100 kcal).
Raportul acid linoleic/acid alfalinolenic trebuie să fie de cel puţin 5, dar nu trebuie să depăşească
15.
4.7. Se pot adăuga acizi graşi polinesaturaţi (LCP) cu
catene lungi de 20 şi 22 de atomi de carbon. In acest caz, conţinutul lor nu
trebuie să depăşească:
- 1% din conţinutul total de grăsimi pentru LCP n-3; şi
- 2% din conţinutul total de grăsimi pentru LCP n-6 [1% din conţinutul total de grăsimi
pentru acidul arahidonic (20:4 n-6)].
Conţinutul de acid eicosapentaenoic (20:5 n-3) nu poate depăşi conţinutul de acid
docosahexaenoic (22:6 n-3).
Conţinutul de acid docosahexaenoic (22:6 n-3) nu trebuie să îl depăşească pe cel
de LCP n-6.
5. Fosfolipide
Cantitatea de fosfolipide din formulele de continuare
nu trebuie să depăşească 2 g/l.
6. Carbohidrati
|
Minim
|
Maxim
|
|
2,2 g/100 kJ
(9 g/100 kcal)
|
3,4 g/100 kJ
(14 g/100 kcal)
|
6.1. Se interzice utilizarea ingredientelor care conţin
gluten.
6.2. Lactoză:
|
Minim
|
Maxim
|
|
1,1 g/100 kJ
(4,5 g/100 kcal)
|
-
|
Prezenta dispoziţie nu se aplică formulelor de
continuare în care izolatele din proteine din soia reprezintă mai mult de 50%
din conţinutul total de proteine. 6.3. Zaharoză, fructoză, miere de albine:
|
Minim
|
Maxim
|
|
-
|
separat sau împreună:
20% din conţinutul total de
carbohidraţi
|
Mierea este tratată pentru a distruge sporii de Clostridium botulinum.
6.4. Glucoza
Glucoza nu poate fi adăugată decât în formulele de
continuare pe bază de hidrolizate proteice. Atunci când se adaugă, conţinutul
de glucoza nu trebuie să depăşească 0,5 g/100 kJ (2 g/100 kcal).
7. Fructo-oligozaharide
şi galacto-oligozaharide
Fructo-oligozaharidele şi galacto-oligozaharidele pot fi adăugate în formulele de continuare. In acest caz, conţinutul
lor nu trebuie să depăşească 0,8 g/100 ml într-o combinaţie de 90%
oligogalactozil-lactoză şi de 10% oligofructozil-zaharoza cu greutate
moleculară mare.
Alte combinaţii şi conţinut maxim de
fructo-oligozaharide şi galacto-oligozaharide pot fi utilizate în conformitate
cu art. I pct. 3 din ordin.
8. Substanţe minerale
8.1. Formule de continuare pe bază de proteine din
lapte de vacă sau hidrolizate proteice:
|
|
Pentru 100 kJ
|
Pentru 100 kcal
|
|
Minim
|
Maxim
|
Minim
|
Maxim
|
|
Sodiu (mg)
|
5
|
14
|
20
|
60
|
|
Potasiu (mg)
|
15
|
38
|
60
|
160
|
|
Clorură (mg)
|
12
|
38
|
50
|
160
|
|
Calciu (mg)
|
12
|
33
|
50
|
140
|
|
Fosfor (mg)
|
6
|
22
|
25
|
90
|
|
Magneziu (mg)
|
1,2
|
3,6
|
5
|
15
|
|
Fier (mg)
|
0,14
|
0,5
|
0,6
|
2
|
|
Zinc (mg)
|
0,12
|
0,36
|
0,5
|
1,5
|
|
Cupru (µg)
|
8,4
|
25
|
35
|
100
|
|
Iod (µg)
|
2,5
|
12
|
10
|
50
|
|
Seleniu (µg)
|
0,25
|
2,2
|
1
|
9
|
|
Mangan (µg)
|
0,25
|
25
|
1
|
100
|
|
Fluorură (µg)
|
-
|
25
|
-
|
100
|
Raportul calciu/fosfor în formulele de continuare nu
trebuie să fie mai mic de 1 şi nu trebuie să depăşească 2.
8.2. Formule de continuare pe bază de izolate din
proteine din soia, singure sau în amestec cu proteine din lapte de vacă:
Se aplică toate cerinţele de la pct. 8.1, cu excepţia
celor referitoare la fier şi la fosfor, care sunt următoarele:
|
|
Pentru 100 kJ
|
Pentru 100 kcal
|
|
Minim
|
Maxim
|
Minim
|
Maxim
|
|
Fier (mg) Fosfor (mg)
|
0,22 7,5
|
0,65 25
|
0,9 30
|
2,5 100
|
9. Vitamine
|
|
Pentru 100 kJ
|
Pentru 100 kcal
|
|
Minim
|
Maxim
|
Minim
|
Maxim
|
|
Vitamina A (µg-RE)1)
|
14
|
43
|
60
|
180
|
|
Vitamina D (µg)2)
|
0,25
|
0,75
|
1
|
3
|
|
Tiamina (µg)
|
14
|
72
|
60
|
300
|
|
Riboflavină (µg)
|
19
|
95
|
80
|
400
|
|
Niacină (µg)3)
|
72
|
375
|
300
|
1.500
|
|
Acid pantotenic (µg)
|
95
|
475
|
400
|
2.000
|
|
|
Pentru 100 kJ
|
Pentru 100 kcal
|
|
Minim
|
Maxim
|
Minim
|
Maxim
|
|
Vitamina B6 (µg)
|
9
|
42
|
35
|
175
|
|
Biotină (µg)
|
0,4
|
1,8
|
1,5
|
7,5
|
|
Acid folie (µg)
|
2,5
|
12
|
10
|
50
|
|
Vitamina B12 (µg)
|
0,025
|
0,12
|
0,1
|
0,5
|
|
Vitamina C (mg)
|
2,5
|
7,5
|
10
|
30
|
|
Vitamina K (µg)
|
1
|
6
|
4
|
25
|
|
Vitamina E (mg a-TE)4)
|
0,5/g acizi
graşi polinesaturaţi
exprimaţi în
acid linoleic corectat pentru legături duble5), dar în niciun caz mai puţin de 0,1 mg pentru 100 kJ
disponibili
|
1,2
|
0,5/g acizi
graşi polinesaturaţi
exprimaţi în
acid linoleic corectat pentru legături duble5), dar în niciun caz mai puţin de 0,5 mg
pentru 100 kcal
disponibile
|
5
|
1) RE = toţi
echivalenţii trans retinol.
2) Sub formă de
colecalciferol, din care 10 µg = 400 LU. de vitamina D.
3) Niacină
preformată.
4) α-TE = echivalent d-α-tocoferol.
5) 0,5 mg a-TE/1 g
acid linoleic (18:2 n-6); 0,75 mg a-TE/1 g acid α-linolenic (18:3 n-3); 1,0 mg a-TE/1 g acid arahidonic (20:4 n-6);
1,25 mg α-TE/1 g acid
eicosapentaenoic (20:5 n-3); 1,5 mg α-TE/1 g acid docosahexaenoic (22:6 n-3).
10. Nucleotide
Se pot adăuga următoarele nucleotide:
|
|
Maxim 1)
|
|
(mg/100 kJ)
|
(mg/100 kcal)
|
|
citidină 5'-monofosfat
|
0,60
|
2,50
|
|
uridin 5'-monofosfat
|
0,42
|
1,75
|
|
adenozină 5'-monofosfat
|
0,36
|
1,50
|
|
guanozină 5'-monofosfat
|
0,12
|
0,50
|
|
inozină 5'-monofosfat
|
0,24
|
1,00
|
1) Concentraţia
totală de nucleotide nu trebuie să depăşească 1,2 mg/100 kJ (5 mg/100 kcal).
ANEXA Nr. 3 (Anexa nr. 3 la norme)
SUBSTANŢE NUTRITIVE
1. Vitamine
|
Vitamina
|
Formula vitaminică
|
|
Vitamina A
|
Acetat de retinol
|
|
Palmitat de retinol
|
|
Retinol
|
|
Vitamina D
|
Vitamina D2 (ergocalciferol)
|
|
Vitamina D3 (colecalciferol)
|
|
Vitamina B1
|
Clorhidrat de tiamina
|
|
Mononitrat de tiamina
|
|
Vitamina B2
|
Riboflavină
|
|
Riboflavin-5'-fosfat de sodiu
|
|
Niacină
|
Nicotinamidă
|
|
Acid nicotinic
|
|
Vitamina B6
|
Clorhidrat de piridoxină
|
|
Piridoxin-5'-fosfat
|
|
Vitamina
|
Formula vitaminică
|
|
Folat
|
Acid folic
|
|
Acid pantotenic
|
D-pantotenat de calciu
|
|
D-pantotenat de sodiu
|
|
Dexpantenol
|
|
Vitamina B12
|
Cianocobalamină
|
|
Hidroxocobalamină
|
|
Biotină
|
D-Biotină
|
|
Vitamina C
|
Acid L-ascorbic
|
|
L-ascorbat de sodiu
|
|
L-ascorbat de calciu
|
|
Acid 6-palmitil-L-ascorbic (palmitat
|
|
de ascorbil)
|
|
Ascorbat de potasiu
|
|
Vitamina E
|
D-alfa-tocoferoi
|
|
DL-alfa-tocoferol
|
|
Acetat de D-alfa-tocoferol
|
|
Acetat de DL-alfa-tocoferol
|
|
Vitamina K
|
Filochinonă (Fitomenadionă)
|
2. Substanţe minerale
|
Substanţe minerale
|
Săruri autorizate
|
|
Calciu (Ca)
|
Carbonat de calciu
|
|
Clorură de calciu
|
|
Săruri de calciu ale acidului citric
|
|
Gluconat de calciu
|
|
Glicerofosfat de calciu
|
|
Lactat de calciu
|
|
Săruri de calciu ale acidului ortofosforic
|
|
Hidroxid de calciu
|
|
Magneziu (Mg)
|
Carbonat de magneziu
|
|
Clorură de magneziu
|
|
Oxid de magneziu
|
|
Săruri de magneziu ale acidului ortofosforic
|
|
Sulfat de magneziu
|
|
Gluconat de magneziu
|
|
Hidroxid de magneziu
|
|
Săruri de magneziu ale acidului citric
|
|
Fier (Fe)
|
Citrat feros
|
|
Gluconat feros
|
|
Lactat feros
|
|
Sulfat feros
|
|
Citrat feric de amoniu
|
|
Fumarat feros
|
|
Difosfat feric (Pirofosfat feric)
|
|
Bisglicinat de fier
|
|
Cupru (Cu)
|
Citrat de cupru
|
|
Gluconat de cupru
|
|
Sulfat de cupru
|
|
Complex cupru-lizină
|
|
Carbonat de cupru
|
|
Iod (I)
|
Iodură de potasiu
|
|
Iodură de sodiu
|
|
Iodat de potasiu
|
|
Zinc (Zn)
|
Acetat de zinc
|
|
Clorură de zinc
|
|
Lactat de zinc
|
|
Sulfat de zinc
|
|
Citrat de zinc
|
|
Gluconat de zinc
|
|
Oxid de zinc
|
|
Mangan (Mn)
|
Carbonat de mangan
|
|
Clorură de mangan
|
|
Citrat de mangan
|
|
Sulfat de mangan
|
|
Gluconat de mangan
|
|
Substanţe minerale
|
Săruri autorizate
|
|
Sodiu (Na)
|
Bicarbonat de sodiu
|
|
Clorură de sodiu
|
|
Citrat de sodiu
|
|
Gluconat de sodiu
|
|
Carbonat de sodiu
|
|
Lactat de sodiu
|
|
Săruri de sodiu ale acidului ortofosforic
|
|
Hidroxid de sodiu
|
|
Potasiu (K)
|
Bicarbonat de potasiu
|
|
Carbonat de potasiu
|
|
Clorură de potasiu
|
|
Săruri de potasiu ale acidului citric
|
|
Gluconat de potasiu
|
|
Lactat de potasiu
|
|
Săruri de potasiu ale acidului ortofosforic
|
|
Hidroxid de potasiu
|
|
Seleniu (Se)
|
Selenat de sodiu
|
|
Selenit de sodiu
|
3. Aminoacizi şi alţi
compuşi ai azotului
L-cistină şi clorhidratul său
L-histidină şi clorhidratul său
L-izoleucină şi clorhidratul său
L-leucină şi clorhidratul său
L-lizină şi clorhidratul său
L-cisteină şi clorhidratul său
L-metionină
L-fenilalanină
L-treonină
L-triptofan
L-tirozină
L-valină
L-carnitină şi clorhidratul său
L-carnitină-L-tartrat
Taurină
citidină 5'- monofosfat şi sarea sa de sodiu
uridin 5'- monofosfat şi sarea sa de sodiu
adenozină 5'- monofosfat şi sarea sa de sodiu
guanozină 5'- monofosfat şi sarea sa de sodiu
inozină 5'- monofosfat şi sarea sa de sodiu
4. Alte substanţe
nutritive
Colină
Clorură de colină
Citrat de colină
Bitartrat de colină
Inositol
ANEXA Nr. 4 (Anexa nr. 5 la norme)
AMINOACIZI
esenţiali şi semiesenţiali din laptele matern
In sensul prezentului ordin, aminoacizii din laptele
matern, esenţiali şi semiesentiali, exprimaţi în mg pentru 100 kJ şi 100 kcal,
sunt următorii:
|
|
Pentru 100 kJ 1)
|
Pentru 100 kcal
|
|
Cistină
|
9
|
38
|
|
Histidină
|
10
|
40
|
|
Izoleucină
|
22
|
90
|
|
Leucină
|
40
|
166
|
|
Lizină
|
27
|
113
|
|
Metionină
|
5
|
23
|
|
Fenilalanină
|
20
|
83
|
|
Treonină
|
18
|
77
|
|
Triptofan
|
8
|
32
|
|
Tirozină
|
18
|
76
|
|
Valină
|
21
|
88
|
1)1 kJ = 0,239 kcal.
ANEXA Nr. 5 (Anexa nr. 6 la norme)
COMPOZIŢIA IN AMINOACIZI A CASEINEI
(în g/100 g proteine)
|
Arginina
|
3,7
|
|
Cistina
|
0,3
|
|
Histidină
|
2,9
|
|
Isoleucina
|
5,4
|
|
Leucina
|
9,5
|
|
Lisina
|
8,1
|
|
Metionină
|
2,8
|
|
Fenilalanină
|
5,2
|
|
Treonină
|
4,7
|
|
Triptofan
|
1,6
|
|
Tirosina
|
5,8
|
|
Valina
|
6,7
|
ANEXA Nr. 6 (Anexa nr. 8 la norme)
VALORI DE REFERINŢĂ
pentru etichetarea nutriţională
a produselor alimentare destinate sugarilor şi copiilor de vârstă mică
|
Nutrient
|
Valoarea de referinţă pentru
etichetare
|
|
Vitamina A
|
(µg)400
|
|
Vitamina D
|
(µg) 7
|
|
Vitamina E
|
(mg TE) 5
|
|
Vitamina K
|
(µg) 12
|
|
Vitamina C
|
(mg) 45
|
|
Tiamina
|
(mg) 0,5
|
|
Riboflavină
|
(mg) 0,7
|
|
Niacină
|
(mg) 7
|
|
Vitamina B6
|
(mg) 0,7
|
|
Folat
|
(µg)125
|
|
Vitamina B12
|
(µg) 0,8
|
|
Acid pantotenic
|
(mg) 3
|
|
Biotină
|
(µg) 10
|
|
Calciu
|
(mg) 550
|
|
Fosfor
|
(mg) 550
|
|
Potasiu
|
(mg) 1.000
|
|
Sodiu
|
(mg) 400
|
|
Nutrient
|
Valoarea de referinţă pentru
etichetare
|
|
Clorură
|
(mg) 500
|
|
Fier
|
(mg) 8
|
|
Zinc
|
(mg) 5
|
|
Iod
|
(μg)80
|
|
Seleniu
|
(μg)20
|
|
Cupru
|
(mg) 0,5
|
|
Magneziu
|
(mg) 80
|
|
Mangan
|
(mg) 1,2
|
ANEXA Nr. 7 (Anexa nr. 9 la norme)
COMPOZIŢIA
esenţială a alimentelor pe bază de cereale
prelucrate pentru
sugari şi copii de vârstă mică
Cerinţele privind nutrienţii se referă la produsele
gata de consum comercializate ca atare sau reconstituite conform
instrucţiunilor producătorului.
1. Conţinutul de
cereale
Alimentele pe bază de cereale prelucrate se prepară în
primul rând din unul sau mai multe cereale măcinate şi/sau produse rădăcinoase
amilacee.
Cantitatea de cereale şi/sau rădăcină amilacee nu va fi
mai mică de 25% din mixtura finală în procente de greutate.
2. Proteine
2.1. Pentru produsele menţionate la art. 17 alin. (1)
lit. b) şi d) din norme, conţinutul de proteine nu va depăşi 1,3 g/100 kJ (5,5
g/100 kcal).
2.2. Pentru produsele menţionate la art. 17 alin. (1)
lit. b) din norme cantitatea de proteină adăugată nu va fi mai mică de 0,48
g/100 kJ (2 g/100 kcal).
2.3. Pentru biscuiţii
menţionaţi la art. 17 alin. (1) lit. d) din norme, făcuţi cu adăugarea unui
aliment cu conţinut ridicat de proteine şi prezentaţi ca atare, cantitatea de
proteină adăugată nu va fi mai mică de 0,36 g/100 kJ (1,5 g/100 kcal).
2.4. Indicele chimic al
proteinei adăugate va fi egal cel puţin cu 80% din cel al proteinei de
referinţă [caseina conform definiţiei din anexa nr. 5 (anexa nr. 6 la norme)]
sau rata de eficienţă a proteinei (PER) în amestec va fi egală cel puţin cu 70%
din cea a proteinei de referinţă. In toate cazurile, adăugarea de aminoacizi va
fi permisă numai în scopul ameliorării valorii nutritive a amestecului de
proteine, şi numai în proporţiile necesare în acest scop.
3. Hidraţii de
carbon
3.1. Dacă la produsele menţionate la art. 17 alin. (1)
lit. a) şi d)din norme se adaugă sucroză, fructoză, siropuri de glucoza sau
miere:
- cantitatea de hidraţi de carbon din aceste surse nu
va depăşi 1,8 g/100 kJ (7,5 g/100 kcal);
- cantitatea de fructoză adăugată nu va depăşi 0,9
g/100 kJ (3,75 g/100 kcal).
3.2. Dacă la produsele menţionate la art. 17 alin. (1)
lit. b) din norme se adaugă sucroză, fructoză, siropuri de glucoza sau miere:
- cantitatea de hidraţi de carbon din aceste surse nu
va depăşi 1,2 g/ 100 kJ (5 g/100 kcal);
- cantitatea de fructoză
adăugată nu va depasi 0,6 g/100 kJ (2,5 g/100 kcal).
4. Lipide
4.1. Pentru produsele menţionate la art. 17 alin. (1)
lit. a) şi d) din norme conţinutul de lipide nu va depăşi 0,8 g/100 kJ (3,3
g/100 kcal).
4.2. Pentru produsele menţionate la art. 17 alin. (1)
lit. b) din norme conţinutul de lipide nu va depăşi 1,1 g/100 kJ (4,5 g/100
kcal). In cazul în care conţinutul de lipide depăşeşte 0,8 g/100 kJ (3,3 g/100
kcal):
- cantitatea de acid lauric nu va depăşi 15% din
conţinutul total de lipide;
- cantitatea de acid miristic nu va depăşi 15% din
conţinutul total de lipide;
- cantitatea de acid linoleic (sub forma de gliceride =
linoleate) nu va fi mai mică de 70 mg/100 kJ (300 mg/100 kcal) şi nu va depăşi
285 mg/100 kJ (1200 mg/100 kcal).
5. Minerale
5.1. Sodiu
- Sărurile de sodiu se pot adăuga la alimentele
prelucrate pe bază de cereale numai în scop tehnologic.
- Conţinutul de sodiu al alimentelor prelucrate pe bază
de cereale nu va depăşi 25 mg/100 kJ (100 mg/100 kcal).
5.2. Calciu
5.2.1. Pentru produsele
menţionate la art. 17 alin. (1) lit. b) din norme, cantitatea de calciu nu va
fi mai mică de 20 mg/100 kJ (80 mg/100 kcal).
5.2.2. Pentru produsele menţionate la art. 17 alin.
(1) lit. d) din norme, realizate cu adaos de lapte (biscuiţi cu lapte) şi
prezentate ca atare, cantitatea de calciu nu va fi mai mică de 12 mg/100 kJ (50
mg/100 kcal).
6. Vitamine
6.1. Pentru alimentele pe bază de cereale prelucrate,
cantitatea de tiamina nu va fi mai mică de 25 ug/100 kJ (50 ug/100 kcal).
6.2. Pentru produsele
menţionate la art. 17 alin. (1) lit. b)
|
|
Per 100 kJ
|
Per 100 kcal
|
|
Minimum
|
Maximum
|
Minimum
|
Maximum
|
|
Vitamina A (μg
RE) 1)
Vitamina D (μg) 2)
|
14
0,25
|
43
0,75
|
60
1
|
180
3
|
|
1) RE = toţi echivalenţii trans
retinol
2) In forma de colecalciferol, din
care 10 μg = 400 i.u.
vitamina D.
|
Aceste limite se aplică şi dacă vitaminele Aşi D sunt
adăugate altor alimente pe bază de cereale prelucrate.
7. Limitele maxime
pentru vitamine, minerale şi elemente sub formă de urme, dacă sunt adăugate
Cerinţele privind nutrienţii se referă la produsele
gata de utilizare, comercializate ca atare sau reconstituite conform
instrucţiunilor producătorului, cu excepţia potasiului şi a calciului pentru
care cerinţele se referă la produsul vândut.
|
Nutrient
|
Maximum per 100 kcal
|
|
Vitamina A (μg
RE)
|
180
|
|
Vitamina E (mg a-TE)1)
|
3
|
|
Vitamina D (u g)
|
3
|
|
Vitamina C (mg)
|
12,5/25 2)
|
|
Tiamina (mg)
|
0,5
|
|
Riboflavin (mg)
|
0,4
|
|
Niacin (mg NE) 3)
|
4,5
|
|
Vitamina B6 (mg)
|
0,35
|
|
Acid folie (μg)
|
50
|
|
Vitamina B12 (μg)
|
0,35
|
|
Acid pantotenic (mg)
|
1,5
|
|
Biotin (Itg)
|
10
|
|
Potasiu (mg)
|
160
|
|
Calciu (mg)
|
80/1804)/1005)
|
|
Magneziu (mg)
|
40
|
|
Fier (mg)
|
3
|
|
Zinc (mg)
|
2
|
|
Cupru (μg)
|
40
|
|
Iod (Itg)
|
35
|
|
Mangan (mg)
|
0,6
|
1) a-TE = d- a
-tocoferol echivalent.
2) Limita
aplicabilă la produsele fortificate cu fier.
3) NE = Niacin
echivalent = mg acid nicotinic + mg triptofan/60.
4) Limita
aplicabilă la produsele menţionate la art. 17 alin. (1) lit. a) şi b).
5) Limita
aplicabilă la produsele menţionate la art. 17 alin. (1) lit. d).
ANEXA Nr. 8 (Anexa nr. 11 la norme)
LIMITELE MAXIME
pentru vitamine, minerale şi alte elemente sub formă
de urme, dacă
sunt adăugate
Cerinţele privind nutrienţii se referă la produsele
gata de utilizare, comercializate ca atare sau reconstituite conform
instrucţiunilor producătorului, cu excepţia potasiului si a calciului pentru
care cerinţele se referă la produsul vândut.
|
Nutrient
|
Maximum per 100 kcal
|
|
Vitamina A (μg
RE)
|
180 1)
|
|
Vitamina E (mg a-TE)
|
3
|
|
Vitamina C (mg)
|
12,5/25 2)/125 3)
|
|
Tiamina (mg)
|
0,25
|
|
Riboflavin (mg)
|
0,4
|
|
Niacin (mg NE)
|
4,5
|
|
Vitamina B6 (mg)
|
0,35
|
|
Acid folie (μg)
|
50
|
|
Vitamina B12 (μg)
|
0,35
|
|
Acid pantotenic (mg)
|
1,5
|
|
Biotin (Itg)
|
10
|
|
Potasiu (mg)
|
160
|
|
Calciu (mg)
|
80
|
|
Magneziu (mg)
|
40
|
|
Fier (mg)
|
3
|
|
Zinc (mg)
|
2
|
|
Cupru (μg)
|
40
|
|
Iod (Itg)
|
35
|
|
Mangan (mg)
|
0,6
|
1) In conformitate
cu prevederile pct. 5.
2) Limita
aplicabilă la produsele fortificate cu fier.
3) Limita
aplicabilă la alimentele pe bază de fructe, sucurile de fructe.
ANEXA Nr. 9 (Anexa nr. 16 la norme)
PESTICIDE
care nu pot fi utilizate în producţia agricolă
destinată producţiei
de formule de început şi de formule de continuare
Tabelul 1
|
Denumirea chimică a substanţei
(definiţia reziduului)
|
|
Disulfoton (suma dintre disulfoton, disulfoton sulfoxid şi
disulfoton sulfonă, exprimată ca disulfoton)
|
|
Fensulfotion (suma dintre fensulfotion,
analogul său oxigenat şi sulfonele lor, exprimată ca fensulfotion)
|
|
Fentin, exprimat în trifenilstaniu cation
|
|
Haloxifop (suma dintre haloxifop, sărurile şi esterii acestuia,
inclusiv conjugatele lor, exprimată ca haloxifop)
|
|
Heptaclor şi trans-heptaclor epoxid, exprimat ca heptaclor
|
|
Hexaclorbenzen
|
|
Nitrofen
|
|
Ometoat
|
|
Terbufos (suma dintre terbufos, sulfoxidul şi sulfona acestuia,
exprimată ca terbuf os)
|
Tabelul 2
|
Denumirea chimică a substanţei
|
|
Aldrin şi dieldrin, exprimate ca dieldrin
|
|
Endrin
|
ANEXA Nr. 10 (Anexa nr. 17 la norme)
CONŢINUTUL MAXIM
specific de reziduuri de pesticide sau de metaboliţi
de pesticide din formulele de început si
formulele de continuare
|
Denumirea chimică a substanţei
|
Conţinutul maxim de reziduuri
(mg/kg)
|
|
Cadusafos
|
0,006
|
|
Demeton-S-metil/demeton-S-metilsulfonă/ oxidemeton-metil (separat
sau combinate, exprimate ca demeton-S-metil)
|
0,006
|
|
Etoprofos
|
0,008
|
|
Fipronil (suma dintre fipronil şi fipronil-desulfinil, exprimată
ca fipronil)
|
0,004
|
|
Propineb/propilentiouree (suma dintre
propineb şi propilentiouree)
|
0,006
|
ANEXA Nr. 11 (Anexa nr. 18 la norme)
PESTICIDE
care nu vor fi utilizate în producţia agricolă
destinată producţiei de alimente pe bază de cereale prelucrate şi alimente pentru copii
Tabelul 1
|
Denumirea chimică a substanţei
(definiţia reziduului)
|
|
Disulfoton (suma de disulfoton, disulfoton sulfoxide şi
disulfoton sulfone exprimată ca disulfoton)
|
|
Fensulfotion (suma de fensulfotion, analogul său oxigenat şi
sulfonii lor, exprimată ca fensulfotion)
|
|
Fentin, exprimat ca trifeniltin cation
|
|
Haloxifop (suma de haloxifop, sărurile şi esterii săi, inclusiv
conjugaţii, exprimată ca haloxifop)
|
|
Heptaclor si frans-heptaclor epoxid, exprimat ca heptaclor
|
|
Hexaclorobenzen
|
|
Nitrofen
|
|
Ometoat
|
|
Terbufos (suma de terbufos, sulfoxizii si
sulfonii săi, exprimată ca terbufos)
|
Tabelul 2
|
Denumirea chimică a substanţei
|
|
Aldrin si dieldrin, exprimat ca dieldrin
|
|
Endrin
|
ANEXA Nr. 12 (Anexa nr. 19 la norme)
MENŢIUNI NUTRIŢIONALE
şi referitoare la sănătate pentru formulele de
început şi condiţiile care garantează menţiunea corespunzătoare
1. MENŢIUNI NUTRIŢIONALE
|
Menţiune nutriţională referitoare
la
|
Condiţii care garantează menţiunea
nutriţională
|
|
1.1 Numai lactoză
1.2 Fără lactoză
1.3 Adaos de LCP sau o menţiune
nutriţională echivalentă referitoare la adaos de acid docosahexaenoic
|
Lactoză este singurul carbohidrat
prezent.
Conţinutul de lactoză nu depăşeşte
2,5 mg/100 kJ (10 mg/100 kcal).
Conţinutul de acid docosahexaenoic nu
este mai mic de 0,2% din conţinutul total de acizi graşi.
|
|
Menţiune nutriţională referitoare
la
|
Condiţii care garantează menţiunea
nutriţională
|
|
1. 4 Menţiuni nutriţionale privind adaosul următoarelor
ingrediente facultative: 1.4.1 taurină
|
|
|
1.4.2 fructo-oligozaharide şi galacto-oligozaharide
1.4.3 nucleotide
|
Adăugate în mod voluntar într-o proporţie adaptată alimentaţiei
speciale a sugarilor şi în
conformitate cu condiţiile stabilite
în anexa nr. 1.
|
2. MENŢIUNI
REFERITOARE LA SĂNĂTATE (INCLUSIV MENŢIUNILE PRIVIND REDUCEREA RISCURILOR DE
ÎMBOLNĂVIRE)
|
Menţiune referitoare la sănătate
|
Condiţii care garantează menţiunea referitoare la sănătate
|
|
2.1 Reducerea riscului de alergie la proteinele din lapte.
Această menţiune poate include termeni referitori la o proprietate alergenică
sau antigenică redusă.
|
a) trebuie să fie disponibile date obiective şi verificate din
punct de vedere ştiinţific care să dovedească proprietăţile afirmate;
b) formulele de început îndeplinesc dispoziţiile prevăzute în
anexa nr. 1 pct. 2.2, iar cantitatea de proteine imunoreactive, măsurată prin
metode general acceptate ca fiind corespunzătoare, trebuie să fie mai mică de
1% din substanţele cu conţinut de azot din formule;
c) eticheta precizează că produsul nu trebuie să fie consumat de
către sugarii alergici la proteinele intacte din care este produsă formula,
cu excepţia cazului în care testele clinice general acceptate dovedesc că
formula de început este tolerată de mai mult de 90% din sugarii (interval de
încredere de 95%) cu hipersensibilitate la proteinele din care este obţinut
hidrolizatul;
d) formulele de început administrate pe cale orală nu trebuie să
provoace reacţii de sensibilizare animalelor cărora le sunt administrate
proteinele intacte din care s-au obţinut formulele de început.
|
ANEXA Nr. 13 (Anexa nr.20 la norme)
SPECIFICAŢII
privind conţinutul şi sursa de proteine, precum şi
prelucrarea proteinelor
utilizate în producţia de formule de început, cu un conţinut de proteine mai mic de 0,56 g/100
kj (2,25 g/100 kcal), pe bază de hidrolizate proteice din zer, derivate din proteine din lapte de vacă
1. Conţinutul de proteine
Conţinutul de proteine = conţinutul de azot x 6,25
|
Minim
|
Maxim
|
|
0,44 g/100 kJ
(1,86 g/100 kcal)
|
0,7 g/100 kJ
(3 g/100 kcal)
|
2. Sursa de proteine
Proteine din zer dulce
demineralizat, derivate din lapte de vacă după precipitarea enzimatică a
cazeinei cu ajutorul chimozinei, constând în:
a) 63% izolat de proteine din zer fără
cazeino-glicomacropeptide cu un conţinut minim de proteine de 95% din substanţa
uscată, o denaturare a proteinelor mai mică de 70% şi un conţinut maxim de
cenuşă de 3%; şi
b) 37% concentrat de proteine din zer dulce cu un
conţinut minim de proteine de 87% din substanţa uscată, o denaturare a
proteinelor mai mică de 70% şi un conţinut maxim de cenuşă de 3,5%.
3. Prelucrarea proteinelor
Procedeu de hidroliză în două etape care utilizează un
preparat din tripsină şi cuprinde o etapă de tratament termic (care durează 3
până la 10 minute la temperatura de 80-100°C) între cele două etape de
hidroliză.